黄花蒿Dof基因家族鉴定及在GA-UV处理下对青蒿素生物合成的影响*
2022-09-29王星文马婷玉尹青岗师玉华
王星文,邬 兰,马婷玉,尹青岗,师玉华,向 丽
(中药鉴定与安全性评估重点实验室/中国中医科学院中药研究所 北京 100700)
Dof(DNA binding with one finger)家族是一类植物特有的转录因子家族,可通过与启动子结合或者与特定蛋白相互作用来调控基因表达,参与多种植物生理过程的调控[1]。Dof蛋白N-末端共有一个高度保守的,由52 个氨基酸组成的Dof 结构域,其中核心基序CX2CX21CX2C与Zn2+共价结合形成的单锌指结构,可以特异性的识别并结合下游基因启动子序列中核心基序为“T/AAAAG”的元件,但也有如南瓜AOBP基因,仅可以与“AGTA”核心的基序结合;Dof蛋白C-端的转录调控结构域保守性低,氨基酸序列多变,主要作用是蛋白-蛋白结合互作,因此Dof家族在参与调控的途径上存在较大差异,功能也具有多样性[2-4]。自第一个Dof 蛋白ZmDof1 在玉米中被鉴定以来,Dof 家族已在拟南芥、水稻、番茄、白菜、菊花等[5-9]多种植物中被鉴定,主要参与光响应调控[10-11]、光周期调控[12-13]、植物激素和非生物胁迫信号通路传导[14-15]、糖代谢[16]、氮代谢[17]、种子发育[18]和细胞周期调控[19]等复杂植物生理过程。如Xu 等研究发现拟南芥Dof 家族基因AtOBP4(OBF BINDING PROTEIN 4)参与调控细胞周期进程,可以抑制细胞的生长和增殖,致使植株生长出现矮化、少花等明显缺陷[19]。另有一类Dof 家族基因AtCDFs(CYCLING DOF FACTOR)广泛参与到光周期调控中[13],过表达AtCDF1基因的拟南芥植株表现为早花表型[20];而在番茄中AtCDFs的同源基因SlCDFs不仅参与光周期开花调控,对植株在干旱、高盐等非生物胁迫下的耐受性也有增强作用[12]。AtDAG1(DOF AFFECTING GERMINATION 1)突变的拟南芥种子对红光敏感,受光敏色素B(phytochrome B,phyB)基因的调控,可降低种子萌发过程中对红光与赤霉素(Gibberellic acid,GA)的需求量,并参与负调控光介导的下胚轴生长过程[18,21]。AtOBP3(OBF4 BINDING PROTEIN 3)受水杨酸(Salicylic acid, SA)与生长素的影响,同时也是phyB下游调控因子,且受到隐花色素1调控,其突变体在蓝光下子叶生长明显大于野生型[10]。综上可见,Dof 家族转录因子是响应光和激素胁迫的重要调控因子,极大的参与到植物生理活动中。而植物代谢产物,尤其是作为药用活性成分的次生代谢产物也多是因响应外界逆境信号而累积[22]。因此,探究转录水平上植物光和激素的响应调控网络,对理解和进一步深入研究植物次生代谢产物生物合成机制尤为重要。
青蒿来源于菊科植物黄花蒿(Artemisia annua)的干燥地上部分,是我国的传统中药,具有清虚热、除骨蒸等功效,其主要活性成分青蒿素及其衍生物是联合国推荐的抗疟一线药物。而除治疗疟疾外,青蒿素及其衍生物在治疗红斑狼疮等免疫性疾病方面也有突出作用[23]。黄花蒿是青蒿素提取的主要原料药材,目前对于青蒿素的生物合成途径也已有了许多研究,其中非生物胁迫及生物胁迫均对其具有促进作用[24-25]。课题组前期研究发现在红光和蓝光处理后,黄花蒿中青蒿素的含量明显提升[26]。GA 和紫外线B(UV-B)处理也对青蒿素生物合成具有正向影响作用,协同促进了植株体内青蒿素的积累[22]。Dof 家族蛋白广泛参与植物响应非生物胁迫的复杂调控过程,但在黄花蒿中还未被系统鉴定与分析。基于其家族功能进行推测,AaDof 家族极有可能通过光与激素等响应途径影响黄花蒿体内青蒿素的生物合成。因此,本研究基于黄花蒿基因组及转录组数据,对黄花蒿中Dof 家族进行鉴定,并对其理化性质、系统进化发育、保守结构、GA 和UV-B 胁迫下的基因表达模式等进行分析,以期为深入探索Dof 家族功能、进一步解析青蒿素生物合成调控网络提供参考依据。
1 材料与方法
1.1 材料
本研究所用黄花蒿种质为课题组于海南收集的野生黄花蒿品种。种子播种后在光周期16/8 h,温度25°C 的温室中培养4 周。以100 μmol·L-1GA 和2 W/m2UV-B 灯(275-320 nm,Huaqiang)进行胁迫处理,对照组不进行任何处理。GA、UV-B 处理及GA+UV-B协同处理6 h 后采集幼苗的所有地上部分,每10 株混合为一个重复,每个处理取三个生物学重复。材料经液氮速冻后保存于-80℃备用。
1.2 黄花蒿Dof家族鉴定及序列分析
本研究基于黄花蒿(Artemisia annua)基因组数据(PRJNA416223)。经在线网站iTAK(http://itak.feilab.net/)检索后获得候选AaDof 蛋白序列,通过Pfam 数据库(http://pfam.sanger.ac.uk/search)鉴定各序列结构域模型完整性,去除重复及结构不完整序列。然后利用ExPASy Proteomic Server (http://expasy. org/tools/protparam.html)对序列蛋白质理化性质进行预测,并通过在线软件ProtComp 9.0(http://linux1.softberry.com/berry. phtml? topic=protcomppl&group=programs&subgroup=proloc)进行亚细胞定位分析。
1.3 多序列比对及进化分析
将鉴定的AaDof 序列与拟南芥全部36 个AtDof 序列及水稻和番茄中部分同源Dof蛋白序列进行聚类分析[5,8],采用MEGA X 中CLUSTALW 工具进行多重序列比对分析,利用邻接法(Neighbor-Joining,NJ)构建系统发育树,校验参数Bootstrap 重复次数设置为1000次。AaDof 序列自身以同样方法建树分析。以EvolView(https://www. evolgenius. info/evolview/#login)进行可视化修饰。
1.4 基因结构及蛋白保守结构分析
通过DNAMAN 对AaDof 蛋白进行序列比对分析,并 通 过MEME(http://meme-suite.org/tools/meme)和NCBI-CDD(https://www. ncbi. nlm. nih. gov/Structure/bwrpsb/bwrpsb.cgi)对AaDof 家族成员蛋白保守结构域进行检索。使用TBtools提取基因结构数据,并进行可视化分析。
1.5 启动子序列结合元件分析
提取基因组中AaDof基因上游2000bp 序列,提交至 PlantCARE (http://bioinformatics. psb. ugent. be/webtools/plantcare/html/)进行分析,筛选并合并响应元件标签后应用TBtools软件进行可视化。
1.6 基因表达模式分析与实时荧光定量PCR验证
基因表达模式分析所用数据为课题组前期获得的GA 和UV-B 处理前后黄花蒿转录组数据[22]。采用TBtools 软件对AaDof基因在GA、UV-B 及GA+UV-B协同胁迫下的表达模式进行热图分析,并以GA+UVB 组和对照组的AaDof基因表达量(FPKM 值)数据差异倍数≥2.0为阈值筛选差异表达基因。
以AaActin[26]为内参基因进行实时荧光定量PCR(qRT-PCR)验证。样品总RNA 提取方法参照EASYspin Plus Plant RNA Kit(Aidlab Biotechnologies)试剂盒步骤,总RNA 反转录第一链cDNA 使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TransGen Biotech)试剂盒方法。qRT-PCR 引物通过Primer Premier 3.0 软件设计(表1),并利用Primer-BLAST(http://ncbi.nlm.nih.gov./tools/primer-BLAST)进行引物序列特异性分析。qRT-PCR体系参照TransStart Green qPCR SuperMix UDG(Transgene)体系:Mix10.0 μL,正向引物0.3 μM,反向引物0.3 μM,cDNA 1.0 μL,ddH2O 8.4 μL。qRT-PCR在Rotor-GeneQ(Qiagen)仪器上进行,程序为:94℃预变性10 min;95℃、10 s,60℃、15 s,72℃、20 s,40 个循环;熔解曲线分析程序:95℃、15 s,60℃、1 min,95℃、15 s。
2 结果
2.1 黄花蒿Dof家族鉴定及理化性质分析
本研究从黄花蒿基因组数据中提取黄花蒿CDS序列,经iTAK在线网站检索后初步获得91条AaDof候选序列。以Pfam 数据库进行鉴定后去除冗余,最终共鉴定出51 个AaDof 蛋白,均具有完整的zf-Dof 结构域(表2)。特征分析发现,AaDof家族蛋白氨基酸长度在115 aa-453 aa,分子量为12.8-49.4 KDa,理论等电点在4.43-10.31,亲水指数均为负数,显示为亲水性蛋白,不 稳 定 系 数 除AaDof21、AaDof24、AaDof29、AaDof38 外均大于40,表明大部分AaDof 为不稳定蛋白。亚细胞定位预测结果显示,39个基因定位于细胞核,占大多数。12 个基因定位在细胞外,分布在除C2.1外的所有亚族中,其中C3亚族的所有序列均显示为细胞外定位,这可能与其参与调控的功能机制密切相关[27]。
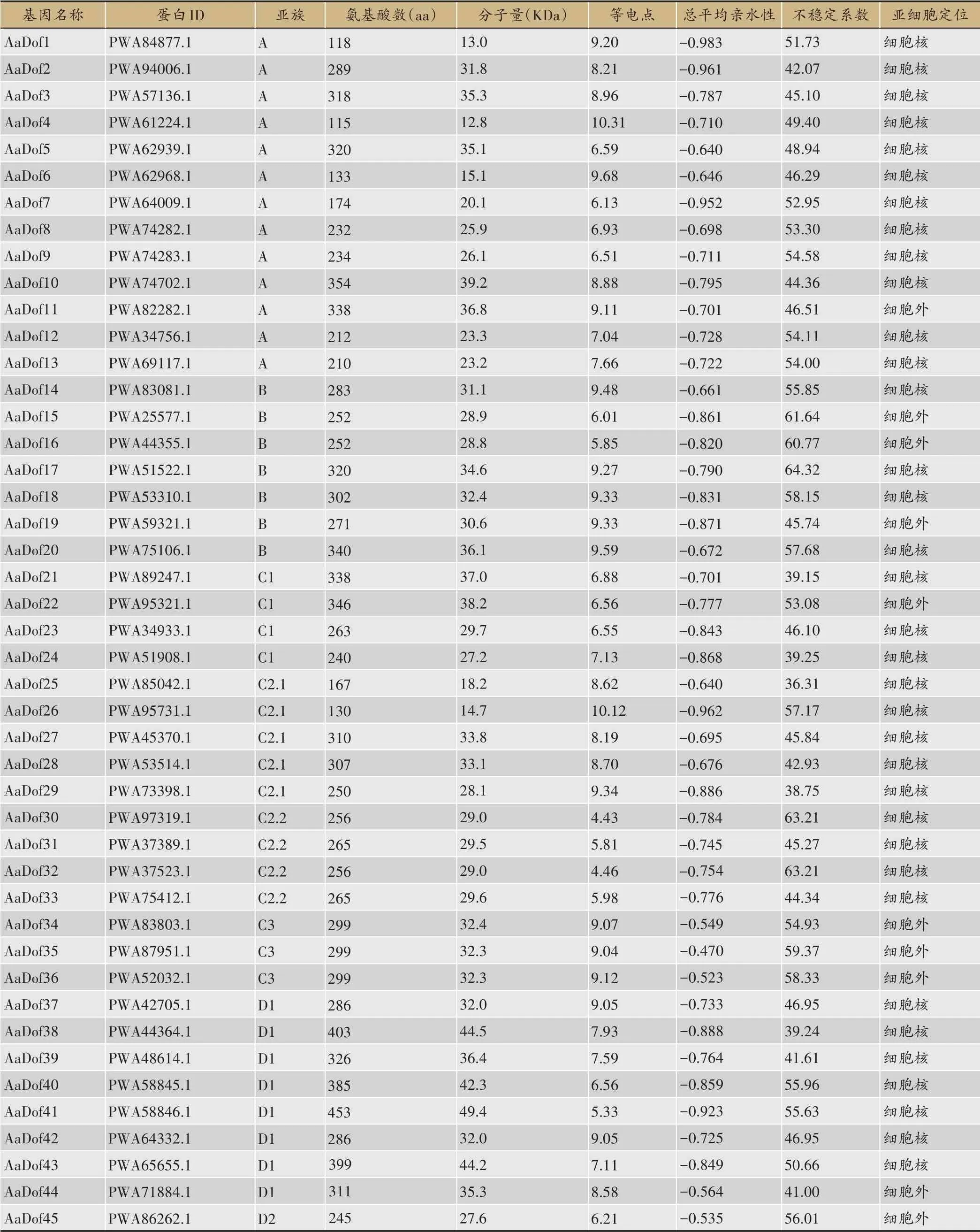
表2 黄花蒿Dof家族基本信息
2.2 黄花蒿Dof家族系统进化分析
将AaDof 蛋白序列与36 个拟南芥Dof 序列及部分水稻和番茄[5,8]中报道的Dof 序列进行同源对比,并以邻接法构建系统发育树。聚类结果显示AaDof序列易与自身聚为一支,具有较高的保守性,此外较多与番茄Dof 序列聚为一支,显示二者进化更为相似。依据Lijavetzky 等[5]分类方法将AaDof 分为A、B、C1、C2.1、C2.2、C3、D1、D2 8 个亚族,并基于亚族顺序进行重命名。A 亚族成员有13 个,相比拟南芥中3 个,水稻中4个,黄花蒿中A 亚族可能发生了复制事件。B 亚族成员共有7个,C1、C2.1、C2.2和C3亚族成员分别有4个、5 个、4 个和3 个,D1 和D2 亚族成员则分别有9 个和7个。同一亚族的Dof 蛋白功能具有相似性,依据进化树聚类可预测其功能。
2.3 黄花蒿Dof家族的结构分析
多序列对比显示AaDof 蛋白中Dof 结构域非常保守(图2),除固定的C2-C2结构外,结构域中其他氨基酸分布也极为相似,与前人研究结果一致[8]。经CDD数据库检索分析,AaDof 家族除了zf-Dof 结构域外,AaDof46与AaDof49序列N-端还分别存在锌指超家族N-端和SRPBCC 超家族C-端的部分结构域、AaDof44序列C-端存在Dimer_Tnp_hAT 结构域,其是HAT 超家族C-端二聚化结合域,在蛋白结合互作途径上可能具有参考意义。经MEME 进行保守motif 分析共检索到12 个motif,其中所有AaDof 序列均含有motif1,为Dof 保守结构域,其余motif 大部分都在C-端,基序多变但在亚族间相对保守,推测为不同蛋白结合域。C2.2 亚组均含有motif5,C3 亚族均含有motif4、motif7、motif8 和motif9,C1 亚族大部分共有motif12,D1 亚族大部分共有motif2 和motif4,D2 大部分共有motif3,这些保守结构使亚族间功能趋于相似。基因结构分析显示AaDof基因存在内含子较少,基本仅含有0-2 个,AaDof46含有3 个。其中AaDof21和AaDof4中均含有一个异常的大内含子,还需通过实验进一步验证(图3)。
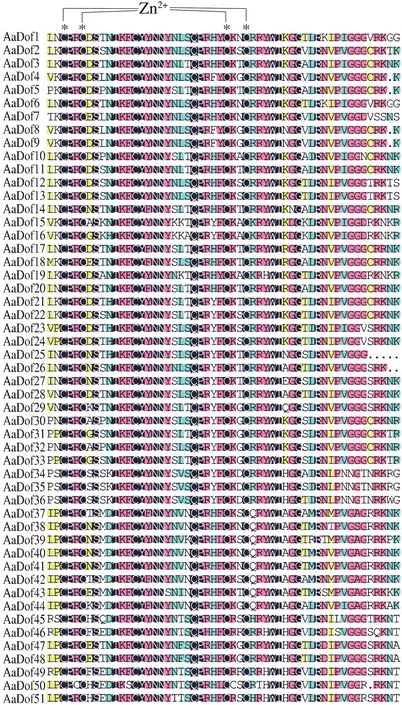
图2 黄花蒿Dof家族保守结构域分析

图3 黄花蒿Dof家族结构域与基因结构分析

续表
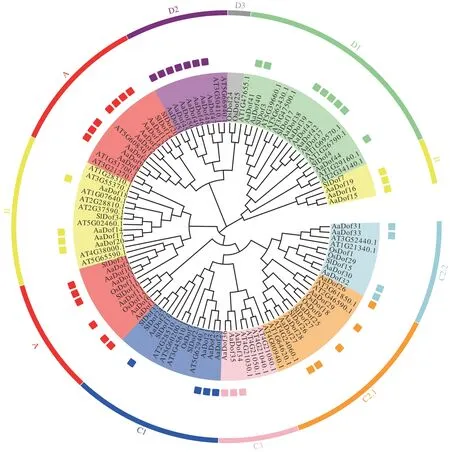
图1 黄花蒿Dof家族蛋白系统进化分析
2.4 黄花蒿Dof家族启动子结合元件分析
对AaDof启动子区序列进行分析,其中AaDof12和AaDof47基因启动子区域因基因组拼接问题不足2000 bp(图4)。所有启动子区域均存在SA、GA、脱落酸(Abscisic acid, ABA)、茉莉酸(Jasmonic acid, JA)等多种激素响应元件以及低温、干旱等环境因子响应元件,尤其如D 亚族AaDof40、AaDof41等基因启动子区域响应元件较多,可能参与到复杂的调控网络中。A亚族、C2.1、C2.2 和C3 亚族基因的启动子区富含如GBox(CACGTT)、GT1-motif(GGTTAA)等参与光相关调控的元件,其功能可能也与光调控相关。另外AaDof启动子区还存在MYB转录因子家族结合域,细胞周期及种子发育等功能相关响应元件,有待进一步分析。本结果将为AaDof基因的功能预测提供支持。

图4 黄花蒿Dof基因启动子作用元件分析
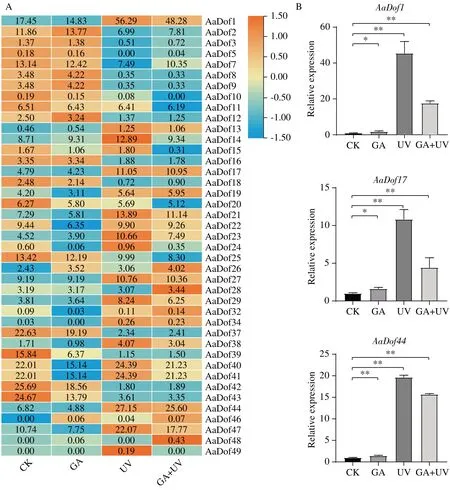
注:A:基因表达热图分析;B:差异基因的qRT-PCR验证,±SD,n=3,*P<0.05,**P<0.01。
2.5 黄花蒿Dof家族基因的表达模式分析
课题组前期研究结果表明GA 与UV-B 处理都对黄花蒿中青蒿素含量具有提升作用,其中6 h 时GA+UV-B 处理作用最明显,测得青蒿素含量最高[22]。因此基于GA、UV-B 及GA+UV-B 协同处理下6h 的转录组数据对AaDof的表达模式进行分析(图5)。结果发现,41 个AaDof基因有表达且受UV-B 胁迫影响明显。A 亚族除AaDof1和AaDof13外均在UV-B 胁迫下表达下调,C1 亚族和C2.1 亚族的大部分成员在UV-B 胁迫下表达上调。B 与D 亚族表达模式复杂,但大部分基因也都响应UV-B 调控,尤其AaDof14和AaDof49,仅在UV-B 胁迫下表达有上调。此外,部分基因也响应GA 胁迫,AaDof26、AaDof46在GA 胁迫下表达上调,AaDof15、AaDof22、AaDof40、AaDof41在GA 胁迫下表达下调,均可能密切参与到GA 激素调控网络中。而AaDof28、AaDof48基因仅在GA+UV-B 协同处理下高表达,这些Dof基因可能参与更加复杂的调控过程。余下10 个AaDof基因未检测到表达,其中A 亚族基因2 个,D2 亚族基因3 个。C2.2 和C3 两亚族均只有1 个基因检测到微量表达,分别为AaDof32和AaDof34。基于GA+UV-B 胁迫处理下表达量数据和具体FPKM 进行筛选,A 亚 族AaDof1、B2 亚 族AaDof17和D1 亚 族AaDof443 个基因表达上调倍数大于2。qRT-PCR 验证结果发现,这3 个基因在UV-B 处理下表达量显著上调,而在GA 处理下表达量也有上升,与转录组测定数据存在一定差异但趋势一致。
3 讨论
本文对黄花蒿基因组进行分析,共鉴定出51 个Dof 家族转录因子。研究报道拟南芥中Dof 家族基因有36 个[5]、白菜中有76 个[7]、菊花中有20 个[7],可见Dof家族在不同植物中数目差异较大。特征分析发现AaDof 家族蛋白大部分为亲水不稳定蛋白。亚细胞定位预测结果则发现有23%的AaDof基因未定位在细胞核,而是定位分泌在细胞外,或可能于过氧化物酶体、叶绿体、高尔基体等细胞器中表达,这些基因的功能或许也存在特异性[27]。对Dof 家族蛋白保守结构和基因结构的分析显示,AaDof 家族进化过程非常保守,Dof 结构域核心基序在不同物种间也极为相似。蛋白保守基序具有多样性,但在亚族间相对一致,这也是亚族中基因功能具有相似性的基础。此外,一些AaDof 蛋白如AaDof1、AaDof6 虽然含有保守的Dof 结构域,但是氨基酸长度小于200aa,仍需要进一步克隆验证。根据Lijavetzky 等[5]分类方法将AaDof 家族分为A、B、C1、C2.1、C2.2、C3、D1、D2 8 个亚族,其中A 亚族与B 亚族均有一支被分出且没有与拟南芥Dof 序列聚类,而是与水稻和番茄Dof序列相似度更高,这些基因显示出不同的进化趋势,在功能上可能也与原亚族有一定区别。进一步根据蛋白序列同源性对其功能进行预测,发现AaDof家族基因可能参与细胞周期、光和激素等多种调控过程中。光敏色素A(phytochrome A,phyA)和phyB基因受红光和远红光诱导表达,参与调控幼苗的去黄化以及种子中GA和ABA激素调控等生理过程。拟南芥中AT1G29160.1(AtCOG1)参与phyA和phyB信号通路下游调控。D1 亚族中AaDof44 与其聚为一支,可能为黄花蒿中COG1 的同源基因并具有类似功能[11]。其余D1 亚族成员则与AtCDFs 聚为一支,可能参与到光周期及非生物胁迫相关调控中[12]。AT2G46590.1(DAG1)也为phyB下游调控因子,在种子萌发过程中起重要作用,C2.1 亚族AaDof29 与其聚为一支,因此AaDof29 功能可能与红光响应和种子发育相 关 调 控 有 关[18,21]。 而AaDof18 与AT3G55370.1(AtOBP3)聚为一支,推测其功能与AtOBP3相似,可能也响应SA 和红蓝光,参与植株下胚轴与子叶的生长调节过程中[10]。启动子区的响应元件分析也是预测基因功能的重要手段。通过对AaDof序列上游2000 bp的启动子区域进行分析,发现AaDof基因可能广泛参与到植物激素和光等调控网络中。其中,A、C2.1、C2.2和C3亚族基因启动子序列富含光调控元件,其亚族功能可能也与光密切相关。
植物响应外界环境信号进而调控体内次生代谢产物合成积累,Dof 家族作为光与植物激素响应调控途径上重要转录因子家族,也极有可能参与到黄花蒿体内青蒿素等次生代谢产物的合成调控中。目前已证实水稻OsDof3基因参与赤霉素靶基因的调控,Yamamoto 等进一步将其鉴定为Dof蛋白P-box 结合因子(PBF),其可与bZIP 转录因子协同互作,调控水稻种子中蛋白储存[28-29]。草莓中FaDOF2通过与MYB 转录因子FaEOBII结合参与果实中苯丙烷途径中丁香酚含量的调控,并受到果实中ABA 和生长素水平的调节[30]。本研究通过对黄花蒿GA 和UV-B 及二者协同处理下转录组数据进行分析,发现大部分AaDof基因都在胁迫下表达,尤其对UV-B 处理敏感,在GA+UVB 协同处理时UV-B 处理对基因表达影响占主导。A亚族大部分成员表达量响应UV-B 胁迫而下调,C1 亚族和C2.1亚族大部分成员表达量响应UV-B胁迫而上调,这些亚族基因均参与到UV-B响应调控过程中,与启动子序列分析结果较一致。同时也有部分基因仅响应GA 胁迫。此外,C2.2 和C3 亚族基本无表达,目前研究表明C3 亚族基因功能与植物分枝和种皮发育等有关,同时参与到拟南芥苯丙烷代谢途径中,可以沉默类黄酮成分生物合成相关基因表达,并促进下胚轴和花蕾中羟基肉桂酸的积累[31-32],本文分析可为黄花蒿中相关通路后续研究提供参考依据。对差异基因进行qRT-PCR 验证结果显示AaDof1、AaDof17、AaDof44均响 应GA 和UV-B 处理,并在UV-B 胁迫下相对表达量显著上升。综合化学含量变化分析,这三个基因可能与黄花蒿中青蒿素生物合成有关,并起到正向调节作用。其中AaDof1 在进化分析中与AtOBP4同聚在A 亚族,功能可能与细胞周期调控相关,并可能参与到ABA 应答网络中[33]。B 亚族AaDof17 与拟南芥PEAR(PHLOEM EARLY DOF)类蛋白序列较为相似,该类蛋白可在胞间短距离移动,功能特异性调控细胞平周分裂并参与植物形成层发育[34]。D1 亚族AaDof44 与AtCOG 聚为一支,其响应GA 和UV-B 胁迫的表达模式与AtCOG 报道功能有一定相关性。这些基因序列均与拟南芥等模式植物基因存在较大差异,推测在黄花蒿中功能更具有特异性,并可能会更多参与到黄花蒿体内萜类代谢的复杂调控中[35-36]。而在GA+UV-B 协同处理时相对表达量较UV-B 处理时有所下降的情况,可能与UV-B和GA间复杂的调控抑制关系有关[37]。
青蒿素的生物合成途径涉及复杂的调控过程,是不同光质、JA、SA、ABA、GA 等激素共同作用的结果[38]。基于模式植物研究对一些基因在黄花蒿中同源序列功能的研究,也可能为青蒿素合成途径的进一步解析提供理论依据。如Zhuo 等[15]研究表明AtDof2.1(AT2G28510.1)是JA 激素调控途径的上游调控因子,可以直接结合MYC2的启动子,影响下游基因表达。Ma 等[39]发现了黄花蒿中涉及ABA 与JA 激素途径的两条转录因子调控网络,其下游调控因子AaTCP14/15对黄花蒿中青蒿素合成具有促进作用,而拟南芥中AtDof6被验证可与黄花蒿AaTCP14的同源基因AtTCP14互作[40]。本文从基因组水平系统鉴定了黄花蒿Dof 家族并对其特征和表达模式进行分析,为黄花蒿Dof家族基因功能与相关转录调控网络的进一步研究提供支持,并为转录水平上黄花蒿中青蒿素及其他次生代谢产物生物合成调控机制的解析提供参考。