刺五加β-香树脂醇合酶基因的挖掘及功能验证*
2022-09-29王亢宗李艳林郑宝江徐志超薛哲勇
李 敏,王亢宗,李艳林,宋 伟,郑宝江,徐志超,薛哲勇,华 欣
(东北林业大学生命科学学院 哈尔滨 150006)
刺五加(Eleutherococcus senticosus)为五加科五加属多年生落叶灌木,其根茎发达,茎常密布细刺,掌状复叶互生,伞形花序,浆果状核果[1];多分布于我国东北地区,是我国一种传统中药。根据《药典》记载,以其干燥的根,茎,根茎入药;其性味辛,苦,温,有益气健脾,补肾安神之功效。近年来的研究表明,刺五加具有多种药理作用,如抗炎[2],抗氧化[3],提高免疫能力[4],抗疲劳[5]以及抗癌等[6]。
刺五加富含多种活性代谢产物,包括三萜皂苷类,多糖类,黄酮类,酚酸类,香豆素,木脂素等小分子化合物,皂苷类化合物是刺五加的主要活性成分之一[7]。近年研究表明,刺五加皂苷具有抑制肿瘤细胞生长迁移[8],促进神经元树突扩展活性[9],影响细胞因子活性[10],增强细胞增殖能力[11]等多种生理活性,在食品医药等方面有良好的前景。然而,20世纪80年代初对刺五加自然资源的过度开采造成了刺五加自然资源的破坏,使刺五加被列为渐危物种[12];而刺五加皂苷结构较为复杂,在植物体中含量较低,使通过植物体分离提取、化学合成等手段获取刺五加皂苷相对困难,进而限制其应用。因此通过生物学与生物信息学手段,研究刺五加三萜皂苷生物合成路线,利用合成生物学方法获得三萜皂苷对解决刺五加皂苷来源问题具有重要意义。
刺五加中具有多种五环三萜皂苷,根据糖苷配基的类型,可以分为齐墩果烷型(oleanane),去甲齐墩果烷型(noroleanane),羽扇豆烷型(lupine)和3,4-半开环羽扇豆烷型(3,4-secolupane)等不同类型,其中齐墩果烷型和去甲齐墩果烷型的变体最多[13]。在植物体中三萜皂苷的前体来源于甲羟戊酸(MVA)途径和2-C-甲基-D-赤藓醇-4-磷酸(MEP)途径,以同为五加科的人参为例:异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)在香叶基焦磷酸合酶(GPS)的作用下缩合成香叶基焦磷酸(GPP),GPP 在法尼基焦磷酸合酶(FPS)的作用下与IPP 聚合成法尼基焦磷酸(FPP),两个FPP 经鲨烯合成酶(SS)缩合形成角鲨烯,角鲨烯在鲨烯氧化酶作用下环氧化为2,3-氧化鲨烯[14]。3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGR)是MVA 萜类合成途径的一个关键酶,在刺五加萜类物质的生物合成过程中起到重要的作用。研究发现,当截短的HMGR(tHMGR)基因在植物中过量表达时,萜类次生物质代谢反应产物的含量明显高于对照植株。因此,在植物中过量表达tHMGR成为生产倍半萜和三萜类物质的普遍适用的方法[15]。氧化鲨烯环化酶(oxidosqualene cyclase,OSC)是一个基因超家族,具有DCTAE 和QW 等保守序列,包含β-香树素合酶(β-Amyrin Synthase)、达玛烷二醇合酶(Dammarenediol Synthase)、环阿屯醇合酶(Cycloartenol Synthase)、羽扇豆醇合酶(Lupeol Synthase)、羊毛甾醇合酶(Lanosterol Synthase)等类型[16]。氧化鲨烯环化酶可催化2,3-氧化鲨烯经质子化、环化、重排、去质子化完成环化作用,生成三萜皂苷的前体。其中,齐墩果烷型三萜皂苷的生物合成是由β-香树素合酶参与完成的,2,3-氧化鲨烯经过β-香树素合酶作用以“椅-椅-椅”式环化生成β-香树素;CYP716A与CPR1家族基因发生连续氧化生成齐墩果酸;最后经过细胞色素P450 酶和糖基转移酶的修饰生成多种多样的三萜皂苷。目前包括人参、三七、越南人参在内的许多五加科植物中参与三萜皂苷环化和修饰的酶已经被鉴定[17-20],而刺五加中的三萜环化酶还没有被鉴定。本研究通过对刺五加基因组中潜在OSC进行系统发育分析,结构预测,表达定量及功能验证,挖掘了一个刺五加三萜环化酶EsOSC5,为刺五加皂苷生物合成通路的研究提供了重要支持和参考。
1 材料与方法
1.1 实验材料
刺五加种植于东北林业大学试验田,于2021 年6月采集根、叶、一年生内茎、一年生外茎、二年生内茎等作为实验材料。本氏烟草(Nicotiana benthamiana)用于基因瞬时表达实验。
1.2 实验试剂及仪器
RNA 提取试剂TRIzol Reagent(康为试剂生物公司)、反转录试剂盒(TAKARA 生物技术公司)、2×Rapid Taq Master Mix 高保真酶、胶回收试剂盒(OMEGA 公司)、ClonExpress ⅡOne Step Cloning Kit重组酶(Vazyme 生物公司)、质粒提取试剂盒(OMEGA公司)、农杆菌感受态细胞(GV3101)、pEAQ 植物表达载体(实验室保存菌种)、实时荧光定量试剂盒2*SYBR qPCR Master Mix(悠扬生物科技公司)。
PCR 仪(Eppendorf AG 22331 Hambury),分光光度计(V-1200 SPECTROPHOTOMETER),冷冻干燥机(SCIENTZ-10N,购于宁波新芝生物科技股份有限公司),Roche LC480荧光定量PCR仪。
1.3 刺五加EsOSC5基因的克隆及生物信息学分析
从PFAM 34.0下载OSCNC 端种子序列stockholm格式的比对结果(PF13243, PF13249),用于搜索OSC基因序列。通过HMMER 2.3.2 软件包的hummbuild脚本(默认参数)对种子序列建立HMM 模型,通过hmmsearch 脚本(默认参数)对预测的刺五加蛋白序列执行搜索,发现潜在OSC序列,并设计引物EsOSC5-F/R(表1)对EsOSC5基因进行克隆。以刺五加根的cDNA 为模板,使用2*Rapid Taq Master Mix 高保真酶进行PCR 扩增,体系为:95℃5 min;95℃15 s,58℃30 s,72℃1 min,32 个循环;72℃5 min;4℃保存。胶回收后与T5 载体连接,转化大肠杆菌DH5α,筛选阳性克隆测序。使用MEGAX 软件来构建EsOSC基因的系统进化树,在NCBI 中查找人参(Panax ginseng),胡萝卜(Daucus carota)具有不同功能的OSC基因,将刺五加假定EsOSC(EsOSC5)基因与人参,胡萝卜的已知OSC基因进行Align,Bootstrap 值设为1000,构建系统发育树。
使用在线软件SWISS-MODEL (expasy.org)对EsOSC5 进行同源建模,通过AutoDock 对蛋白质EsOSC5 和小分子2,3-氧化鲨烯进行分子对接,使用PyMOL进行可视化。
通过在线软件ExPASy - ProtParam tool 计算EsOSC5 的各种物理或化学参数,包括分子量、等电点、原子组成、不稳定性指数和疏水性。
使用MEGAX 对刺五加EsOSC5、人参PgOSC、拟南芥AtOSC 蛋白序列进行clustw 多序列比对,MEGAX clustw默认参数,ESPript可视化。
使用kallisto 0.46.2在默认参数下对预测的EsOSC定量,通过prism8.0 分析其组织特异性。通过实时荧光定量PCR 对转录组数据进行验证,设计引物qEsOSC5-F/R,内参基因actin-F/R(表1)。
1.4 刺五加EsOSC5基因表达载体的构建及瞬时表达实验
采用Gateway 的方法经过BP 反应将刺五加EsOSC5基因连接在pDONR-207 载体上,引物设计为attB-EsOSC5-F/R(表1)。将BP 反应的质粒通过LR反应连入pEAQ 载体,挑取阳性单克隆测序。本实验将燕麦(Avena sativa)中的HMGR(AstHMGR)基因截短后导入pEAQ 载体,以AstHMGR基因过表达烟草作为对照组,将测序正确的重组质粒pEAQ-EsOSC5、pEAQ-tHMGR分别转化到农杆菌GV3101 中摇菌培养,待两者菌液OD600值为0.2 时,6000 rpm 离心5 min集菌。使用Argomix 接种缓冲液(10 mM MgCl2,10 mM MES(pH=5.6),150 μM 乙酰丁香酮)分别对收集到的pEAQ-EsOSC5、pEAQ-tHMGR菌液重悬,将此两种悬浮菌液暗培养2 h 后注射于生长1 个月的本氏烟草叶片下表皮中,处理组及对照组均设置三个重复。
1.5 刺五加EsOSC5基因瞬时表达烟草代谢产物的测定
本实验通过菌液悬浮液侵染烟草并收集其代谢产物。pEAQ-EsOSC5、pEAQ-tHMGR菌液侵染烟草5-7 天之后,分别收集注射过的烟草叶片,通过GCQQQ-MS 仪器(Thermo Fisher Trace 1310ISQ,美国)测定次生代谢产物的成分及含量。将收集到的烟草叶片冻干、研磨之后分别称取10 mg粉末,加皂化剂1 mL(无水乙醇90%,超纯水10%,氢氧化钾10%,以1 mg·mL-1粪醇溶于DMSO作为内标:10 μL·mL-1),75℃皂化1 h后打开管盖,继续75℃加热至乙醇蒸发。向干燥的样品中加入500 μL 色谱级乙酸乙酯,并涡旋振荡,其后加入500 μL超纯水再次涡旋振荡。离心1 min使溶液分层(上层液体为黄色,下层液体为绿色)。取50 μL上层液(乙酸乙酯层)移至进样小瓶衬管中,旋干后重悬于50 μL 衍生化试剂TMA 咪唑(tri-Sil Z)中,70℃加热30 min,使用GC-QQQ-MS仪器检测代谢物。
色谱条件:色谱柱为ZB-5 HT(0.25 mm×30 m,Thermo Fisher scientific),载气为高纯氦气,流速为1.0 mL·min-1,进样口温度280℃,进样量为1 μL,分流比为20:1。程序升温:起始温度为170℃,5℃·min-1升温至290℃,保持4 min,25℃·min-1升温至340℃。质谱条件:电子能量为70 eV,质量扫描范围60-800。以β-香树脂醇(β-amyrin)为标准品,外标法定量。
2 结果
2.1 刺五加EsOSC5基因的克隆及生物信息学分析
测序结果表明,获得的刺五加EsOSC5(NCBI 登录号为OM681328)基因CDS 区最大开放阅读框ORF 全长为2286 bp,编码761个氨基酸,结果如图1所示。通过分析得出蛋白质EsOSC5的分子式为C3964H5983N1045O1118S45,分子量为87609.14,原子总数为12155,等电点为6.10,亲水性平均系数(GRAVY)-0.356,表明该蛋白具有疏水性,不稳定指数为50.83,表明该蛋白是不稳定的。

图1 刺五加EsOSC5基因克隆
由MEGAX 软件构建的刺五加、人参、胡萝卜的OSC蛋白系统进化树表明,刺五加EsOSC5蛋白与人参PgBASS2801.2有较高的同源性(图2),bootstrap 有99.4%的置信度,且二者进化程度相近。故刺五加EsOSC5蛋白可能与人参PgBASS2801.2有相似的功能,均为β-amyrin synthase。

图2 刺五加EsOSC5与人参,胡萝卜OSC的系统进化分析
本实验对EsOSC5,人参OSC及拟南芥OSC进行clustw 多序列比对,结果如图3 所示。DCTAE 基序在OSCs 中高度保守,是角鲨烯环氧化的起始序列,这个基序中的酸性羧基残基Asp释放质子攻击底物的末端环氧环,从而引发环形成的级联反应。MWCYCR基序是β- amyrin 合成酶的一个特征基序,其中,Trp 控制齐墩酰阳离子的稳定、Tyr 参与五环三萜的形成。QW基序则参与稳定OSC 的结构。SWISS-MODEL 是欧洲瑞士生物信息中心开发的蛋白质同源建模程序,提供全自动的计算流程,此类同源建模算法首先选定输入一级序列的同源蛋白结构,然后以同源蛋白的三维结构为模板利用理论计算方法进行优化[21]。本实验利用SWISS-MODEL 预测EsOSC5的蛋白结构,通过AutoDock 对蛋白质EsOSC5 和小分子2,3-氧化鲨烯进行分子对接(图4)。

图3 EsOSC5与人参和拟南芥的β-amyrin synthase的序列比对

图4 EsOSC5与2,3-氧化鲨烯分子对接
根据刺五加转录组数据,对EsOSC5 在不同组织中的表达水平通过prism8.0 进行分析。由图5 可知,相较于刺五加叶(LEAF),一年生内茎(1N),一年生外茎(1W)以及两年生内茎(2N),EsOSC5 在刺五加根(ROOT)中表达量明显提高,且该结果与实时荧光定量PCR 结果一致。因此,我们选取刺五加根的cDNA进行克隆基因,同时为后续代谢组的测定提供参考。
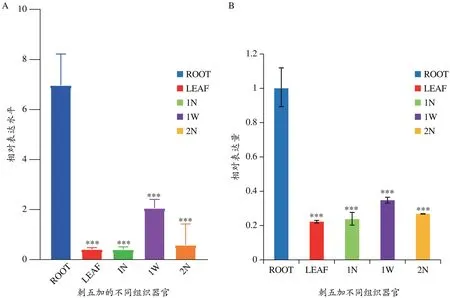
图5 刺五加中EsOSC5的组织特异性分析
2.2 刺五加EsOSC5基因瞬时表达烟草代谢产物的测定
经农杆菌介导的烟草瞬时表达实验,分别收集pEAQ-EsOSC5、pEAQ-tHMGR菌液侵染后的烟草叶片,其代谢产物组成及含量通过GC-QQQ-MS 进行测定分析。结果显示处理组(EsOSC5)的代谢物相比于对照组(tHMGR)产生了新的色谱峰,且与β-香树脂醇(β-amyrin)标准品的出峰时间一致,进一步对比二级质谱发现两者为同一种物质,即β-amyrin。由此表明,EsOSC5基因可促进刺五加β-amyrin(三萜皂苷)的合成积累,即β-amyrin 是由EsOSC5基因调控产生,该基因为刺五加β-香树脂醇合酶基因(图6)。

图6 GC/MS总离子流图谱
3 讨论
三萜皂苷是刺五加中一类重要的次生代谢产物,其优良的生理药理活性使之有可观的医用药用应用前景。但因其结构较复杂,且在植株中含量较低,使其通过传统的化学提取、合成量产较为困难。解析刺五加三萜皂苷的次生代谢途径,通过合成生物学的方法实现刺五加三萜皂苷工业化生成的意义不言而喻。三萜合酶在不同植物品系中的自然变异使从不同植物体中发现高效的氧化鲨烯环化酶成为可能,且为三萜生物代谢工程提供了新的活力。本研究挖掘并验证了一个主要在刺五加根中表达的催化刺五加中2,3-氧化鲨烯“椅-椅-椅”式环化形成刺五加三萜皂苷前体的β-香树素合酶基因——EsOSC5。Li L A 等研究表明人参β-amyrin synthase 在根中有较高的表达量,与我们的实验结果相符[22]。相较于亲缘关系更远的拟南芥β-amyrin synthase,EsOSC5和人参β-amyrin synthase 序列更为相似,他们具有一致的DCTAE 保守序列,和几乎一致的QW(QXXXGXW)保守序列,区别只在于于第三个QW 保守序列发生L->P的突变,它们同属疏水氨基酸,只有侧链上一个CH2的差异;拟南芥BAS 则与他们有更大的差异,除了每个QW 和DCTAE都具有一个以上的位点发生氨基酸性质变异,还存在氨基酸的增添和缺失。尽管如此,与β-amyrin synthase功能密切相关的473-489基序,特别是缬氨酸是保守的,这个氨基酸的突变会引起OSC 酶功能的改变,例如在拟南芥中V484→A484 可能会引起产物向camelliol C的转化[23-25]。
植物五环三萜类化合物主要通过甲羟戊酸途径和戊糖磷酸途径合成2,3-氧化鲨烯,之后在氧化鲨烯环化酶OSC 的作用下环化成不同的三萜骨架,最后在细胞色素P450(CYP)及糖基转移酶(UGT)的修饰下形成多种皂苷[26]。目前,本实验挖掘并鉴定了刺五加β-amyrin synthase 基因EsOSC5,为鉴定刺五加中其他OSC的功能提供了思路,同时为解析刺五加中三萜皂苷类化合物代谢途径及实现其生物合成奠定了基础。刺五加中富含多种三萜皂苷。例如:刺五加叶中齐墩果烷型三萜皂苷acanthopanaxosides A、B、C;3,4-开环- 羽扇豆烷型三萜皂苷 Inermoside,1-Deoxychiisanoside, 24-Hydroxychiisanoside, 11-deoxyisochiisanoside;羽 扇 豆 烷 型 三 萜 皂 苷Chiisanoside 和Daucosterol[27-29]。然而,我们对于参与刺五加三萜皂苷生物合成的细胞色素P450 及糖基转移酶尚不明确。相对于参与三萜皂苷次生代谢的CYP和UGT,OSC有着更为保守的序列及相对较小的家族分歧,这使得挖掘具有功能的OSC相较于CYP、UGT更为容易。而鉴定已知功能的OSC,有助于进一步挖掘参与同一通路的CYP和UGT;一方面,协同行使代谢功能的不同基因,其表达水平可能存在连锁;另一方面,这些功能基因可能在进化的某一时期聚集,形成生物合成基因簇(BGCs),或者因易位、倍增、丢失等事件而分离,这将在近缘物种的染色体共线性分析中显示,有助于挖掘相关的功能基因,描述潜在的进化事件。接下来的工作将结合这些内容,继续挖掘刺五加三萜皂苷生物合成通路中的其他OSC基因及其下游基因CYP和UGT,解析刺五加三萜皂苷代谢途径并实现其生物合成。
