水驱油藏微生物群落结构及影响因素
2022-09-29刘音颂韦海文王继刚李博杨二龙
刘音颂, 韦海文, 王继刚, 李博, 杨二龙*
(1.东北石油大学石油工程学院, 大庆 163318; 2. 东北石油大学三亚海洋油气研究院, 三亚 572000; 3.广东石油化工大学机电工程学院, 茂名 525000)
目前,中国主力油田多已进入开采中后期,由于长期开发,采出液含水率高,面临储采失衡、产量逐年递减等矛盾。即便实施三次采油仍有30%~40%的原油地质储量滞留在地下,其开采难度进一步增大,因此如何经济有效地开采这部分剩余油,对老油田可持续发展非常重要。
微生物采油技术是通过利用微生物生长、繁殖及其代谢产物(包括生物表面活性剂、生物聚合物、生物酸、酶、溶剂和生物酶)来调动残余油[1]。微生物驱油分为外源微生物驱油和内源微生物驱油[2]。外源微生物采油主要通过室内筛选出自然采油菌或采用基因工程学方法培育出工程采用菌,经地面培养后注入油藏[3],而内源微生物驱油技术则是通过注入适宜的营养激活剂以激活油井中的功能微生物,通过内源微生物自身的代谢活动来提高原油采收率。相对而言,内源微生物采油技术具有更能适应油藏环境、不需要菌种保藏和菌液生产、操作成本低等特点,在油田中具有更广阔的应用前景[2,5]。目前现场试验中,孤岛油田向一区馆3区块累计注入营养体系405 t,实现累计增油量1×104t[5];胜利油田辛68区块通过注入营养激活剂实现日产油量提高0.8 t[6],沾3区块日产油量由激活前的2.5 t/d上升至14.0 t/d[7];大庆油田第四采油厂A区块在注入营养激活剂后平均日产液量由456 t增加倒528 t,平均日常油量由15.2 t增加到28.5 t[8],驱油效率得到显著提高。尽管激活剂的注入能够刺激地层微生物的快速生长繁殖,从而改善原油驱替效果,但激活剂筛选周期长,对不同区块的油藏都需要进行重新筛选激活剂,主要原因是对地层中的群落结构认识不足,难以实现有针对性激活油藏微生物。
传统人工培养方法难以完整反映群落生态系统,多种分子生物学技术逐渐被广泛应用于物种多样性研究[9-11]。常用的分子生物学技术主要有变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)、端限制性片段长度多态性(terminal-restriction fragment length polymorphism,T-RFLP)及高通量测序技术等。近年来16sRNA、宏基因组、宏转录组等高通量测序技术通过提高测序深度和覆盖度,实现对低丰度菌群的有效鉴定与统计,在反映整体样本情况上更加精确,随着测序技术和计算机软硬件的迅猛发展,数据量巨大的宏基因组研究的成本在逐步降低,宏基因组领域的研究数量在呈指数型增长[12-13]。进一步拓展了人们对油藏微生物群落结构的认识,有助于提升对油藏微生群落结构和功能的认识。
现通过对A油田和L油田的高通量测序数据进行深入分析,解析不同温度下水驱油藏注水井和生产井的群落结构特征,分析样品的优势菌属与环境因子间的关系,为油藏微生物高效激活剂筛选提供指导,为微生物驱油技术的推广应用奠定理论基础。
1 分析方法
1.1 数据来源
样品数据采集来源于NCBI(National Center for Biotechnology Information (nih.gov))。本文中A油田表示阿尔及利亚油田,L油田表示陆梁油田。通过使用R软件(https://www.r-project.org/)和dada2包分析L油田和A油田的相关序列数据,得到相应的OTU (operational taxonomic units)以及物种注释表等。L油田注水井包括Lu3084、Lu3064和生产井Lu3065和Lu3069。A油田注水井包括IBD、IS2、IT3和生产井PFOH1、PFOH2、PFS2[14-15]。L油田选用数据的登录号分别为,SRX588796(Lu3064),SRX588714(L3065),SRX588677(Lu3084),SRX588820(Lu3096);A油田选用数据分别为SRX265483(IT3),SRX265484(PFS1), SRX265485(IS2),SRX265486(IBD),SRX265487(PFOH1),SRX265488(PFOH2)。两个油田的生产井、注水井地层环境如表1所示,相关序列数信息如表2所示。
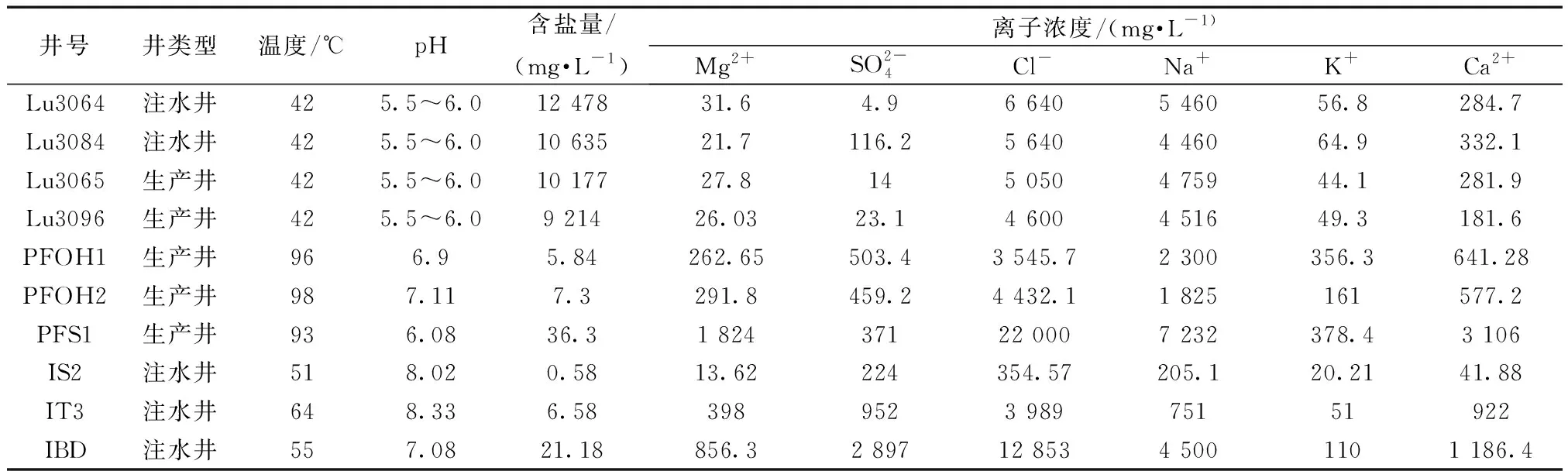
表1 A油田和L油田采样井环境条件Table 1 Environmental conditions of sampling wells in Algeria oilfield and Luliang Oilfield
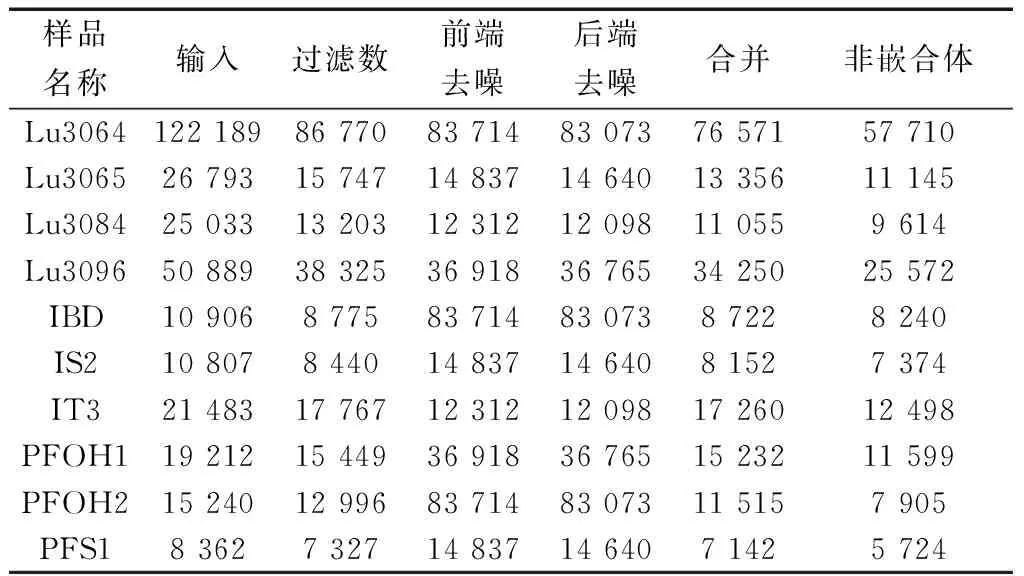
表2 有效序列数Table 2 Number of valid sequences
1.2 分析方法
1.2.1 物种组成分析
使用软件R和SILVA库(http://www.arb-silva.de/search/testprime/)对样品序列进行物种比对,得到物种注释结果,并使用phyloseq包绘制物种丰度图[16],同时使用TBtools软件绘制Venn图[17]。
1.2.2 物种多样性分析
使用R软件进行多样性分析,计算物种的丰富度采用Chao1、ACE,菌群多样性的指数采用Shannon-Wiener(H′)和Simpson(D),H′=-∑pilnpi,其中pi=ni/N,D=∑ni(ni-1)/[N(N-1)],H′为样品的信息含量,pi表示第i个物种占总数的比例,ni表示物种i的个体数,N为所在群落的所有物种的个体数之和。本研究中用于指数评估的OTU相似水平为100%[18-19]。
1.2.3 PcoA分析
使用软件R和Vegan包对物种门水平和属水平上的OTUs数据进行主坐标分析(principal coordinate analysis,PCoA)。
1.2.4 冗余分析
使用R软件和Vegan包先做去趋势对应分析(detrented correspondence, DCA),根据Axis length值对采用典型相关分析(canonical correlation analysis, CCA)分析或者RDA分析进行判定,同时分析环境因子于与物种及样本间的相关性[20]。
2 分析结果
2.1 样本物种组成分析
通过对样本中属水平的物种进行统计分析得到物种相对丰度如图1所示。由图1(a)可知,A油田的注水井和生产井中的古菌菌种数较少,但在菌群丰度分布上差异性明显。注水井中以甲烷嗜热属(Methanothermobacte,43.91%)、甲烷类菌属(Methanosaeta,14.21%)、甲烷杆菌(Methanobacterium,5.53%)为主要菌属。在生产井中的优势菌属分别为亚硝酸盐菌属(CandidatusNitrocosmicus,45.11%),酵母菌(Saccharolobus,22.43%)和甲烷嗜热菌属(Methanothermobacter,5.36%)。由图1(c)所示,L油田的注水井和生产井并无太大差异,都以Methanolobus为主要菌属。在注水井中主要菌属分别为硫球菌(Sulfophobococcus,29.5%)、亚硝酸盐菌属(CandidatusNitrosopumilus,15.12%)、(Methanolobus,5.16%)和(Methanomethylovorans,20.66%)。生产井种以Methanolobus(91.63%)作为主要菌属。如图1(b)所示,A油田注水井中的细菌以嗜温热菌属(Tepidiphilus,24.35%)、脱硫弧菌(Desulfovibrio,15.52%)、海杆菌属(Marinobacterium,9.1%)和假单胞菌属(Pseudomonas,8.79%)为主要菌属。在生产井中的优势细菌菌属分别为假单胞菌属(Pseudomonas,23.39%)和食酸菌(Acidovorax18.82%),能够明显看出注水井和生产井间的群落组成差异较大,共同优势菌属数量较少,仅存在一个共同优势菌种——假单胞菌属。如图1(d)所示,L油田的注水井和生产井中的细菌群落组成基本保持一致,但物种丰富度较低,并且优势菌属上也存在显著差异。注水井主要菌属分别为(Denitromos,5.3%)、海杆菌属(Marinobacterium,4.84%)。生产井中以龙血杆菌(Draconibacterium,6.95%)、假单胞菌(Pseudomonas,6.66%)和海杆菌属(Marinobacterium,5.87%)为主要菌属,其次还包含常见驱油菌属芽孢杆菌(Bacillus,1.76%)。
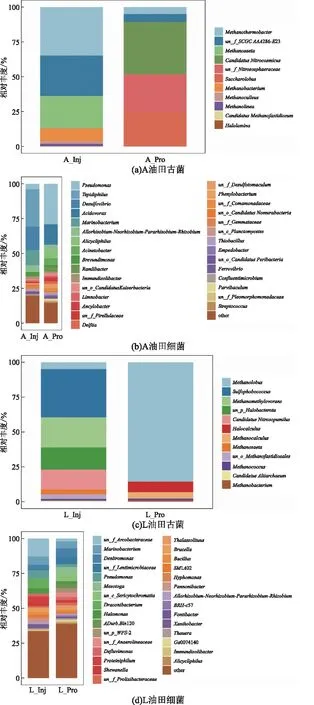
A_Inj为A油田注水井,A_Pro为A油田生产井,L_Inj为L油田 注水井,L_Pro为L油田生产井 图1 样本古菌、细菌在属水平上的物种组成图Fig.1 Species composition diagram of sample archaea and bacteria at the genus leve
通过Venn图分析A油田和L油田的注水井和生产井中的共有菌属。如图2所示,在古菌中共有菌属数目保持一致性,数目都为2,其中A油田的生产井和生产井共有菌属分别为甲烷嗜热菌(Methanothermobacter)和un_f__SCGCAAA286-E23,L油田中的古菌共有菌属分别为(甲烷球菌属)Methanococcus和Methanolobus。但是在细菌中共菌属数目具有较大差别,L油田的生产井和注水井共有菌属数目163,A油田中的生产井和注水井共有菌属数目仅有52,表明在属水平上,L油田中的生产井和注水井间的物种相似程度要明显高于A油田。
2.2 物种多样性分析
Rank-abundance曲线能够分析样本的物种丰度和物种均度,在水平方向,物种的丰度由曲线的宽度来反映,物种的丰度越高,曲线在横轴上的范围越大;曲线的平滑程度反映了样本中物种的均度,曲线越平缓,物种分布越均匀。如图3所示,在A油田和L油田的Rank-abundance曲线图中,A油田中的注水井和生产井间物种丰度和物种均度差异不明显;L油田的注水井L3064的物种均度和物种丰度相对较高,注水井L3084和生产井间的物种均度和物种丰度差异不明显。
2.3 PcoA分析
选取样本门水平和属水平上的数据,采用Bray-Curtis算法计算每个样本的物种组成相似性,得到PCoA分析结果如图4所示。基于门水平的PCoA分析结果能够看出L油田中生产井和注水井之间物种相似性较低,而A油田中,处于同一区块的生产井和注水井在物种组成上差异不明显,如生产井PFS1和注水井IS2,生产井PFOH1、PFOH2和注水井IT3。然而在属水平PCoA分析结果中,A油田中的注水井和生产井间的物种相似性较低,而L油田中的注水井和生产井间的物种相似性较高,呈现与门水平相反的趋势。
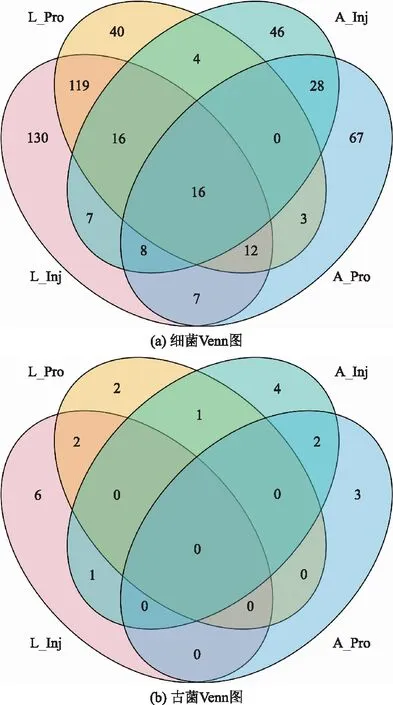
数字表示4个样本之间相交和不相交的物种数 图2 属水平上的OTUs分布图Fig.2 A horizontal OTUs distribution map
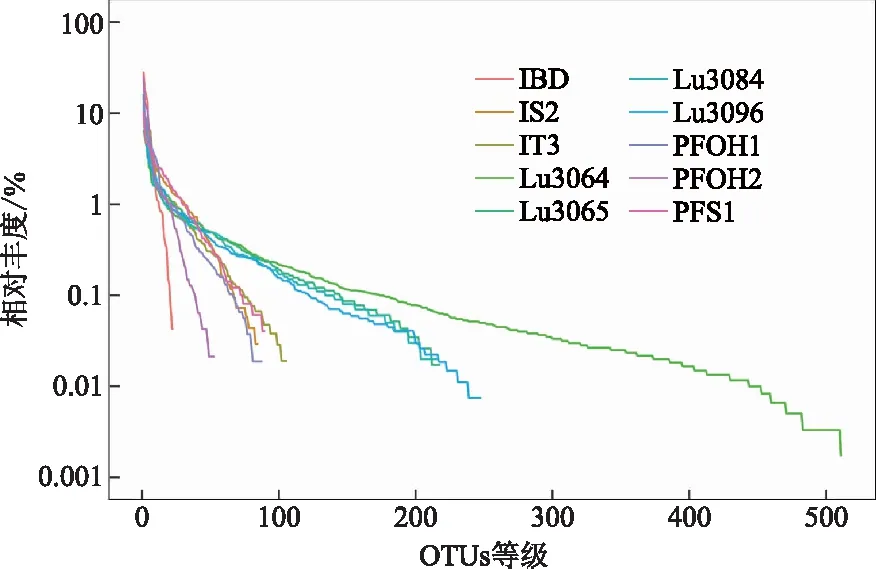
图3 Rank-abundance曲线Fig.3 Rank-abundance curve
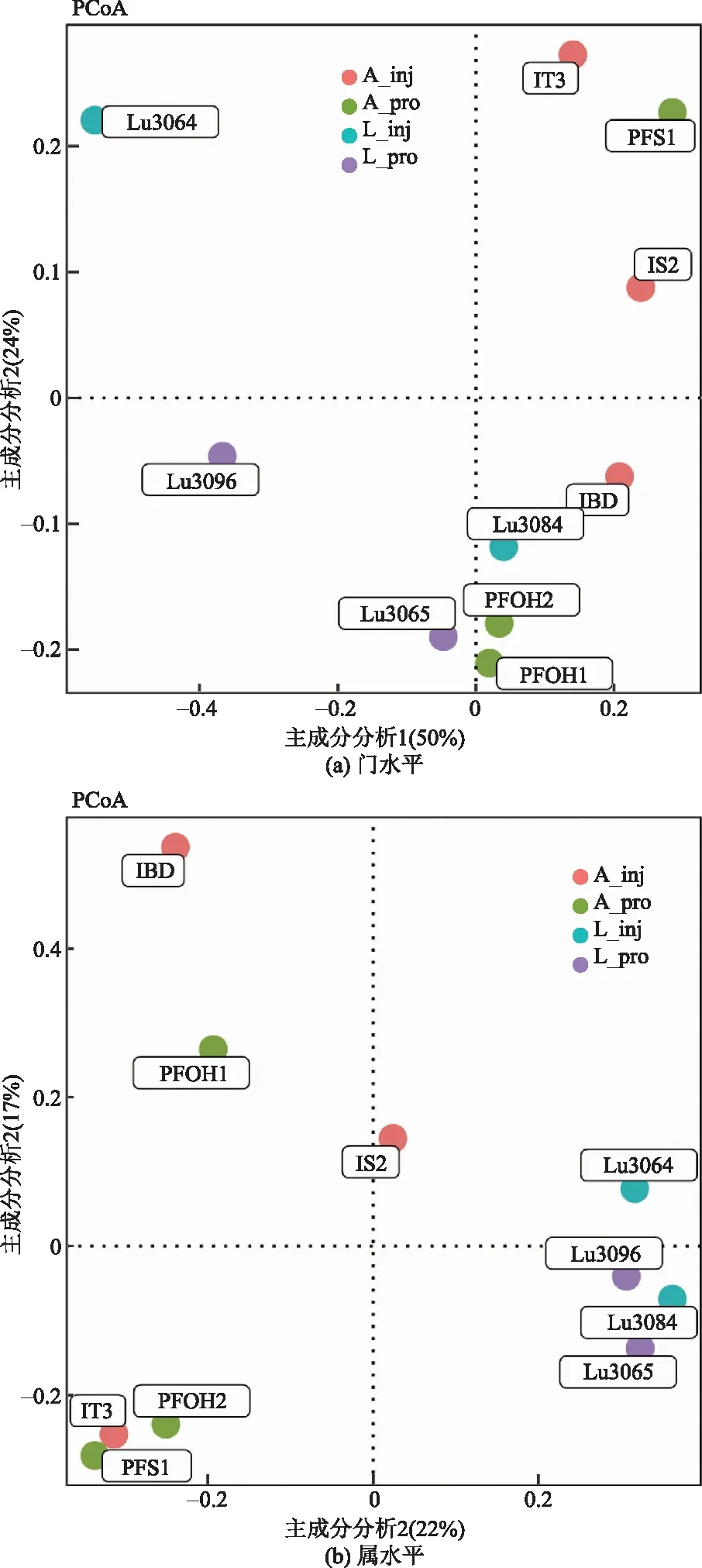
图4 PCoA分析图Fig.4 PCoA analysis diagram
2.4 冗余分析
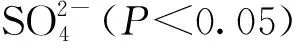
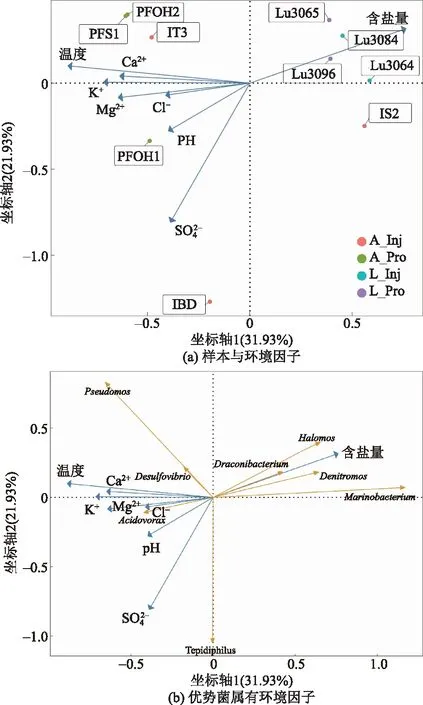
图5 样本和样本群落与理化因子之间的RDA分析Fig.5 RDA analysis between samples and sample communities and physical and chemical factors
3 讨论
PcoA分析结果表明A油田得注水井与生产井中的微生物群落相似性具有明显差异,这与任红燕等[9]关于受环境影响导致了注入水和产出液中的微生物类型差异结论具有一致性。在物种相对丰度结中,A油田的注水井和生产井间的物种组成差异较大,在分析注水井和生产井间的优势菌群组成上,主要优势菌属发生明显改变,注水井中的嗜温热菌属(Tepidiphilus,24.35%)、脱硫弧菌(Desulfovibrio,15.52%)、甲烷类菌属(Methanosaeta,14.21%)和甲烷杆菌属(Methanobacterium,9.1%)等在生产井中占比大幅度下降,食酸菌(Acidovorax,18.82%)、Alicycliphilus(5.72%)、Acinetobacter(5.59%)等成为新的优势菌属,有研究表明食酸菌能够通过对石油烃进行降解获取代谢所需要的能量[21],假单胞菌能够通过降解碳氢化合物并使用硝酸盐作为末端受体电子[22],是作为微生物驱油的常用菌属之一[23-24]。
此外,根据Alpha多样性分析结果表明(表3),A油田注水井和生产井间的物种多样性和物种丰度差异不明显,表明注水井中的油藏微生物对于生产井中的地层环境适应性较低,与生产井中的微生物群落在营养物质等的竞争中处于劣势,相对丰度逐渐降低。L油田中的物种相似较高,并且在物种组成上差异不显著,共有菌属较多,Alpha多样性分析结果与A油田相似,生产井和注水井间差异不明显,这为实施微生物驱油提供了良好的基本条件。
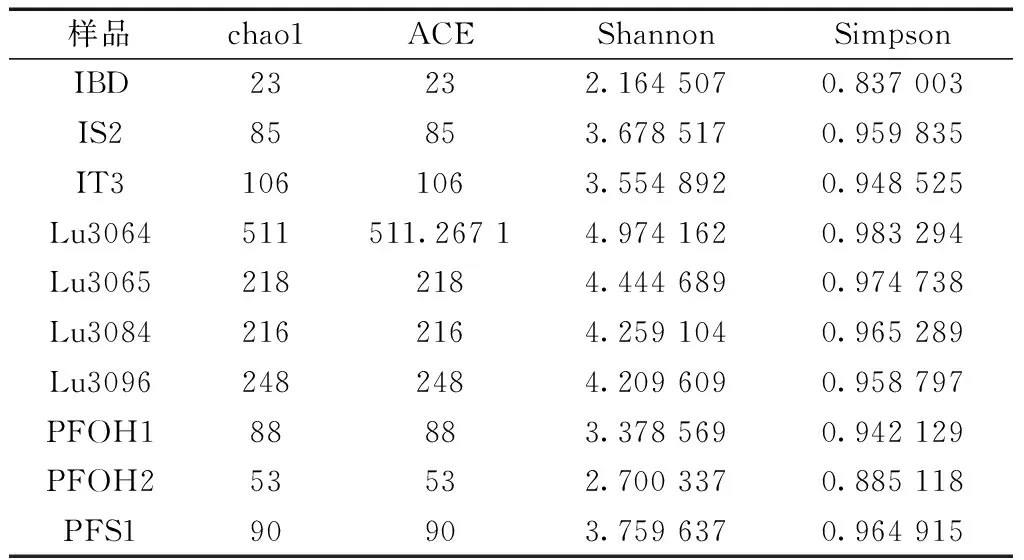
表3 Alpha多样性结果Table 3 Alpha diversity results
表4 DCA分析结果Table 4 DCA analysis results

4 结论
主要通过分析A油田和L油田中注水井和生产井的物种组成以及环境因子对群落组成的影响,得到以下结论。
(1)A油田的注水井和生产井中的古菌菌种数较少,但在菌群丰度分布上差异性明显;在细菌分布上,注水井和生产井间的群落组成差异明显。L油田的注水井和生产井的古菌并无太大差异,都以Methanolobus为主要菌属。在细菌分布上,群落组成基本保持一致,但物种丰富度较低,并且优势菌属上也存在显著差异。
(2)A油田和L油田中的注水井和生产井间物种丰度和物种均度差异不明显,此外,两油田间的物种丰度和物种多样性差异不显著。
(3)在属水平上,A油田中的注水井和生产井间的物种相似性较低,而L油田中的注水井和生产井间的物种相似性较高。