间充质干细胞外泌体对MPTP诱导急性帕金森小鼠模型的治疗作用
2022-09-29柴源王宏康赵瑞婧苗宇
帕金森病(Parkinson's disease, PD)是中老年人常见的中枢神经系统变性疾病。其主要病理改变为中脑黑质致密部多巴胺(dopamine,DA)能神经元进行性变性丢失,纹状体区多巴胺含量减少,以及残存的多巴胺能神经元内形成以突触共核蛋白(α-Synuclein, α-Syn)为主要成分的嗜酸性包涵体—路易小体(Lewy body, LB)。
帕金森疾病的治疗目前仍无显著有效的药物,干细胞治疗是诸多方法中很有前景的一种,尤其是间充质干细胞(mesenchymal stem cells, MSCs)。间充质干细胞是一种多功能性细胞,表现出低免疫原性,具有多向分化的同时,还具有免疫调节的生物学潜能,可以离体扩大培养
,根据文献,其对神经系统疾病有一定的治疗作用
。现阶段研究发现,MSC的治疗作用主要来源于间充质干细胞旁分泌作用产生的外泌体(exosomes,Exo)和可溶性因子,其中外泌体中含有microRNA、蛋白质在内的多种物质,可以发挥靶向调节作用
,其能够通过血脑屏障
,在治疗神经疾病方面更有优势。文献显示,间充质干细胞来源的外泌体(mesenchymal stem cells-derived exosomes, MSC-Exo)能够到达黑质,显著抑制6-羟基多巴胺(6-hydroxydopamine, 6-OHDA)诱导的PD大鼠疾病模型
,能够抑制PD小鼠模型的氧化应激
。本文探讨通过尾静脉注射MSC-Exo对1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3, 6-tetrahydropyridine, MPTP)诱导的急性帕金森小鼠模型的治疗作用,从神经元损失到炎性变化以及氧化应激等多方面观察效果。
1 材料与方法
1.1 实验材料 从西安交通大学实验动物中心购买8~12周的C57BL/6小鼠,适应性饲养一周后进行实验,期间自由饮食饮水,12h∶12h昼夜环境。
1.2 间充质干细胞外泌体的提取鉴定 取小鼠皮下脂肪,剪碎后,用0.1%胶原酶Ⅰ 37℃消化40min,然后 200目滤网过滤后,1000rpm,5min离心,培养液悬浮后,接种培养瓶,培养液为改良伊格尔培养基(Dulbecco's Modified Eagle Medium,DMEM)+10%优级胎牛血清(Fetal Bovine Serum,FBS)
。培养至4到6代时,在细胞长至融合后,更换为无血清DMEM,继续培养24h,收集上清提取外泌体。首先以300g,10min离心去除细胞以及碎片等,然后取上清2000g,10min离心去除较小的细胞碎片,接着以10000g,30min离心清除凋亡体,最后100000g,70min超速离心沉淀外泌体,所有离心步骤均为4℃处理,磷酸缓冲盐溶液(phosphate buffer saline,PBS)重悬外泌体后-80℃保存。采用BCA(bicinchoninic acid)法对外泌体进行定量,免疫印迹法检测外泌体标志分子CD63 (1∶1000, Abcam, California, USA)和CD81 (1∶1000, Abcam, California, USA)的表达。
1.3 MPTP诱导小鼠帕金森模型 将45只小鼠分为3组,分别为Sham组、PD组和PD+MSC-Exo组,每组15只,Sham组在造模时给予生理盐水,PD组腹腔注射MPTP诱导急性PD模型,PD+MSC-Exo组在PD造模后尾静脉注射给予MSC-Exo。用MPTP(M2690, Tokyo Chemical IndustryTCI,日本)诱导小鼠急性帕金森模型,MPTP用生理盐水溶解,配成2mg/ml试剂,小鼠连续腹腔注射4次MPTP,间隔2h,每次按照20mg/kg给药,总剂量是80mg/kg
。2h后,尾静脉给予MSC-Exo,每只50ug/150ul
。在第4天,14天,30天时取材。
自从有了小弟,我们家增添了许多欢声笑语。我喜欢给他喂饭,看他一口接一口香香地吃着,心里美滋滋的。我喜欢和他一起洗澡,看他笨手笨脚去爬海洋球的池子,可爱极了!我喜欢和他一起玩滑滑梯,看他从滑梯上滑下来那股高兴劲儿,我比他还要开心!也不知道为什么会这样,大概跟他在一起时,我也觉得自己变小了、可以无忧无虑了吧。
本文实验中用MPTP成功诱发急性帕金森模型,实验发现,C57BL/6小鼠给予MPTP连续4次后(2h一次,每次20mg/kg),小鼠的神经元显著减少,TH表达降低,给阿朴吗啡后,PD小鼠的转圈数达到200多以上,出现典型的帕金森症状,同时发现,PD小鼠给予MSC-Exo后症状显著缓解,转圈数相比PD组显著下降,并且神经元损失减少,TH的表达量也明显上升,表明MSC-Exo对帕金森的治疗具有显著作用,能够保护神经元,改善行为学特性。另外,我们还发现PD小鼠纹状体的炎症因子TNFα、IL-1β和氧化应激分子Nrf2、Keap1的表达显著高于Sham组,给予MSC-Exo后小鼠的这些因子表达显著下降。我们的结果与文献报道的结果一致,有临床试验用自体脂肪MSC治疗帕金森病人,发现对运动障碍有一定的治疗效果
,给PD大鼠移植MSC同样能够显著减少转圈数,增加TH的表达
,关于MSC-Exo对PD治疗效果的研究目前较少,Chen等
发现Exos在体内通过血脑屏障到达黑质,能够缓解PD小鼠中阿朴吗啡诱导的不对称旋转,减少黑质多巴胺能神经元的丢失和凋亡,并上调纹状体多巴胺水平,Ma等
发现在PD小鼠中,骨髓间充质干细胞的Exo通过携带miR-181a-2-3p减轻多巴胺神经元的凋亡,并通过烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(Nicotinamide Adenine Dinucleotide Phosphate Oxidase 4, NOX4)/丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通过抑制氧化应激。表明在帕金森疾病状态下,整个纹状体脑区的细胞都处于炎症和应激状态,MSC-Exo通过整体调控这种失控状态而达到治疗作用,但是具体的作用分子有待进一步研究,后续研究中会用组学等方法确定MSC-Exo的具体作用物质,以及它的靶向分子,为MSC-Exo治疗帕金森提供更为具体的证据。
2 结果
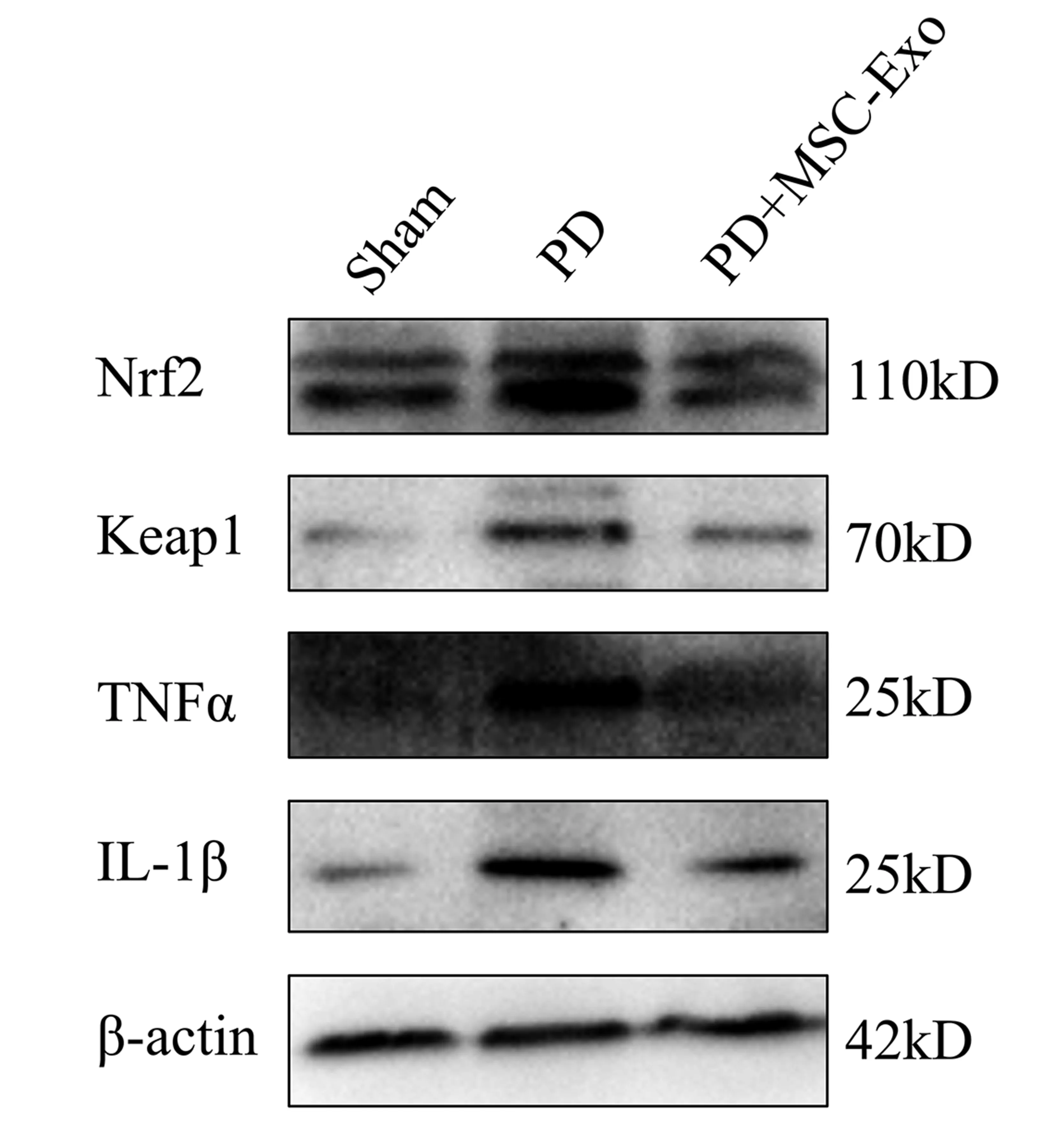
2.3 免疫印迹结果 在第4天,PD组小鼠纹状体的TH蛋白表达相比于Sham组显著降低(
<0.05),而与PD组相比,PD+MSC-Exo组的TH表达量上升(
<0.05),见表2,图2。PD组小鼠在第4天时,脑组织的炎症因子TNFα和IL-1β表达显著高于Sham组(
<0.01),而PD+MSC-Exo组的这两种炎症因子的表达明显低于PD组(
<0.01)。同时发现,第4天时,氧化应激通路分子Nrf2和Keap1相较于Sham组在PD组高表达(
<0.01),而与PD组相比在PD+MSC-Exo组显著下调(
<0.01)。见表3,图3。

由于阳极铜飞边毛刺多、几何尺寸误差偏大,蒸汽供应不稳定,阴极铜外观质量不佳,表面粒子较多,直到10月份,外观质量得到稳定。投产以来,阳极板平均铜含量达到99.6%,加之新液生产,电解液杂质含量低,阴极铜成分均达到高纯铜标准,连续5批阴极铜成分见表2。
2.1 小鼠行为学结果 实验发现,连续4次(间隔2h)给MPTP后,成功诱发小鼠急性帕金森模型,行为学症状明显,在第4、14、30天,给予阿扑吗啡后,PD+MSC-Exo组和PD组小鼠的转圈数显著高于Sham组(
<0.01),PD+MSC-Exo组小鼠转圈数明显低于PD组(
<0.01)。见表1。



3 讨论
MSC因其具有自我复制、多向分化、免疫调控、神经营养等生物学特性,目前已成为基础研究和临床试验应用最为广泛的干细胞之一,其来源的外泌体能够穿透血脑屏障,在神经系统疾病治疗以及靶向载药中有巨大的潜在价值。MPTP具有多巴胺神经毒性,进入脑部后,能够进入多巴胺能神经末梢和胞体,破坏黑体多巴胺能神经元,导致纹状体神经末梢、多巴胺地址的大量减少,最后产生神经毒性,诱发帕金森疾病
。MSC衍生外泌体成分可对抗神经炎症,增强抗氧化能力和神经营养因子的表达
,因此MSC-Exo应该对帕金森也有良好的治疗效果。
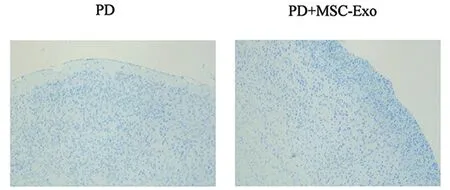
2.2 尼氏染色结果 在第30天尼氏染色结果发现,与Sham组相比,PD组小鼠的阳性染色显著减少,神经元损失严重,而与PD组相比,PD+MSC-Exo组的神经元损失减少,数量增多,见图1。
1.4 评定指标 ①旋转实验:在第4、14和30天,进行阿朴吗啡诱导的旋转试验,每组10只,以评估受损纹状体的超敏反应。小鼠皮下注射阿扑吗啡(0.05 mg/kg)后,放到旋转仪中,观察旋转情况,同时使用视频跟踪系统测量30min内的旋转次数。②尼氏染色:在第30天用4%多聚甲醛全身灌注固定后,取大脑进行石蜡包埋,每组5只,切片到纹状体,依次过二甲苯、无水乙醇、95%酒精、80%酒精、70%酒精和蒸馏水,然后1%焦油紫染色30min,蒸馏水清洗,70%酒精分色数秒至数分钟,依次经70%酒精、80%酒精、95%酒精,各2min脱水,无水乙醇2次,每次5min,二甲苯2次,每次10min,DPX封片。显微镜下观察拍片分析。③免疫印迹:取第4天的纹状体,每组5只,RIPA(radio immunoprecipitation assay)裂解液超声(50w,5min)提取蛋白,12000rpm,10min,4℃离心,取上清液,BCA法进行定量。进行SDS-PAGE,每孔蛋白30ug,80V 30min,120V 1h;然后进行转膜,300 mA恒定电流,120 min将蛋白转至聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)(Millipore,MA,USA)膜;室温下将膜在封闭液中封闭2 h,然后一抗孵育过夜核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2) (1∶1000)、Kelch样环氧氯丙烷相关蛋白-1(kelch-likeECH-associated protein 1, Keap1) (1∶1000)、酪氨酸羟化酶(tyrosine hydroxylase , TH)、肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)、白介素1β(interleukin-1β, IL-1β)、β-肌动蛋白(β-actin),三羟甲基氨基甲烷缓冲液(tris buffered saline with tween, TBST)洗涤后,室温下孵育二抗2 h,TBST 洗涤3次。加上发光液后使用Bio-Rad成像系统(Bio-Rad, Hercules, California, USA)显示条带,Image Lab软件分析灰度值。
唐五代时期,“过”用于非位移动词后的情况开始出现,如:例(12),且“过”在这些例子中不再表示动作行为的趋向,其语义已经虚化,在这些例子中“过”表示动作行为的完成和结束,即“过1”,至此动态助词“过1”产生,用例不是很多。但是唐五代“过”作趋向补语的用例特别的多,比魏晋时期增多,如:例(11)等。
类似地,MSC-Exo对癫痫小鼠也具有治疗作用,能够提高其认知和学习记忆能力,降低炎症
,能够改善阿尔茨海默病小鼠的认知损伤,减少海马神经元丢失,抑制海马神经元氧化应激
,减轻小鼠缺血后的神经功能缺损、梗死体积、脑水肿和神经元损伤,降低中性粒细胞、单核细胞和巨噬细胞的浸润,具有神经保护作用
。表明MSC-Exo确具有免疫调控和神经保护作用,在治疗帕金森疾病方面具有巨大的应用潜力。
许多研究者采用菜薹的带柄子叶、原生质体、游离小孢子等进行培养,均取得了一定的成果[2-4]。张鹏等[5]研究认为菜薹以子叶-子叶柄为外植体,不定芽诱导率最高。而何晓明等[6]则认为菜薹再生能力在不同品种间差异很大,Zhang等[7]指出大白菜的基因型对它的再生能力影响极大,虽然一些菜薹品种已经可以进行再生,但是由于材料的专一性强,许多未研究过的品种在基因工程技术方面的应用还是会受到限制。因此,笔者以未报道的红菜薹为研究对象,以带柄的子叶为外植体,探讨TDZ、NAA等不同激素浓度对再生体系的影响,旨在为其在生物技术育种层面上的研究奠定基础。
在MPTP诱发的急性帕金森小鼠模型中,给予MSC-Exo后,神经元的损失减少、TH表达上升,炎症因子和氧化因子分子的表达也趋于正常,显示MSC-Exo在治疗帕金森以及其他神经疾病方面具有广泛的潜力。
[1] Chen JM, Huang QY, Zhao YX, et al. The Latest Developments in Immunomodulation of Mesenchymal Stem Cells in the Treatment of Intrauterine Adhesions, Both Allogeneic and Autologous [J]. Frontiers in Immunology, 2021,12(1):785717.
[2] Yarygin KN, Namestnikova DD, Sukhinich KK, et al. Cell Therapy of Stroke: Do the Intra-Arterially Transplanted Mesenchymal Stem Cells Cross the Blood-Brain Barrier? [J] Cells, 2021,10(11): 2997-3018.
[3] S ELA, Mager I, Breakefield XO, et al. Extracellular vesicles: biology and emerging therapeutic opportunities [J]. Narure Reviews Drug Discovery, 2013, 12(5): 347-357.
[4] Long Q, Upadhya D, Hattiangady B, et al. Intranasal MSC-derived A1-exosomes ease inflammation, and prevent abnormal neurogenesis and memory dysfunction after status epilepticus [J]. Proceedings of The National Academy of Sciences of The United States of America, 2017, 114(17): E3536-E3545.
[5] Chen HX, Liang FC, Gu P, et al. Exosomes derived from mesenchymal stem cells repair a Parkinson's disease model by inducing autophagy [J]. Cell Death & Disease, 2020,11(4):288-305.
[6] Ma J, Shi X, Li M, et al. MicroRNA-181a-2-3p shuttled by mesenchymal stem cell-secreted extracellular vesicles inhibits oxidative stress in Parkinson's disease by inhibiting EGR1 and NOX4 [J]. Cell Death Discovery, 2022, 8(1):33-47.
[7] 曹胜军,王凌峰,巴特,等. 异体小鼠脂肪源性间充质干细胞-微孔化羊脱细胞真皮基质对小鼠全层皮肤缺损创面愈合的影响及相关机制[J].中华烧伤杂志, 2018,34(12): 901-906.
[8] Tan X, Hu J, Ming F, et al. MicroRNA-409-3p Targeting at ATXN3 Reduces the Apoptosis of Dopamine Neurons Based on the Profile of miRNAs in the Cerebrospinal Fluid of Early Parkinson's Disease [J]. Frontiers in Cell and Developmental Biology, 2021,9(1):755254.
[9] Tillerson JL, Miller GW. Grid performance test to measure behavioral impairment in the MPTP-treated-mouse model of parkinsonism [J]. Journal of Neuroscience Methods, 2003, 123(2): 189-200.
[10] d'Angelo M, Cimini A, Castelli V. Insights into the Effects of Mesenchymal Stem Cell-Derived Secretome in Parkinson's Disease [J]. International Journal of Molecular Sciences, 2020, 21(15): 5241-5260.
[11] Shigematsu K, Komori N, Tahara K, et al. Repeated infusion of autologous adipose tissue-derived stem cells for Parkinson's disease [J]. Acta Neurologica Scandinavica, 2022, 145(1):119-122.
[12] Forouzandeh M, Bigdeli MR, Mostafavi H, et al. Therapeutic potentials of human microfluidic encapsulated conjunctival mesenchymal stem cells on the rat model of Parkinson's disease [J]. Experimental and Molecular Pathology, 2021, 123(1):104703.
[13] Chen HX, Liang FC, Gu P, et al. Exosomes derived from mesenchymal stem cells repair a Parkinson's disease model by inducing autophagy [J]. Cell Death & Disease 2020,11(4):288-305.
[14] Wang H, Liu Y, Li J, et al. Tail-vein injection of MSC-derived small extracellular vesicles facilitates the restoration of hippocampal neuronal morphology and function in APP / PS1 mice [J]. Cell Death Discovery, 2021,7(1): 230-240.
[15] Wang C, Börger V, Mohamud Yusuf A, et al. Postischemic Neuroprotection Associated With Anti-Inflammatory Effects by Mesenchymal Stromal Cell-Derived Small Extracellular Vesicles in Aged Mice [J]. Stroke, 2022, 53(1): e14-e18.
