2种充气模式中华鳖工厂化养殖水体水质及微生物群落结构
2022-09-28苏俊宇祝骏贤罗来福耿露露李健松张继平朱新平
苏俊宇,陈 辰,李 伟,雷 骆,祝骏贤,罗来福,耿露露,史 伟,李健松,张继平,朱新平
(1.佛山科学技术学院生命科学与工程学院,广东 佛山 528231;2.中国水产科学研究院珠江水产研究所农业农村部热带亚热带水产资源利用与养殖重点实验室,广东 广州 510380;3.惠州市财兴实业有限公司,广东 惠州 561700)
中华鳖(Pelodiscus sinensis)又称甲鱼,是我国重要的名特优水产养殖物种[1]。近年来,中华鳖工厂化养殖发展迅速,以“保温车间+养殖池+地下水”为主。充气增氧是中华鳖工厂化养殖过程中维持水质稳定,保持水体微生态平衡的重要措施。微孔增氧技术是新兴的高效水体增氧技术。该技术通过管道将增压空气输送到养殖池底,气体通过管壁的微孔以微气泡形态逸散于水中,有气泡上升速率慢、滞留时间长、气水接触面积大、传质效率高的特点,可实现水体高效、持久复氧,提高水体中好氧微生物生理活性,加快污染物降解,促进水体净化[2-3]。该技术目前已用于循环水养殖系统水体增氧[4-5]等多个渔业领域,并取得良好效果。
本研究比较微孔管和普通通底管两种充气模式下中华鳖工厂化养殖水体的常规水质指标,用高通量测序方法对水体微生物进行宏基因组测序分析,探讨不同充气模式下水体微生物的群落结构组成和环境因素,为中华鳖工厂化健康养殖研究提供科学依据。
1 材料与方法
1.1 样本采集
实验在惠州市财兴实业有限公司中华鳖工厂化养殖车间进行。实验设置微孔管和通底管两种充气模式(分别记为MA、DG 组),两种充气管均购自无锡江诺增氧设备有限公司。微孔管为三元乙丙橡胶(EPDM)材质,孔径为25 μm;通底管为聚氯乙烯(PVC)材质,孔径为4 mm。两种充气模式充气管道在池底的布设如图1所示。
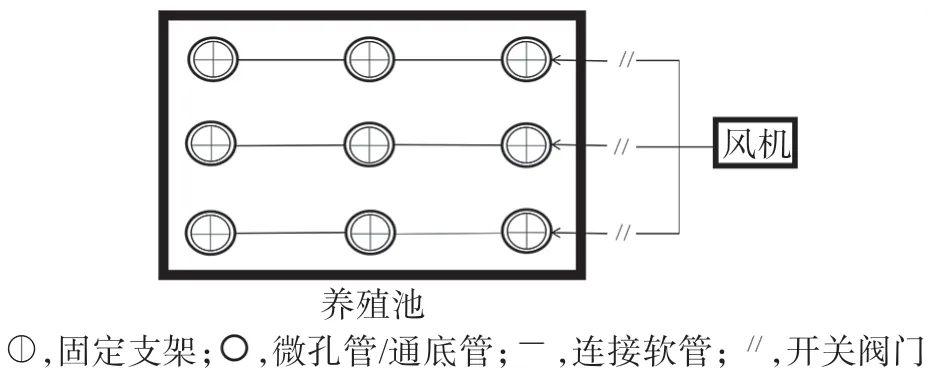
图1 养殖池充气装置示意图Fig.1 Schematic diagram of the inflation device installed in the indoor aquaculture ponds
每种充气模式均设5 个重复养殖池,每个养殖池容积225 m3。实验期间,每池投放规格为(300±40)g 的中华鳖15 000 只,投喂相同组分的配方饲料,并由专人统一管理,车间内水温保持在(30±0.5)℃。每日在投料后1 h(5:00、12:00、18:00)充气1 h。两种充气模式用功率为15 kW 的同一罗茨鼓风机进气。
饲养2 个月后,水色变为褐色并出现絮状沉淀物,分别从每个养殖池中采集1 L 水样,用于后续分析。水样采集前1 h 停止充气,用五点采样法采样。使用便携式水质分析仪(奥克丹,OCT-V型)测定pH值、溶氧量(DO)、亚硝态氮(NO2--N)、活性磷酸盐(PO43-)和氨氮(TAN)5 个水质指标。用孔径0.22 μm 的醋酸纤维素滤膜(Merk Millipore,USA)对样本进行真空抽滤,取出滤膜,装入灭菌离心管,置于液氮保存待测。
1.2 DNA提取和Illumina高通量测序
将滤膜用超低温研磨仪研磨,按照DNA提取试剂盒(HiPure Soil DNA Kits,广州美基生物科技有限公司)提取微生物总DNA。用NanoDrop 2000 检测DNA 浓度和纯度,用琼脂糖凝胶电泳检测DNA质量。
用带有barcode 的特异引物341F(5′-CCTAC‐GGGNGGCWGCAG-3′)和806R(5′-GGACTACH‐VGGGTWTCTAAT-3′)对细菌16S rRNA 基因V3-V4 可变区进行PCR 扩增。PCR 扩增分为两轮,第一轮扩增体系为:10×Buffer KOD 5 μL,2 mmol/L dNTPs 5 μL,25 mmol/L MgSO43 μL,正反向引物(10 μmol/L)各1.5 μL,KOD 酶(东洋纺(上海)生物科技有限公司)1 μL,DNA模板30 ng,补足ddH2O至50 μL。第1 轮扩增程序为:94 ℃2 min;98 ℃10 s,55℃30 s,68 ℃30 s,30 个循环;68 ℃5 min。第1轮PCR 产物用AMPure XP Beads 纯化,用Qubit 3.0定量。第2 轮扩增体系为:10×Buffer KOD 5 μL,2 mmol/L dNTPs 5 μL,25 mmol/L MgSO43 μL,Index Primer(10 μmol/L)1 μL,Universal PCR Primer(10 μmol/L)1 μL,KOD 酶1 μL,DNA 模板30 ng,补足ddH2O 至50 μL。第2 轮扩增程序:94 ℃2 min;98 ℃10 s,65 ℃30 s,68 ℃30 s,12 个循环;68 ℃5 min。使用AMPure XP Beads 纯化第2 轮扩增产物。纯化产物使用ABI StepOnePlus RealTime PCR System(Life Technologies,美国)进行定量。使用Illumina公司的Novaseq 6000测序仪,按照PE250模式进行混池测序。
1.3 数据处理与统计分析
高通量测序数据按照Illumina 标准流程对原始数据(raw data)进行质控(QC),获得去除低质量读数(reads)的有效数据(clean data)。将过滤后reads拼接为标签(tags),对低质量tags 进行过滤,获得用于后续分析的净标签(clean tags)。
为划分操作分类单元(OTU),用USEARCH 软件的UPARSE 算法,在相似性97% 的水平下对clean tags进行聚类分析,用UCHIME算法去除聚类比对中检测到的嵌合体,用R程序包venndiagram对聚类结果进行统计。
基于聚类分析结果,用RDP classifier 软件的Naive Bayesian assignment 算法对每个OUT 的代表序列进行物种注释,并在门、科和属水平上分析两种充气模式养殖水体微生物群落结构。以柱形累加图(门、科水平)或条形图(属水平)呈现相对丰度(样本的物种tags 数/样本总tags 数)达到1%以上的物种注释结果,并采用Welch'st检验比较物种间的相对丰度。
为评价两种充气模式下养殖水体微生物的多样性水平,用QIIME软件分别计算两种充气模式的微生物群落的α-物种多样性指数,包括Chao1指数、ACE指数、Shannon 指数、Simpson 指数和覆盖率(%),并用t检验比较多样性指数的组间差异。为比较两种充气模式群落结构的差异,基于样本间的Jaccard 距离,使用R 程序包vegan 计算组间的β-多样性,并进行主坐标分析(PCoA)。用R 程序包ggplot2 绘制PCoA主坐标分析图。
用SPSS 22.0 软件对水体理化指标的组间差异进行t检验或Mann-Whitney U 检验;为评价水质因子和微生物群落相对丰度的关系,使用R 程序包vegan对属水平相对丰度排名前10的微生物群落与前述5个水质指标进行冗余分析(RDA)。
2 结果与分析
2.1 两种充气模式中华鳖工厂化养殖水体的主要水质指标
在两种充气模式中华鳖养殖水体的主要水质指标如表1 所示。两组水样的pH 均呈弱酸性,DG组的pH 值(5.16 ± 0.32)显著低于MA 组(6.22 ±0.24);MA 组溶解氧含量较高(10.86 ± 1.98),显著高于DG 组(4.44 ± 0.47);两组水样的亚硝态氮含量均处于较低水平,MA 组含量(0.18 ± 0.08)显著低于DG 组(0.53 ± 0.08);两组的磷酸盐和氨氮含量均处于较高水平,但两组间无显著差异(P >0.05)。

表1 两种充气模式下中华鳖工厂化养殖水体的主要水质指标Table 1 Five water quality indices of the indoor industrial aquaculture system for Pelodiscus sinensis under two different aeration methods mg/L
2.2 两种充气模式下中华鳖工厂化养殖水体微生物的OUTs分布
高通量测序结果经过滤后,共获得1293 143 条高质量reads。去除嵌合体以后,最终获得1168 010条有效tags,平均每个样本的高质量tags数为116 801条。OTU 聚类分析结果(图2)表明,DG 组的平均OUTs 数目为463,MA 组的平均OTUs 数目为591。两组共有的OTUs 数目为308,DG 组独有的OTUs 数目为155,MA 组独有的OTU 数目为283。
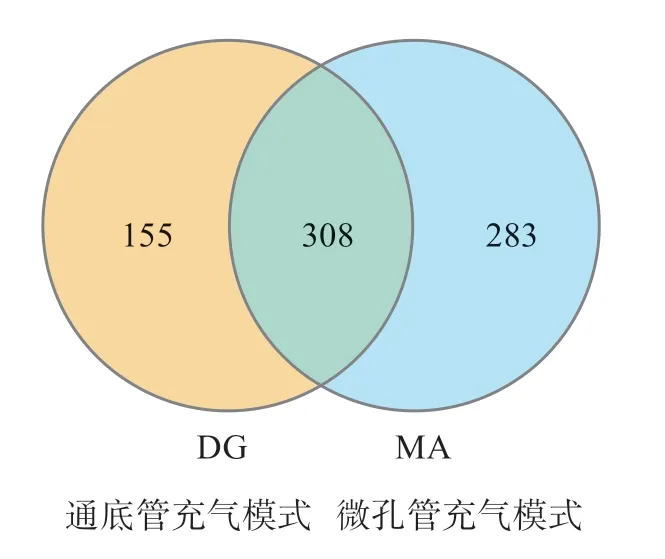
图2 两种充气模式下养殖水体微生物OTUs分布维恩图Fig.2 Venn diagram showing the OTU numbers in water of aquaculture system by two aeration methods
2.3 两种充气模式下中华鳖工厂化养殖水体微生物多样性
2.3.1 α-物种多样性指数 如表2 所示,MA 组水体微生物的4 种多样性指数(Ace 指数、Chao1指数、Shannon 指数和Simpson 指数)均显著高于DG 组(P <0.05),表明采用微孔管充气的中华鳖养殖水体微生物多样性明显优于通底管充气模式。
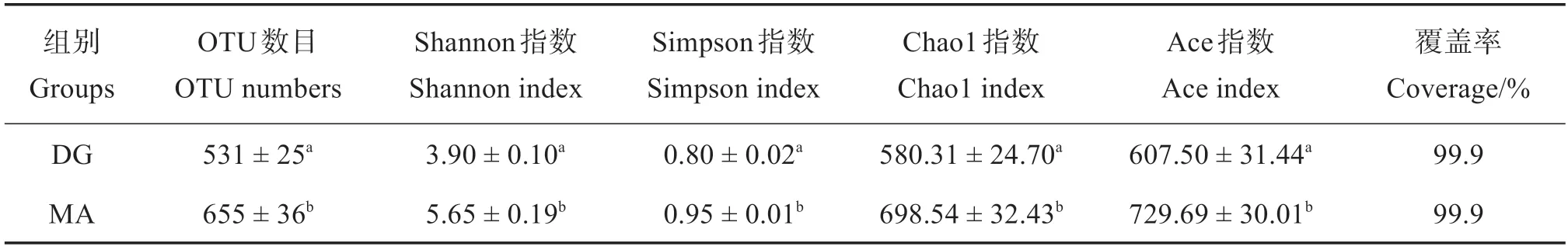
表2 两种充气模式下中华鳖工厂化养殖水体微生物α-物种多样性指数Table 2 Alpha species diversity index of microbial taxa in the indoor industrial aquaculture system for Pelodiscus sinensis under two different aeration methods
2.3.2 β-多样性分析 图3 显示,两种充气模式下养殖水体的微生物分别呈现明显聚类,DG 组样本只分布于第1、3 象限,MA 组样本主要分布在第4 象限,主坐标PCo1 和PCo2 的方差贡献率分别为85.00%和5.25%。表明两种充气模式的中华鳖工厂化养殖水体微生物群落结构差异较大,微生物群落分区明显。
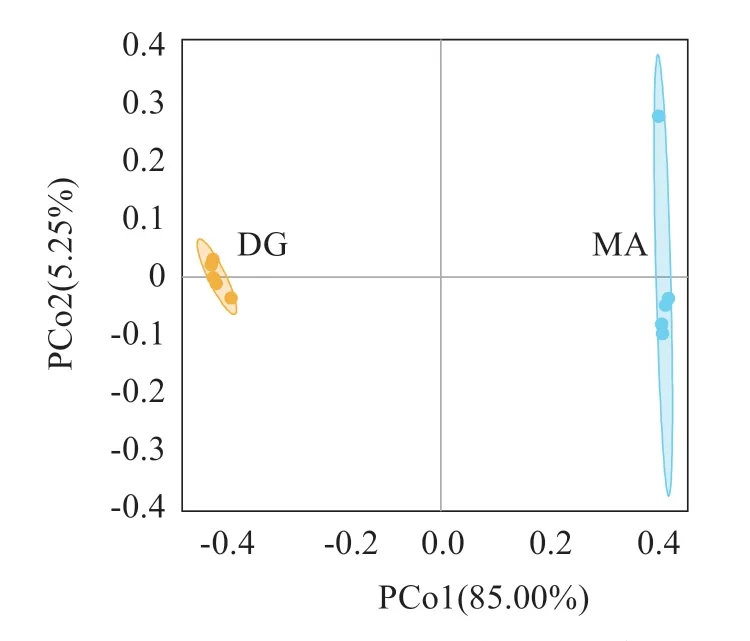
图3 基于Jaccard距离的主坐标分析Fig.3 Principal coordinate analysis based on Jaccard distances
2.4 两种充气模式下中华鳖工厂化养殖水体微生物群落结构组成
2.4.1 门水平的微生物群落结构组成 两种充气模式下的中华鳖工厂化养殖水体共检测到22 个门类微生物,组间的微生物门类组成相似。其中,变形菌门(Proteobacteria)等19 个门为两种充气模式共有。蓝细菌门(Cyanobacteria)为DG 组特有;纳古菌门(Nanoarchaeaeota)和Hydrogenedentes 为MA 组 特有。特有门类的相对丰富在群落组成中均小于1%。
按平均相对丰度大于10%进行优势菌门统计,两种充气模式的优势菌门差异显著(图4)。DG 组的优势菌门较为集中,66.99%为变形菌门,12.81%为髌骨细菌门(Patescibacteria);MA 组的主要优势菌门为变形菌门(44.81%)、髌骨细菌门(13.15%)、芽单胞菌门(Gemmatimonadetes,10.49%)和拟杆菌门(Bacteroidetes,9.56%)。
2.4.2 科水平微生物群落结构组成 在科水平,两种充气模式下中华鳖工厂化养殖水体的微生物优势菌科(以平均相对丰度>10%统计)差异显著(图4)。DG 组的优势菌科为红杆菌科(Rhodobacteraceae,41.25%)和红环菌科(Rhodocyclaccae,17.32%),MA组的优势菌科为红环菌科(34.07%)和芽单胞菌科(Gemmatimonadaceae,10.48%)。
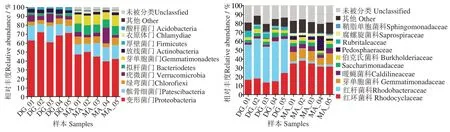
图4 两种充气模式下养殖水体微生物门与科水平的相对丰度Fig.4 Relative abundance of microbial taxa in water of aquaculture system by two aeration methods at phylum and family levels
2.4.3 属水平的微生物群落结构组成 在属水平,两种充气模式下中华鳖工厂化养殖水体的微生物组成相似(图5),但不同微生物类群间相对丰度差异较大。两种充气模式均有较高比例未被注释的菌属(DG 组为68.70%,MA 组为79.48%)。在已鉴定的菌属中,Denitratisoma属是两种充气模式下的共有优势菌属,组间相对丰度差异显著(DG 组为14.38%,MA 组为4.63%)。除Denitratisoma属外,Luteolibacter属(4.01%)、Limnobacter属(2.06%)、新鞘氨醇杆菌属(Novosphingobium,1.34%)、埃希氏-志贺氏菌属(Escherichia-Shigella,1.37%)、Lacunisphaera属(1.32%)和小纺锤状菌属(Fusibacter,1.31%)为DG 组的优势菌属,相对丰度均显著高于MA 组;Sulfuritalea属(3.91%)、Azospira属(1.29%)和Tetrasphaera属(1.17%)为MA 组的优势菌属,相对丰度均显著高于DG组。

图5 两种充气模式下中华鳖工厂化养殖水体微生物属水平相对丰度Fig.5 Relative abundance of microbial taxa in water of aquaculture system by two aeration methods at the genus level
2.5 两种充气模式下微生物群落结构与环境因子的相关性
图6 可见,RDA1 和RDA2 两个排序轴对微生物群落结构的解释程度分别为93.66%和5.66%。水体微生物群落结构与pH 和DO 有正相关性趋势(r2=0.907,P=0.081 和r2=0.934,P=0.061),与亚硝态氮有负相关性趋势(r2=0.922,P=0.100)。其 中,Denitratisoma属、Novosphingobium属、Lacunisphaera属、Fusibacter属 和Limnobacter属与pH 和DO 呈显著或极显著的负相关关系,而Limnobacter属、Escherichia-Shigella属和Azospira属均与pH、DO 有显著或极显著的正相关关系(图7)。
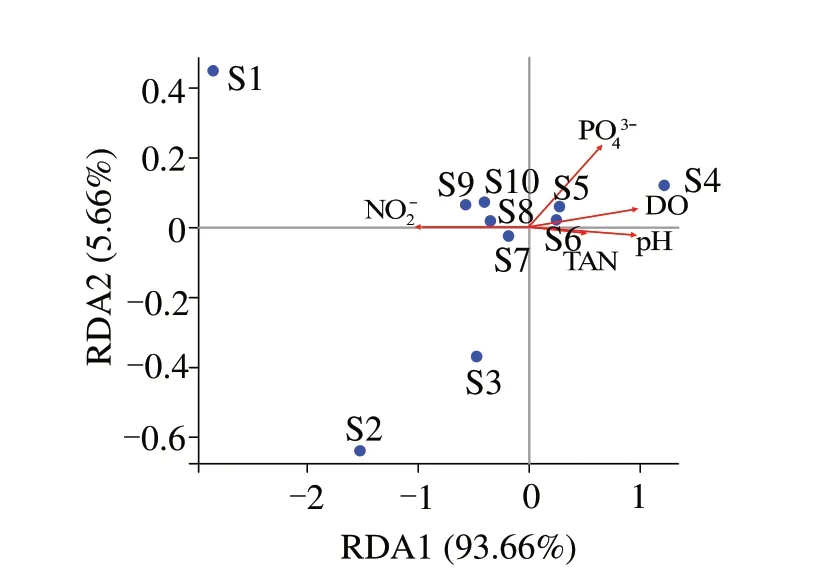
图6 属水平微生物群落结构组成与环境因子的RDA分析Fig.6 Redundancy analysis(RDA)of the top 10 genus microbial taxa and five environmental factors
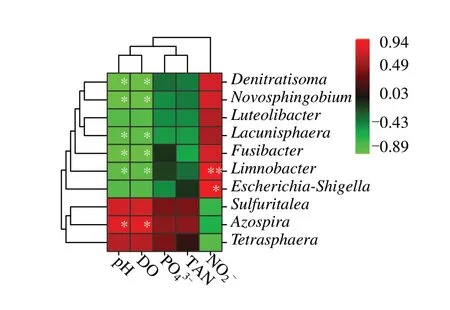
图7 属水平物种相对丰度与环境因子相关性热图Fig.7 Heat map of the correlation between relative abundance of top 10 genus microbial taxa and five environmental factors
3 讨论
养殖水体环境的稳定对于促进水体物质代谢,控制水产养殖病害和水质调控有重要作用。自然条件下池塘养殖水体溶氧主要来源于浮游植物的光合作用。由于中华鳖工厂化养殖在遮光恒温室内进行,浮游植物光合作用受到完全抑制。因此,高效的充气增氧,以建立水体良性微生态环境更为重要。微孔管充气方式因其充气气泡在水体中上升速率慢、浮力小,在水体中滞留时间长,氧传质效率高,可使水体溶氧量显著增加[6]。本研究显示,使用微孔管充气的水体溶解氧含量显著高于通底管充气(P<0.05),亚硝态氮含量显著低于后者(P<0.05),水体酸碱度更接近中性,水质环境更有利于水产养殖动物的生存健康。这与魏亚南等[7]使用微孔曝气方式调控海参(Stichopus japonicus)池塘水质环境的结果一致。研究表明,在养殖过程中使用微孔增氧技术,可有效提高养殖鱼塘的产量和水产品的品质,降低养殖尾水的污染。罗楠等[8]比较了草鱼(Ctenopharyngodon idella)养殖池塘微孔增氧与叶轮式增氧机增氧效果。结果表明,试验塘(微孔增氧)的草鱼终末体质量、增重率、特定生长率均显著高于对照塘(叶轮式增氧),饲料系数显著低于对照塘。在本研究的后续工作中,我们也发现使用微孔管充气的养殖池商品鳖产量达33~40 kg/m2,比使用普通底管模式可提高15%以上。
本研究显示,MA 组微生物的OTUs 数目和4 个α-多样性指数均显著高于DG组,表明MA组的微生物多样性水平明显优于DG组。RDA分析进一步显示,微生物群落结构与溶解氧、pH 密切相关。鱼类池塘水环境的稳定性与微生物多样性关系密切,当水体微生物群落多样性增加时,可降低水产养殖病害暴发的风险[11]。因此,本研究的微孔管充气可有效促进中华鳖工厂化养殖水体微生态环境的稳定,对于降低及控制养殖过程中病害暴发有潜在的积极意义。
本研究显示,不同的充气模式对于养殖水体的微生物群落结构有显著影响。在门水平上两种充气模式的第一优势菌均为变形菌门,DG 组的相对丰度显著高于MA 组(MA 组44.81%,DG 组66.99%)。变形菌门菌类是淡水养殖水体中分布最为广泛的微生物[11],在生物肠道内是极为常见的优势菌[12],在土壤和污水处理的氮、磷转换方面中有极重要作用[13-14]。本研究中,两种充气模式下养殖水体微生物均主要由变形菌门红杆菌科和红环菌科构成,但二者平均相对丰度差异极显著(P<0.01)。红杆菌科和红环菌科分属变形菌门的α 和β 簇群,目前已从中分离筛选出大量有良好反硝化聚磷能力的菌株[15]。操梦颖等[16]对主流-侧流序批式反应装置中污泥微生物群落组成的研究表明,反硝化优势菌科占比约39.5%~58.6%,与本研究反硝化优势菌科占比54.55%~58.57%的结果相符。
本研究中,MA 组芽单胞菌门和拟杆菌门的相对丰度显著高于DG 组的优势菌门(P<0.01)。芽单胞菌是养殖池塘和土壤中常见功能菌群,仅包含芽单胞菌科。芽单胞菌不仅有助于水体的反硝化过程[17],而且对养殖动物有益生作用[18]。罗衡等[19]研究稻鳖共作模式的土壤时发现,芽单胞菌的相对丰度与pH 呈显著正相关关系,这与本研究结果一致。拟杆菌门是水体环境中的重要微生物类群,属于化能有机营养菌,是进行氧化溶解性有机物和碳水化合物的主要消费者之一,在各种水体环境中碳循环过程中起着重要作用[20-21]。由于微孔管充气模式显著提高了养殖水体的溶解氧含量,因此提升了养殖水体中需氧菌群的相对丰度,进而可促进养殖水体中的溶解性有机物和碳水化合物的降解,改善水质环境。
在属水平上,两种充气模式均有较高比例未被检出的菌属(DG 组为68.70%,MA 组为79.48%),原因可能是本研究采用的是二代测序技术,测序读长较短,导致属水平的注释率偏低。在已被鉴定的菌属中,DG 组厌氧性菌属和间性厌氧性菌属的相对丰度显著高于MA 组(图7)。物种和环境的相关性分析结果显示,Denitratisoma属和Limnobacter属与pH 和溶解氧存在显著的负相关关系(图9)。Denitratisoma属是两种充气方式中相对丰度最高的属。该属属于变形菌门,是一类兼性厌氧反硝化菌属,具有完整的反硝化途径,可在微氧条件下利用系统内NO3-或NO2
-进行反硝化反应[22-23]。Limnobacter属则是具有降解反硝化过程中N2O 潜能的异养菌[24],可以缓冲外界环境对厌氧氨氧化菌的影响[25]。除Denitratisoma属和Limnobacter属外,DG 组还有相对丰度较高的Fusibacter属和Lacunisphaera属菌群。Fusibacter属是鱼类等水产动物肠道中常见的间性厌氧性菌类,与碳水化合物的发酵有关[12,26-27],而Lacunisphaera属则与生物膜的产生有关[28]。李卢国等[29]对黑鲷(Acanthopagrus schlegelii)循环水系统菌落结构的分析结果表明,低氧环境下可发生活跃的脱氮作用,有利于间性厌氧菌的生长。因此,厌氧反硝化菌属在DG 组较高的相对丰度,可能是本研究中DG 组氨氮含量略低于MA 组的原因之一。此外,本研究在DG 组中还发现了一定比例的Escherichia-Shigella菌属(1.37%),其相对丰度显著高于MA 组。Escherichia-Shigella属是常见于水生动物肠道内的条件致病菌,可引发宿主肠道疾病[30-31],但目前也有报道认为Escherichia-Shigella属可能在废水脱氮与沼气脱硫耦联系统中发挥着重要作用[32]。
本研究中,Sulfuritalea属、Azospira属和Tetrasphaera属相对丰度显著高于DG 组,是MA 组已鉴定菌群中的优势菌属。Sulfuritalea属为硫自养反硝化细菌,在水环境中可利用H2和单质硫等进行自养反硝化反应[33],是重要的生物修复功能菌种[34]。Azospira属是常见的好氧反硝化细菌,不仅存在于湖泊等天然水体的沉积物中[35],也是生物反应器中常见的优势菌群[36-37]。Azospira可将水体中的碳源作为电子供体进行反硝化作用,在为其自身生长提供能量同时,实现水体的脱氮[35]。Tetrasphaera属是一种具有反硝化功能的除磷菌类,可利用NOx-N 作为电子受体,降解细菌细胞内的脂质碳源PHB(聚-β-羟丁酸),并将细胞外的PO43--P 摄入细胞内,形成多聚偏磷酸盐,从而实现同步脱氮除磷的作用[38]。然而,本研究中MA 组和DG 组的磷酸盐含量差异并不显著(P >0.05),原因可能是Tetrasphaera属1.17%的相对丰度尚不足以抵消来自饲料投喂等磷输入途径的作用。
综上所述,使用微孔管充气方式可有效提升中华鳖工厂化养殖水体的溶解氧含量,降低亚硝态氮含量,提高微生物菌群的多样性,抑制条件致病菌的生长,这对于增强水体的微生物群落稳定性,降低病害暴发风险,维持水产养殖生态系统的健康具有积极作用。此外,本研究的结果初步揭示了中华鳖工厂化养殖水体的水质状态与微生物群落结构的关系,为中华鳖工厂化健康养殖技术的进一步优化提供了基础。
