地衣芽孢杆菌分批补料发酵γ-聚谷氨酸
2022-09-28郭建敏郭利飞赵廷彬李镇江江源刚叶莉唐晓芳杨志刚乔长晟
郭建敏,郭利飞,赵廷彬,李镇江,江源刚,叶莉,唐晓芳,杨志刚,乔长晟*
(1.天津科技大学生物工程学院,天津 300457;2.天津市工业微生物重点实验室,工业发酵微生物教育部重点实验室,天津 300457;3.天津慧智百川生物技术有限公司,天津 300457;4.四川百川金开生物工程有限公司,四川 成都 610000;5.四川省食品发酵工业研究设计院有限公司,四川 成都 610000)
γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)是由 D-谷氨酸和L-谷氨酸通过γ-羧基和α-氨基之间的酰胺键连接的阴离子均聚酰胺[1],其分子量大小在104kDa~108kDa之间[2]。γ-PGA是一种水溶性的可食用高分子氨基酸聚合物,其不具备免疫原性,对人体无害,且生物可降解[3]。由于具有这些特性,它在食品、医药、化妆品、农业和废水处理领域具有广泛的应用[4-8]。自从Lvanovice在炭疽芽孢杆菌中第一次发现γ-PGA[9],至今已经报道了多种产γ-PGA的芽孢杆菌,如地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)、凝结芽孢杆菌(Bacillus coagulans)。产生 γ-PGA的菌株根据生物聚合物生产对L-谷氨酸的需求分为两类:L-谷氨酸依赖性和非依赖性菌株。依赖于L-谷氨酸的菌株,在其培养基中添加前体物L-谷氨酸能够高水平地生物合成γ-PGA[10]。由于非依赖性菌株发酵γ-PGA产量不高,当前市场上主要利用L-谷氨酸依赖性菌株进行γ-PGA生产[11]。
在获得高产菌株的前提下,通过优化发酵培养基(如碳源、氮源、无机盐等)、优化发酵条件(如温度、pH值、溶氧等)、选择合适的发酵方式(如分批发酵、连续发酵、分批补料发酵等)是提高γ-PGA产量的重要手段[12-13]。在分批发酵中,一次性投料过多容易造成发酵液环境突变,不利于菌种生长代谢和目标产物的积累[14]。分批补料发酵是在发酵过程中对营养物质浓度进行控制,给菌体提供适宜的生长环境,使菌体的生产状态保持最大化,同时提高底物消耗利用率,实现目标产物提升的手段。王云龙等[15]通过分批补料蔗糖、蛋白胨、玉米浆,将L-天冬酰胺酶的酶活提高到了1 413.60 U/mL,较分批发酵提升了66.20%。Huang等[16]通过优化初始酵母膏、L-谷氨酸浓度以及分批流加葡萄糖的方法,将γ-PGA产量提高到了101.10 g/L。Kongklom等[17]通过在发酵过程中添加葡萄糖、柠檬酸和氯化铵的方法,将γ-PGA的产量提高到39.60 g/L。
本文利用地衣芽孢杆菌(Bacillus licheniformis)CGMCC NO.3336生产γ-PGA,使用葡萄糖和硫酸铵作为碳源和氮源,前期研究葡萄糖的最适初始浓度为90 g/L,硫酸铵的最适初始浓度为7 g/L[18]。在γ-PGA生产过程中,存在葡萄糖和氨氮在发酵40 h左右就被消耗殆尽的情况,所以本研究采用分批补料发酵方式式,通过流加葡萄糖溶液和硫酸铵溶液,对发酵液中葡萄糖浓度和氨氮浓度进行控制,并确定出持续补料时间,从而提升菌体生产γ-PGA的能力,为工业上高效生产γ-PGA提供技术支持。
1 材料与方法
1.1 材料与试剂
地衣芽孢杆菌(Bacillus licheniformis)CGMCC NO.3336:天津北洋百川生物技术有限公司;硫酸镁、硫酸钙、硫酸亚铁、硫酸铵、硫酸钾、葡萄糖(均为分析纯):天津市科密欧化学试剂有限公司;味精(工业级):梅花生物科技集团股份有限公司;酵母膏(食品级):安琪酵母股份有限;酵母浸粉、胰蛋白胨、蛋白胨(食品级):北京奥博星生物技术有限公司。
1.2 仪器与设备
FE20 pH计:梅特勒-托利多(上海)仪器有限公司;TGL-16G高速台式离心机:上海安亭科学仪器厂;752紫外分光光度计:天津市光学仪器厂;SBA-40E生物传感仪:山东省科学院生物研究所;LC-20AT高效液相色谱分析仪:日本岛津仪器有限公司;GRJB-5D 5 L发酵罐:镇江格瑞生物工程有限公司;BIOTECH 30 L、200 L发酵罐:上海保兴生物设备过程有限公司;NDJ-8S黏度计:上海舜宇恒平科学仪器有限公司;YM灭菌锅:上海三申医疗器械有限公司。
1.3 方法
1.3.1 培养基的配制
固体培养基:NaCl10g/L,胰蛋白胨10g/L,酵母浸粉5g/L,琼脂2%。调节初始 pH7.2~7.3,121℃灭菌20 min。
种子培养基:葡萄糖30g/L(单独灭菌),酵母膏7 g/L,胰蛋白胨6 g/L,蛋白胨4 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,调节初始 pH7.2~7.3,121℃灭菌 20 min。
发酵培养基:味精70g/L(单独灭菌),葡萄糖90g/L,酵母膏10g/L,蛋白胨5g/L,(NH4)2SO47g/L,K2SO415g/L,CaSO4·2H2O 0.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.1 g/L,甘油 60 mL/L。调节初始 pH7.2~7.3,121℃灭菌20 min。
补料培养基:葡萄糖750 g/L(单独灭菌),硫酸铵30 g/L(单独灭菌)。
1.3.2 菌种培养方法
种子活化:在无菌操作台用接种环从甘油管中蘸取2~3环菌液,划线于固体培养基,放置在37℃恒温培养箱中培养16 h。然后将培养皿中的菌种挑起,并均匀涂抹于斜面培养基上,37℃恒温培养12 h。
种子培养:接种前将灭菌后的葡萄糖溶液转入装有种子培养基的三角瓶中,然后使用接种环将活化好的菌种斜面接种于装有100 mL种子培养基的500 mL无挡板三角瓶中,置于转速为220 r/min的37℃恒温摇床中培养14 h~16 h。
5L发酵罐发酵培养:接种前投入单独灭菌的味精600mL,调初始pH7.2~7.3,将300mL种子液转入发酵罐中,总装液量达到3 L。调节通风量为1.25 m3/(m3·min),搅拌转速为400 r/min,温度为37℃,罐压为0.02 MPa,培养72 h。
30 L种子罐培养:在无菌操作室内将试管中的菌体斜面使用无菌水洗起,均匀涂抹于2个装有固体培养基的茄子瓶中,放置于37℃恒温培养箱中培养12 h。然后将茄子瓶中菌体用无菌水洗起,与单独灭菌好的葡萄糖一起转入装有种子培养基的30 L种子罐中,总装液量达到15 L,调节通风量为1.25 m3/(m3·min),搅拌转速为300 r/min,温度为37℃,罐压为0.02 MPa,培养至 OD660达到 0.21~0.23。
200 L发酵罐培养:使用外置管路将30 L种子罐的15 L种子液导入装有135 L发酵培养基的200 L发酵罐中,调节通风量为1.25 m3/(m3·min),搅拌转速为300 r/min,温度为37℃,罐压为0.02 MPa,发酵72 h。
1.3.3 葡萄糖和硫酸铵流加方法
在发酵过程中,菌种在不同生长阶段对营养物质消耗速率是不同的,所以采用变速流加方法,选取1.0、1.5、2.0 g/(L·h)为补料速率。在发酵过程中,当发酵液中葡萄糖质量浓度低于2、5、15、25 g/L时,开始流加浓度为750 g/L的葡萄糖溶液,使发酵液中的葡萄糖浓度维持在 2 g/L~5 g/L、5 g/L~15 g/L、15 g/L~25 g/L、25 g/L~35 g/L(葡萄糖浓度处于不同浓度范围的临界值时,作为小于当前浓度处理);当发酵液中氨氮浓度低于0.1、0.5、1.0g/L时,流加浓度为75g/L的硫酸铵溶液,使发酵液中的氨氮浓度维持在 0.1 g/L~0.5 g/L、0.5 g/L~1.0 g/L、1.0 g/L~1.5 g/L(氨氮浓度处于不同浓度范围的临界值时,作为小于当前浓度处理)。
1.3.4 分析计算
1.3.4.1 菌体浓度测定
取1 mL发酵液至25 mL容量瓶,定容后以蒸馏水作为空白对照,采用分光光度计测定660 nm处的吸光度(OD660),稀释倍数为固定数值25,用OD660表示菌体浓度。菌体浓度计算公式如下。
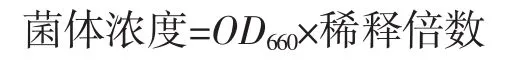
1.3.4.2 葡萄糖和谷氨酸浓度测定
取10 mL发酵液,在15 000 r/min条件下离心15 min,取1 mL上清液至100 mL容量瓶,定容后采用SBA-40生物传感器测定葡萄糖浓度和谷氨酸浓度。
1.3.4.3 氨氮浓度检测
氨氮浓度采用奈斯勒试剂,通过比色法测定[19]。
1.3.4.4 γ-PGA含量的测定
首先取1 mL上清液至50 mL容量瓶中,纯净水定容,然后使用0.22 μm微孔滤膜过滤,最后采用高效液相色谱分析仪检测γ-PGA含量;色谱柱条件:Shodx SB-800HQ凝胶渗透色谱柱,0.05 mol/L无水硫酸钠缓冲液洗脱,流速0.5 mL/min,检测波长210 nm,柱温30 ℃,进样体积 20 μL。
1.3.4.5 生产强度的计算
生产强度计算公式如下。
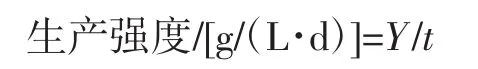
式中:Y 为 γ-PGA 含量,g/L;t为发酵时间,d。
1.3.4.6 谷氨酸利用率的计算
谷氨酸利用率计算公式如下。
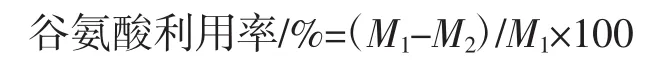
式中:M1为初始谷氨酸浓度,g/L;M2为发酵结束时谷氨酸浓度,g/L。
1.4 数据处理与分析
数据处理及作图均使用Origin软件完成。
2 结果与分析
2.1 维持不同葡萄糖浓度对发酵γ-PGA的影响
当葡萄糖浓度低于2、5、15、25 g/L时,采用分批补料发酵方式对发酵液的葡萄糖浓度进行控制。通过对发酵液的OD660、pH值、葡萄糖浓度、谷氨酸浓度、黏度、γ-PGA产量的测定,明确维持不同葡萄糖浓度对发酵γ-PGA的影响,结果见图1。
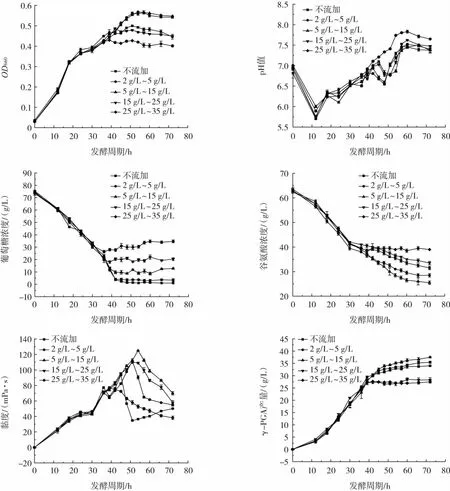
图1 维持不同葡萄糖浓度对发酵γ-PGA含量的影响Fig.1 Effects of different glucose concentrations on fermentation of γ-PGA
如图1所示,不进行葡萄糖流加,菌体在48 h时进入稳定生长期,发酵结束时OD660达到0.44,谷氨酸浓度为31 g/L,γ-PGA 产量达到(34.01±0.53)g/L。当葡萄糖浓度维持在2 g/L~5 g/L、5 g/L~15 g/L,发酵72 h结束时,OD660皆达到了0.54;菌体进入稳定生长期的时间分别为51、54 h,指数生长期分别延长了3、6 h;发酵液中的谷氨酸浓度为28 g/L和25 g/L,谷氨酸利用率较不补料发酵提升了7.69%和15.38%;γ-PGA含量分别为(35.47±0.45)g/L 和(37.51±0.61)g/L,较不补料发酵提升了4.29%和10.29%。当葡萄糖浓度维持15 g/L~25 g/L、25 g/L~35 g/L,发酵 72 h结束时 OD660分别为0.44、0.40;菌体进入稳定生长期的时间分别为45、42 h,指数生长期分别缩短了3、6 h;发酵液中的谷氨酸浓度为33 g/L和39 g/L,谷氨酸利用率较不补料发酵降低了6.45%和25.80%;γ-PGA含量分别为(28.29±0.75)g/L和(27.51±0.73)g/L,较不补料发酵降低了16.81%和19.11%。
经过分析可知,γ-PGA伴随着菌体的生长发育而积累,积累速率与生长状态密切相关。在菌体处于指数生长期时,γ-PGA的积累速率最大,随着菌种进入稳定生长期,γ-PGA的积累变缓。当菌体生长发育面临营养物质缺乏时,谷氨酸钠也可能被作为碳源和氮源所消耗利用[11]。维持葡萄糖浓度在2 g/L~5 g/L、5 g/L~15 g/L,有利于菌体的生长发育,使得菌体的指数生长期延长并保持一定的γ-PGA生产活性;进一步促进了底物谷氨酸的消耗利用,使得γ-PGA产量提高。维持葡萄糖浓度在 15 g/L~25 g/L、25 g/L~35 g/L 时,高浓度的碳源会对菌体的生长发育造成不同程度的抑制,使菌体提前进入稳定生长期,γ-PGA积累速率下降。在维持葡萄糖浓度为25 g/L~35 g/L时,出现了发酵液pH值明显高于其他试验组的情况,这可能是因为过高的碳源浓度造成菌体产生过量的副产物所引起的[20],不利于γ-PGA的积累。综上所述,选择合适的补料时机并维持适宜的葡萄糖浓度,对菌体的生长发育和γ-PGA的积累具有一定的促进作用,所以选择在发酵过程中葡萄糖浓度低于5 g/L时,通过流加葡萄糖溶液维持葡萄糖浓度在5 g/L~15 g/L。
2.2 维持不同氨氮浓度对发酵γ-PGA的影响
氮源作为菌体生长代谢的必需营养物质,能直接影响到发酵过程中氨基酸的代谢合成[21]。硫酸铵作为微生物发酵的速效氮源,是培养基中氨氮营养的合适补充者[22]。在分批发酵过程中,氨氮质量浓度一般会在42 h降至0.1 g/L以下。在控制培养基中葡萄糖浓度的同时,采用变速流加方式流加硫酸铵溶液,控制发酵液中氨氮浓度,以保障菌体生长发育和目标代谢产物积累。设计了维持氨氮浓度在0.1 g/L~0.5 g/L、0.5 g/L~1.0 g/L、1.0 g/L~1.5 g/L 3 种方法,结果见图2。
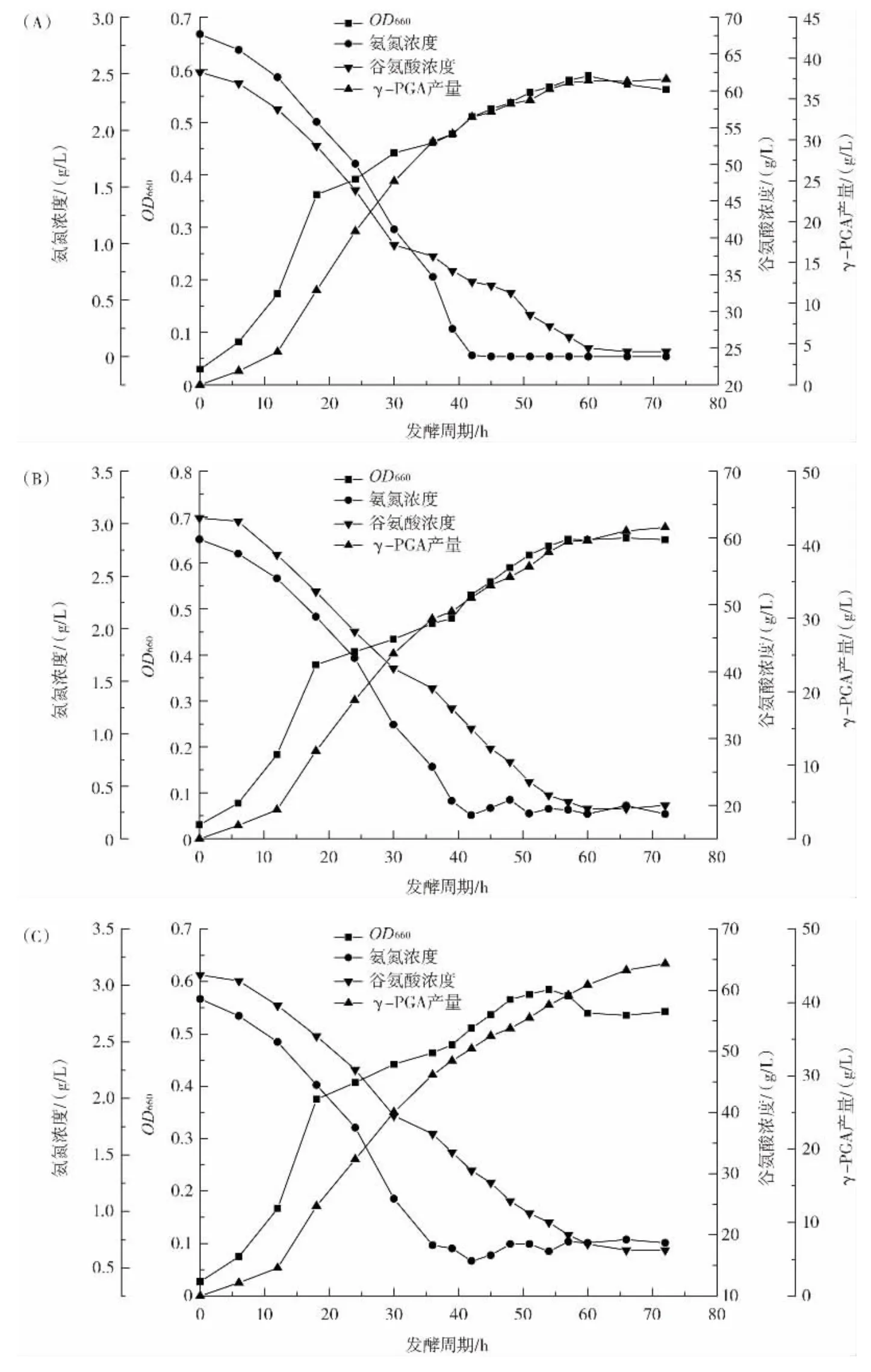
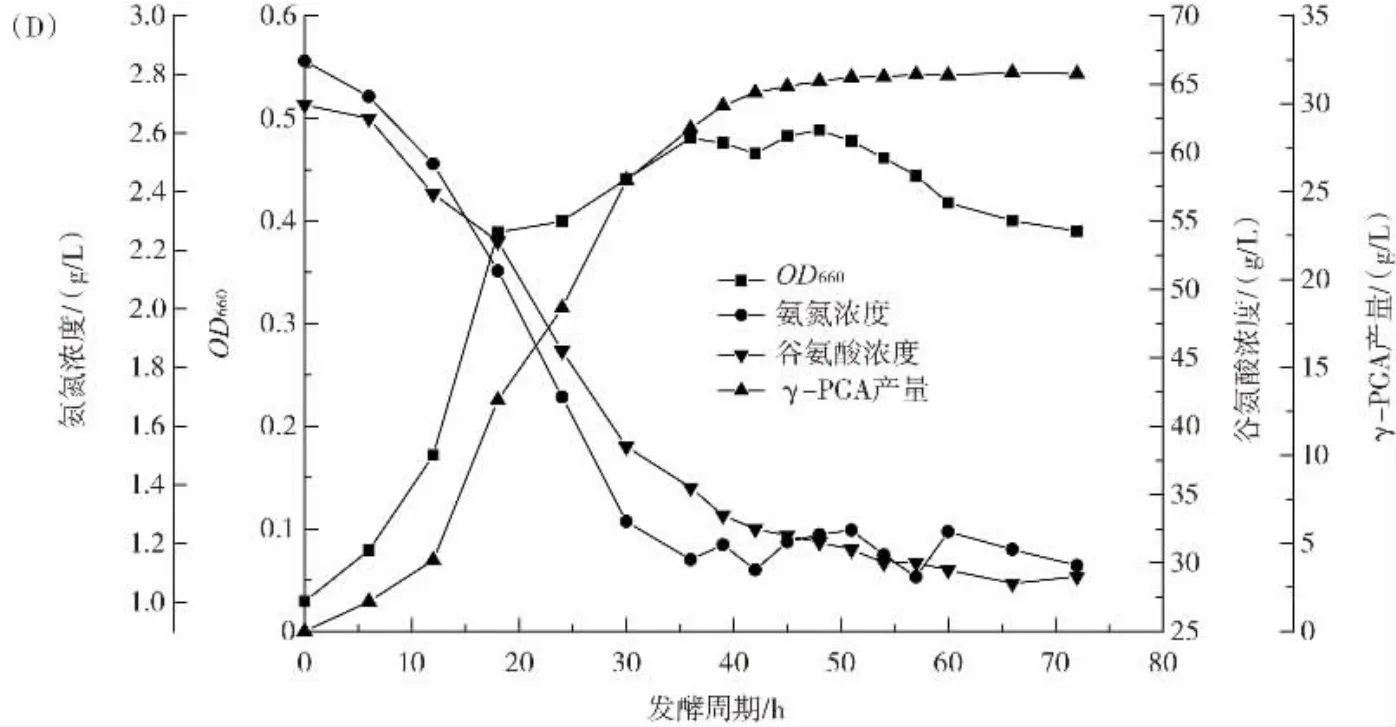
图2 维持不同氨氮浓度对发酵γ-PGA的影响Fig.2 Effects of maintaining different ammonia concentration on fermentation of γ-PGA
从图2可以看出,不同氨氮浓度对OD660、谷氨酸浓度、γ-PGA产量影响较大。只补料葡萄糖,发酵结束时OD660为0.56,谷氨酸浓度为25 g/L,γ-PGA产量为(37.51±0.64)g/L;当维持氨氮浓度在 0.1 g/L~0.5 g/L、0.5 g/L~1.0 g/L,发酵结束时 OD660为 0.65、0.54,谷氨酸浓度为20 g/L和18 g/L,谷氨酸利用率较只流加葡萄糖提升了13.52%和18.93%,γ-PGA产量为(42.36±0.70)g/L 和(45.29±0.81)g/L,较只流加葡萄糖提高了12.93%和20.74%;当维持氨氮浓度为1.0 g/L~1.5 g/L,发酵结束时OD660为0.39,谷氨酸浓度为29 g/L,γ-PG产量为(31.71±0.65)g/L,较只补料葡萄糖均出现了明显下降。
由图2分析可知,随着氨氮浓度逐渐提高,OD660、谷氨酸消耗量和γ-PGA产量均出现先升高后下降的情况。这表明将硫酸铵和葡萄糖搭配流加并维持其浓度在适宜范围,有利于菌体生长发育和保持菌体胞内酶的活性,使得菌体增加了对底物的消耗利用,尤其谷氨酸利用率大幅增加,促进了γ-PGA的合成积累。但如果提供的氨氮量超过了菌体生长和产物合成所需,会对菌体的生长发育造成不同程度的抑制,使得菌种过早进入稳定生长期或者稳定生长期缩短提前进入衰亡期,这都会造成γ-PGA合成量下降。此外,氨氮的补充大大提高了菌体对底物谷氨酸的利用。综上所述,当发酵液中氨氮浓度低于0.5 g/L时,通过流加硫酸铵溶液将氨氮浓度控制在0.5 g/L~1.0 g/L有利于γ-PGA发酵。
2.3 不同持续流加时间对发酵γ-PGA的影响
考虑到菌体对营养物质的需求量会因菌体所处生长阶段不同而发生变化,探究了葡萄糖溶液和硫酸铵溶液的持续流加时间对发酵γ-PGA产量的影响,结果见表1。
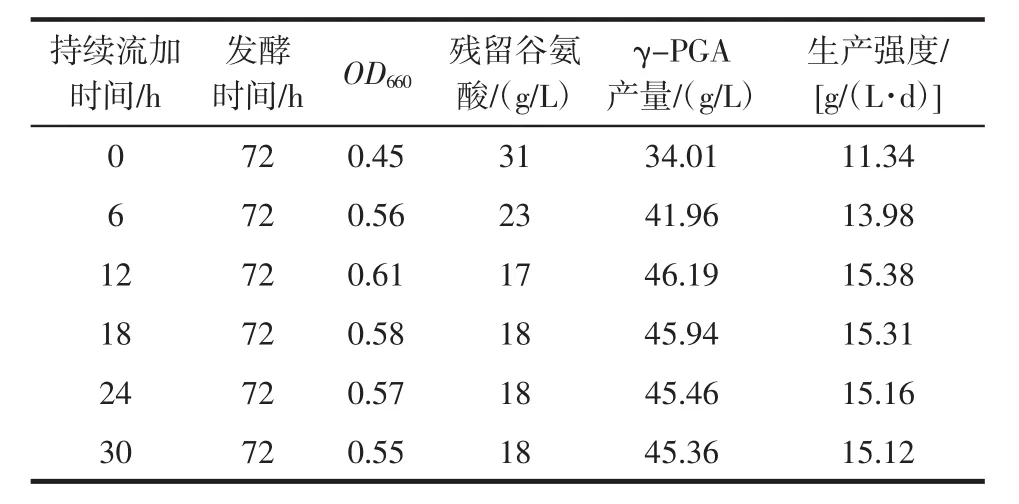
表1 不同持续流加时间对发酵γ-PGA产量的影响Table 1 Effects of different duration on fermentation of γ-PGA
由表1所示,在发酵54 h前进行葡萄糖、硫酸铵溶液流加补料,使得OD660、谷氨酸消耗量、产量和生产强度随着补料持续时间的延长而增加。持续流加葡萄糖、硫酸铵溶液12 h,发酵液最终OD660达到0.61,谷氨酸含量为17 g/L,γ-PGA产量为46.19 g/L,生产强度达到15.38 g/(L·d)。如发酵54 h后继续流加葡萄糖溶液和硫酸铵溶液,会造成菌体量下降或菌体活性降低,对γ-PGA的合成积累没有促进作用。
由表1可知,发酵培养54 h是地衣芽孢杆菌(Bacillus licheniformis)CGMCC NO.3336生长发育和积累γ-PGA的一个重要临界点。持续流加葡萄糖、硫酸铵溶液12 h可以使菌种的指数生长期和稳定生长期得到不同程度地延长,且在稳定生长期时能保持一定的γ-PGA代谢活性,增加了底物谷氨酸的消耗转化,合成积累更多γ-PGA;在54 h停止流加补料,发酵液中的葡萄糖和氨氮在后续发酵中被耗尽,避免了营养物质的浪费。适当的流加时间,不仅可以避免碳源和氮源提供过多对菌体生长发育和γ-PGA生产积累造成不利影响,还可以减少生产成本的增加。此外,发酵结束后,发酵液中的葡萄糖耗尽更有利于γ-PGA的提取纯化[16]。因此,确定12 h为葡萄糖、硫酸铵溶液最适流加时间。
2.4 200 L罐放大验证
为了验证分批补料发酵条件优化后菌体发酵性能的稳定性,利用200 L发酵罐进行重复试验,在200 L发酵罐中,加料量进一步扩大。200 L发酵罐生产γ-PGA各参数随时间变化情况见图3。
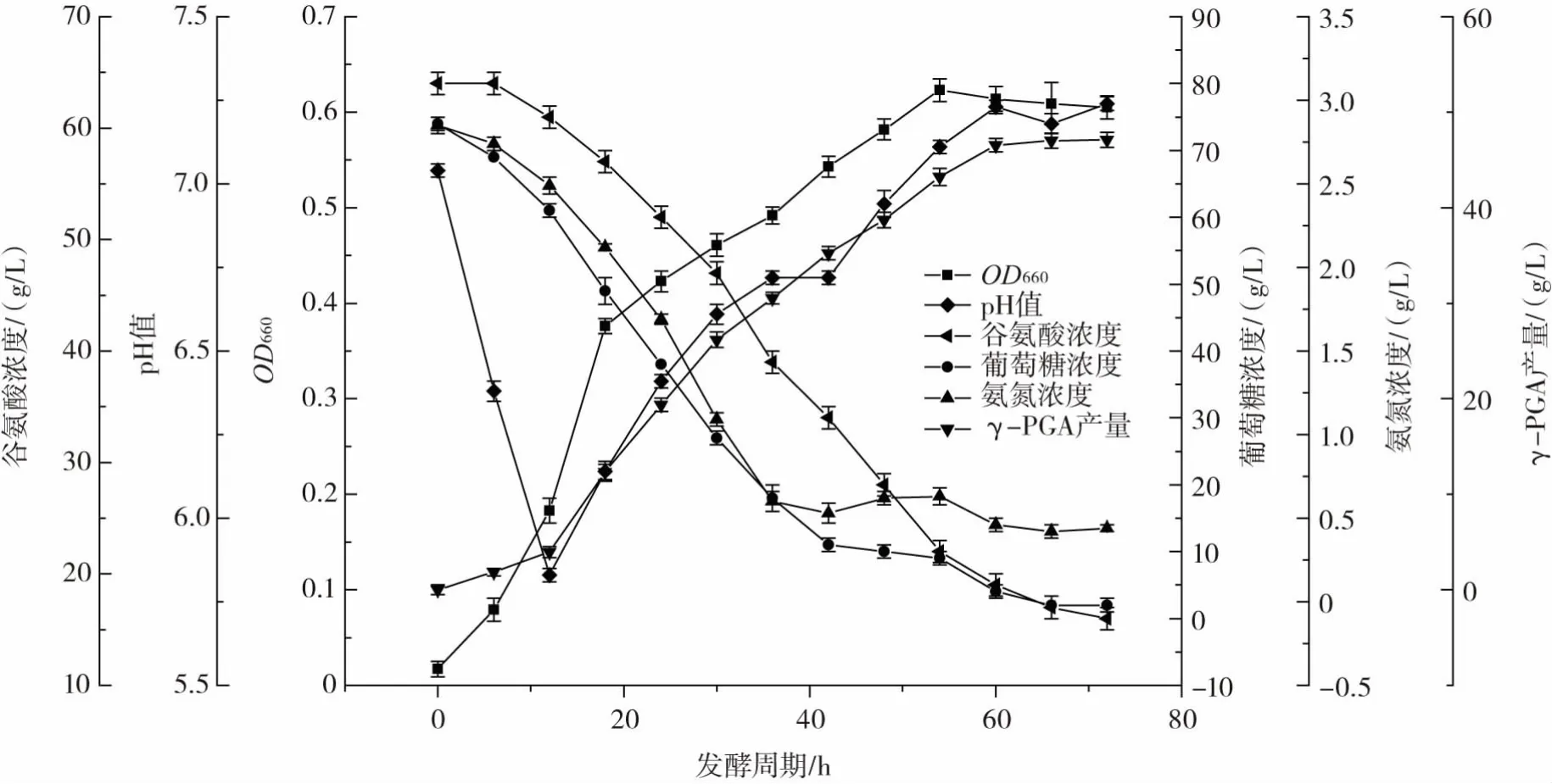
图3 200 L发酵罐生产γ-PGA各参数随时间变化情况Fig.3 The variation of γ-PGA parameters in 200 L fermentation tank with time
由图3可以看出,在发酵过程中OD660、pH值、葡萄糖浓度、谷氨酸浓度、氨氮浓度、γ-PGA积累量的变化趋势与5 L罐发酵基本一致,连续3次分批补料发酵均可稳定高产γ-PGA。菌体发酵72 h后,菌体OD660达到了0.62,较不补料发酵前提高了39.01%,谷氨酸利用率为77.14%,较不补料发酵提高了38.47%,γ-PGA产量为(47.09±0.82)g/L,较不补料发酵提高了38.45%。200 L罐发酵水平略优于5 L罐发酵,这可能是由于200 L发酵罐高径比大于5 L发酵罐,增加了发酵液的传质系数,提升了氧气的利用率。这一结果验证了在5 L发酵罐进行的分批补料优化成果,即通过分批补料流加方式对发酵液中葡萄糖和氨氮进行适宜补充和控制,能够显著提升菌体生长和γ-PGA合成。
3 结论
本研究分别以葡萄糖和硫酸铵作为碳源和氮源,采用变速流加方法补料,对发酵液中葡萄糖浓度和氨氮浓度的控制范围以及持续控制时间进行优化。试验结果表明,当培养基中葡萄糖浓度低于5 g/L,氨氮浓度低于0.5 g/L时开始流加补料。在200L发酵罐中,葡萄糖浓度控制在5 g/L~15 g/L,氨氮浓度控制在0.5 g/L~1.0g/L,持续控制12 h进行γ-PGA分批补料发酵,菌体的指数生长期延长了6 h,菌体量明显提升,发酵72 h结束时OD660达到了0.62,并且菌体处于稳定生长期仍合成大量γ-PGA,谷氨酸浓度降至了16 g/L,γ-PGA生产强度达到了15.69 g/(L·d),最终发酵液中γ-PGA产量达到了(47.09±0.82)g/L。相对于不补料发酵,菌体量提升了39.01%,谷氨酸利用率提高了38.47%,γ-PGA生产强度和产量均提高了38.45%。这一结果对实现γ-PGA高效发酵具有借鉴意义。
