CA9基因在舌鳞状细胞癌组织中的表达及其预后价值分析
2022-09-28赵格黎昌学郭超
赵格 黎昌学 郭超
舌鳞状细胞癌(tongue squamous squamous cell cellcarcinomas carcinomas,TSCC)是口腔鳞状细胞癌中最常见的子型,近年来发病率有所上升[1-2]。与口腔其他部位的癌症相比,舌鳞癌进展迅速,转移率高,预后差[3]。TNM分期被认为是舌鳞癌的关键预后因素[4],然而由于高度异质性,TNM分期不能描述同一分期患者的个体风险。因此,迫切需要新的基因标志物来区分高危患者,以协助指导个体化治疗,延长患者生存时间。
肿瘤缺氧微环境不仅在肿瘤的增殖分化中起着关键作用,还影响了手术和放化疗的疗效反应[5-6]。碳酸酐酶9(carbonic anhydrase 9,CA9)是缺氧诱导作用最强的基因之一,可调节细胞增殖和细胞内外酸碱平衡,在肺、乳腺、结直肠、膀胱、子宫和头颈部等恶性肿瘤中高表达[7]。Potter等[8]研究表明CA9在多种肿瘤细胞中的异常表达与不良预后有关,可作为侵袭性恶性行为的标志,预测疾病进展。
本研究通过癌症基因组图谱(the cancer genome atlas,TCGA)分析CA9在舌鳞癌中的表达和对患者预后的影响,并通过基因集富集分析(gene set enrichment analysis,GSEA)探索CA9可能参与的肿瘤相关信号通路,为明确CA9在舌鳞癌中发生发展机制奠定基础。
1 材料与方法
1.1 数据来源
2020 年3 月26 日于TCGA官网下载舌鳞状细胞癌RNA-Seq表达数据及其临床信息。得到147 例舌鳞癌组织样本、15 例癌旁组织样本和156 例舌鳞癌患者信息。将CA9表达信息与临床信息合并,用于后续分析。
1.2 GSEA富集分析
使用GSEA将CA9按照表达高低进行排序,检验KEGG通路基因集是否在这个排序表的顶端或者底端富集。设置随机组合次数为1 000 次,计算标准化富集系数。筛选出符合FDR≤0.25,P≤0.05的结果作为显著富集通路。
1.3 统计学方法
统计分析通过R语言3.6.2版本及其附属包来实现。采用Wilcoxon秩和检验分析舌鳞癌组织与癌旁组织CA9的表达差异。采用Wilcoxon、Kruskal-Wallis秩和检验和逻辑回归分析分析CA9与临床病理特征的关系。Kaplan-Meier生存分析采用Log-rank检验法。CA9表达和其他临床特征(年龄Age、性别Gender、病理分级Grade、临床分期Stage、区域淋巴结转移N、原发肿瘤范围T)对生存率影响采用单因素、多因素Cox回归分析。
2 结 果
2.1 CA9在舌鳞癌及癌旁组织中的表达差异
舌鳞癌组织中CA9表达量高于癌旁组织,差异具有统计学意义(P<0.001)(图1A)。而且15 例舌鳞癌组织中CA9表达水平也明显高于其配对癌旁组织,差异有统计学意义(P<0.001)(图1B)。

图1 CA9在舌鳞癌和癌旁组织中的表达
2.2 舌鳞癌组织中CA9表达水平与临床病理特征关系
Wilcoxon、Kruskal-Wallis秩和检验表明CA9表达水平与肿瘤大小(T)相关(P=0.007),但与年龄、性别、病理分级、临床分级、淋巴转移结情况不相关(P>0.05)(表1)。逻辑回归分析显示T2、T3、T4期舌鳞癌CA9表达量均高于T1期,OR值分别为3.76、8.50、5.10(表2)。

表1 CA9表达与临床病理相关性(秩和检验)

表2 CA9表达与临床病理特征相关性(逻辑回归)
2.3 CA9的表达水平与舌鳞癌患者预后关系
以CA9表达量中位值为依据将肿瘤组样本划分为高低表达两组,Kaplan-Meier生存分析显示CA9高表达组死亡率比低表达组高(P=0.001)(图2)。患者1 年生存率ROC曲线的AUC值为0.747(图3)。
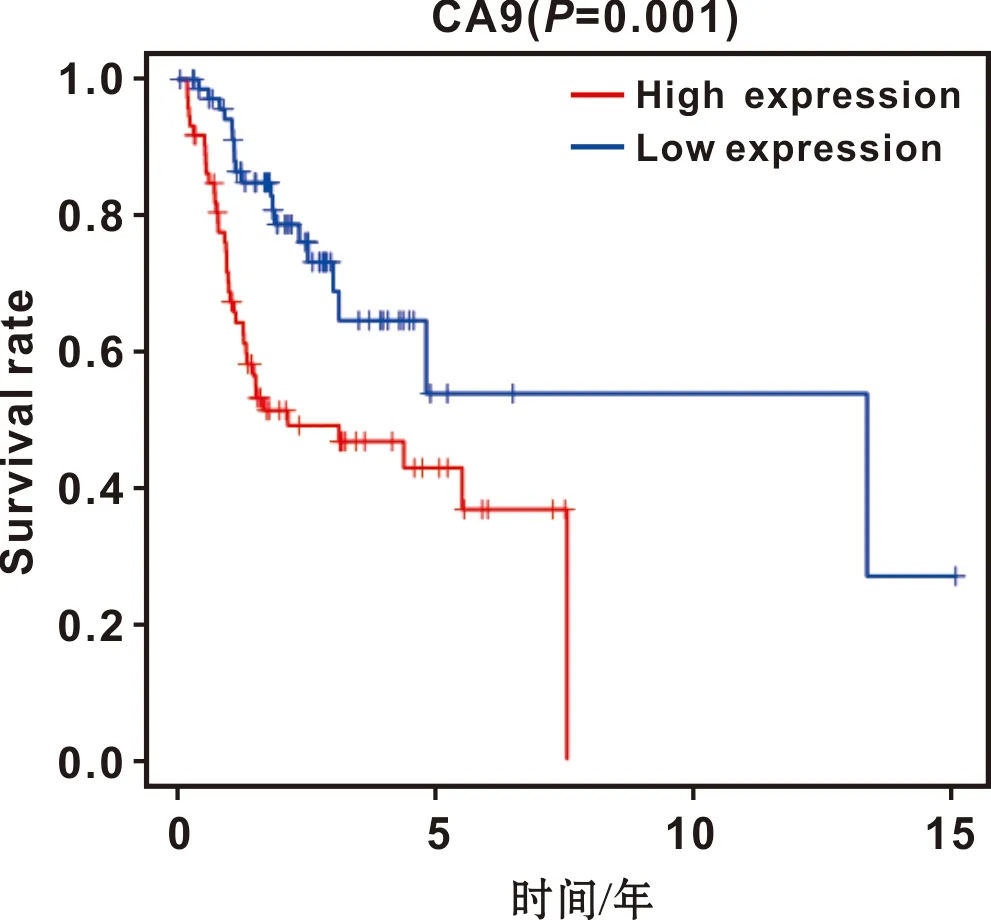
图2 TCGA数据库中CA9表达水平与舌鳞癌患者预后的生存曲线
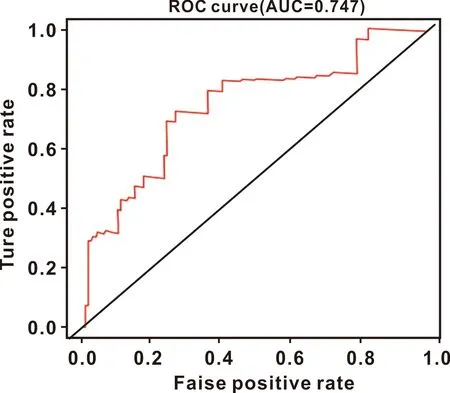
图3 舌鳞癌患者1年生存率ROC曲线的AUC值
单因素Cox回归分析显示,CA9表达量与患者的总生存率明显相关(P<0.001);多因素Cox回归分析表明在考虑其他临床因素时,CA9是影响舌鳞癌患者总生存率的独立预后因素(P<0.001)(表3)。

表3 舌鳞癌患者临床病理特征对预后影响的单因素及多因素分析
2.4 CA9功能富集分析
为了解CA9表达对舌鳞癌的影响,本研究对CA9高表达组与低表达组数据集进行了GSEA富集分析。CA9高表达富集在糖酵解糖异生、磷酸戊糖途径、氨基糖和核苷酸糖代谢、不饱和脂肪酸生物合成途径、丙酮酸代谢、DNA复制、核苷酸切除修复、同源重组、错配修复、碱基切除修复、剪切体、细胞周期、膀胱癌等相关通路(表4)。CA9表达与上述通路中的基因表达成正相关。

表4 GSEA富集分析CA9相关信号通路
3 讨 论
舌鳞状细胞癌恶性程度高、预后差。被认为具有良好预后的Ⅰ、Ⅱ期舌鳞癌仍有较高的死亡率[9]。因此,迫切需要预测舌鳞癌预后风险的生物标志物,这有助于个性化治疗的实现。缺氧是肿瘤重要的微环境,通过诱发酸性内环境、重塑细胞外基质、触发肿瘤微血管形成、诱导上皮间质转化、促进肿瘤免疫逃避肿瘤适应、维持肿瘤干细胞存在等机制促进肿瘤增殖。靶向缺氧关键基因可能成为新的有效的肿瘤治疗策略。CA9在多种肿瘤中差异表达,是肿瘤缺氧的内源性标志物,受缺氧诱导因子-1(HIF-1)的转录调控但比HIF-1更稳定,具备作为稳定预测因子的条件[10-12]。
每种肿瘤都有独特的突变,呈现不同的临床表现并与特定的风险因素相关[5]。尽管已有部分研究证明CA9在头颈部及口腔鳞癌中差异表达[13],但舌鳞癌中CA9表达情况与预后关系鲜有报导。本研究通过TCGA数据分析发现,与癌旁组织相比CA9在舌鳞癌组织中高表达。CA9的表达与T分期相关,T2-T4期患者中CA9的表达均高于T1期,提示舌鳞癌中CA9可能发挥促肿瘤细胞的作用。Kaplan-Meier生存分析显示CA9高表达组比低表达组死亡率高,且患者1年生存率ROC曲线AUC值为0.747,表明该基因在预测舌鳞癌患者生存预后风险方面具有较好预测能力。单因素和多因素Cox回归分析显示CA9是影响舌鳞癌患者总生存率的独立预后因素,有力证明了其在舌鳞癌中较高的预后价值。
为了解CA9基因表达对肿瘤发生发展的影响,我们通过GSEA富集分析得到CA9高表达组富集集中在糖酵解与糖异生、磷酸戊糖途径、氨基糖和核苷酸糖代谢、不饱和脂肪酸等生物合成途径。文献表明缺氧状态下肿瘤细胞的存活依赖于糖酵解活性的增加[14]。糖酵解为生物合成(如核苷酸、氨基酸和脂质)提供底物,促进肿瘤细胞增殖[15]。Chafe等[16]发现靶向CA9可降低肿瘤细胞的糖酵解代谢和细胞外酸化,使免疫细胞杀伤增强。证明CA9是参与糖酵解促进肿瘤增殖的重要基因。其次,CA9是稳定胞外酸性环境的重要蛋白,CA9维持的细胞外酸性微环境可中和缺氧条件下谷氨酰胺代谢产生的有毒废物氨,进而为线粒体TCA循环和戊糖磷酸途径提供支持,为合成肿瘤细胞所需的氨基酸、核苷酸、脂肪酸、氨基己糖等提供原料[17]。以上与GSEA富集结果一致,表明CA9在舌鳞癌中可通过增强糖酵解和维持谷氨酰胺代谢环境促进肿瘤生长。此外,GSEA富集显示CA9高表达与细胞周期和DNA损伤等通路密切相关,提示CA9或可直接促进舌鳞癌细胞增殖发挥促癌作用。
本研究仅对CA9基因表达量进行了研究探讨,后续还需实验验证CA9蛋白在舌鳞癌组织中的表达。综上所述,本研究通过TCGA数据库挖掘明确CA9表达是影响舌鳞癌预后的独立风险因素,通过GSEA富集分析预测了CA9影响预后的机制。为舌鳞癌预后判断提供了候选生物标志物,并为探讨CA9参与舌鳞癌进展的分子机制研究提供了理论基础。
