气相色谱-三重四级杆串联质谱法测定易腐果蔬中的环酰菌胺残留量
2022-09-28康兆广武笑颖周莉莉孙胜敏王一村侯广月王苹苹李梓源李延臻栾文惠
康兆广,武笑颖,周莉莉,孙胜敏,王一村,侯广月,王苹苹,袁 雪,姜 鑫,李梓源,李延臻,栾文惠
(山东省产品质量检验研究院,国家加工食品质量检验检测中心(山东),山东济南 250102)
环酰菌胺是一种新型酰胺类内吸性杀菌剂,可以有效防治农作物灰霉病、菌核病等腐烂病害,对其他种类杀菌剂产生抗药性的菌群也有效,该农药主要用于防治蔬菜、水果等各类农作物的病害[1-3]。由于其不易产生交互抗性,对各类作物安全性高、对环境友好性强,环酰菌胺是一种应用前景较好的新型杀菌剂[4-6]。基于生物安全考虑,CAC、欧盟和日本等国家和地区所制定的环酰菌胺在各类食品中最高残留限量为0.02~30 mg/kg[7-9]。国内外对该化合物残留检测方法的报道较少[10-15],而且国内残留分析前处理方法较繁琐[16-19],如《JAP-068 环酰菌胺检测方法》,前处理过程所用试剂较多,且重复多次提取,最终净化上机过程相当繁琐。因此,研究易腐果蔬中环酰菌胺快速准确的分析方法极为必要。
本研究参照QuEChERS 前处理技术的分散固相萃取技术[20-21],采用混合吸附剂净化,拟建立一种用气相色谱-三重四级杆串联质谱(gas chromatography-triple quadrupole mass spectrometry,GC-MS/MS)法测定果蔬中的环酰菌胺。
1 材料与方法
1.1 材料与试剂
5 种基质(桑葚、草莓、葡萄、菠菜、小白菜)均为市售,2022 年3 月10 日于济南市七里堡综合批发市场购买,每种各3 kg。
乙腈、丙酮,均为色谱纯,德国Merke 公司;氯化钠、无水硫酸镁,均为分析纯,国药集团化学试剂有限公司,用前在450 ℃烘5 h,冷却至200 ℃时取出置于干燥器内备用;Cleanert PSA 净化剂、Cleanert ODS C18-N 净化剂、Cleanert Pesti Carb 净化剂,天津博纳艾杰尔科技有限公司;环酰菌胺标准物质,CAS 号:126833-17-8,分子式:C14H17Cl2NO2,纯度≥99.5%,德国Dr Ehrenstorfer GmbH 公司。
1.2 仪器与设备
Agilent 8890-7010B 气相色谱-三重四级杆串联质谱仪,美国Agilent 公司;T25 高速分散机,德国IKA 公司;Sigma 3-30K 高速冷冻离心机,德国Sigma 公司;Al204 分析天平,感量0.01 mg,瑞士Mettler 公司。
1.3 方法
1.3.1 标准溶液配制
标准储备溶液:准确称取环酰菌胺标准品10.05 mg置于50 mL 小烧杯中,用丙酮溶解后转移至25 mL 容量瓶中,然后多次洗涤小烧杯并将其转移至容量瓶中,最后用丙酮定容至刻度,分别配成500 μg/mL 标准储备溶液。
标准中间溶液:准确吸取环酰菌胺标准储备溶液1 mL 于50 mL 容量瓶中,用丙酮定容至刻度,配成10 μg/mL 环酰菌胺标准中间液。然后准确吸取1 mL、10 μg/mL 标准中间溶液于10 mL 容量瓶中,用丙酮定容,配成1.0 μg/mL 标准中间溶液。
标准工作溶液:根据需要使用前用空白样品基质溶液稀释标准中间溶液,配制成适当质量浓度的标准工作溶液。
1.3.2 测定条件
(1)色谱条件
色谱柱:HP-5MS(30 m×0.25 mm×0.25 μm);升温程序:100 ℃保持3 min,然后以30 ℃/min 程序升温至280 ℃保持2 min,再以20 ℃/min 升温至330 ℃保持4.5 min;载气:氦气,纯度≥99.999%,流速1.0 mL/min;碰撞气:氮气,纯度≥99.999%,流速1.5 mL/min;淬灭气:氦气,纯度≥99.999%,流速2.25 mL/min;进样口温度:330 ℃;进样量:1 μL;进样方式:不分流进样;电子轰击源:70 eV;离子源温度:280℃;MS传输线温度:330℃;溶剂延迟:4min。
(2)质谱条件
多反应监测(multi-reaction monitoring,MRM):环酰菌胺选择一对定量离子。两对定性离子。环酰菌胺的保留时间、定量离子对、定性离子对和碰撞电压等参数详见表1。

表1 环酰菌胺质谱采集参数Table 1 Instrumental parameter setting for MS-MS detection of fenhexamid
1.3.3 样品前处理
将所购样品用四分法取出500 g,用破壁机粉碎。称取10.00 g 粉碎后的均匀样品置于50 mL 离心管中,准确加入20 mL 乙腈溶液、5.0 g 氯化钠、4 g 无水硫酸镁,涡旋提取。以5 000 r/min 离心5 min。吸取2.0 mL 上层有机相,转移至装有100 mg Cleanert ODS C18-N、50 mg Cleanert PSA 粉末的离心管中,涡旋2 min,5 000 r/min 离心5 min。取上清液1.0 mL,水浴45 ℃氮吹至近干,用1.0 mL 丙酮复溶,过0.22 μm 滤膜后,供气相色谱-三重四级杆串联质谱仪测定使用。
1.4 数据处理
使用Agilent 8890-7010B 气相色谱-三重四级杆串联质谱仪自带的定量分析软件Agilent MassHunter Workstation 10.1 对实验数据进行分析,将数据文件导入数据处理软件,使用标液建立校正曲线,根据定量离子对、定性离子对以及标准物质出峰时间对样品数据进行定量、定性分析。
2 结果与分析
2.1 色谱条件选择
环酰菌胺沸点为320 ℃,进样口温度选择330 ℃,柱箱升温程序初始温度选择100 ℃保持3 min,使目标物在初始时在色谱柱前端凝结汇聚,目标物半峰宽更小,峰形更为对称。以30 ℃/min 程序升温至280 ℃保持2 min,以较高的升温速率使目标物快速气化。再以20 ℃/min 升温至330 ℃,保持4.5 min,除去高沸点杂质。
2.2 质谱条件优化
根据环酰菌胺质谱图(图1)及其断裂机理,选择丰度高、质荷比大的97、177 和179 作为特征离子,通过Q2进行诱导碰撞,通过Q3 扫描得到一系列碎片离子图,选择丰度高碎片离子用来定量,另一个用来辅助定性,从而建立经典的选择反应监测扫描。
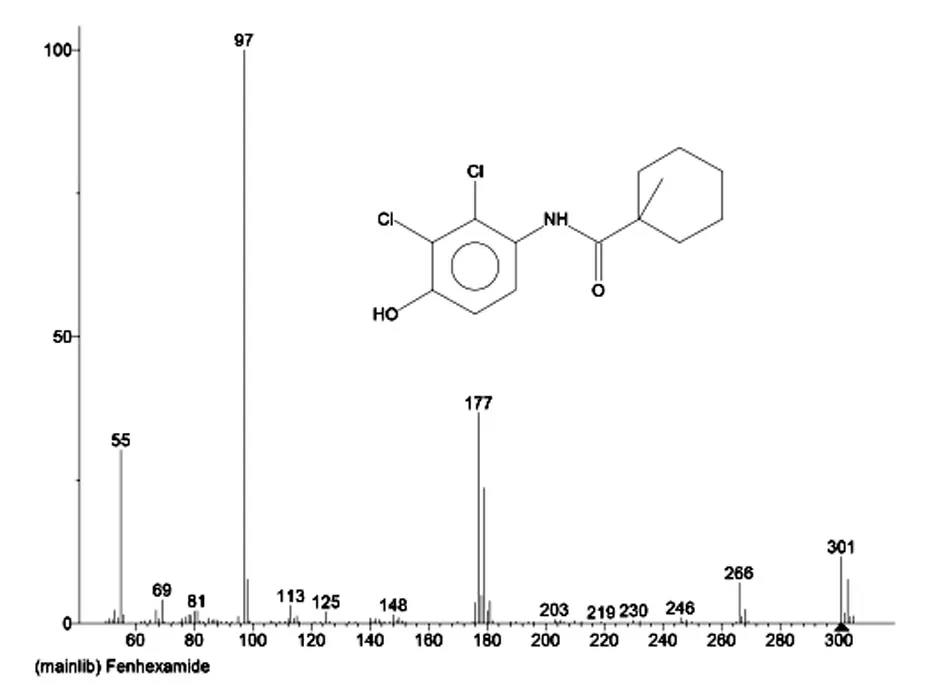
图1 环酰菌胺质谱图Fig.1 Mass spectrogram of fenhexamid
最 终 选 定5 对 离 子 对:97.1-55.1(10 eV)、177.1-113.0(15 eV)、177.1-78.0(25 eV)、179.0-115.0(15 eV)、179.0-78.0(25 eV)进行测试优化。
环酰菌胺总离子流图及5 对离子对谱MRM图分别见图2、3。其中97.1-55.1(10 eV)、179.0-115.0(15 eV)两对离子对干扰较大,97.1-55.1(10 eV)离子对的周围杂峰较多,179.0-115.0(15 eV)离子对响应值较低且基线漂移严重,对目标物的定性定量干扰严重。可使用另外三对离子对进行定量、定性,这三对离子对响应值高、干扰小,有利于对目标物的定量定性。选取响应值较大的177.1-78.0(25 eV)作为定量离子对。
图2 环酰菌胺的TIC 图Fig.2 TIC of fenhexamid

图3 环酰菌胺的MRM 色谱图Fig.3 MRM chromatogram of fenhexamid
图4 环酰菌胺的TIC 图Fig.4 TIC of fenhexamid

图5 环酰菌胺的MRM 色谱图Fig.5 MRM chromatogram of fenhexamid

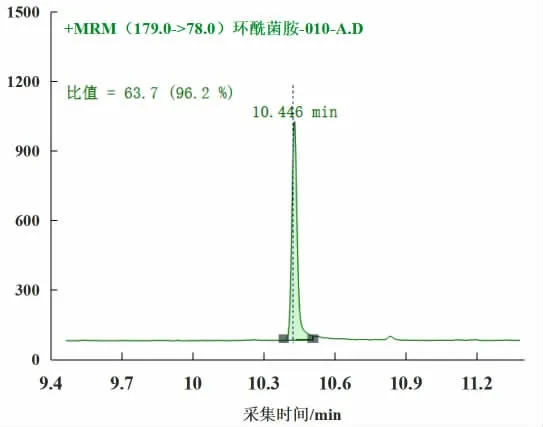
图6 离子对177.1-78.0、177.1-113.0、179.0-78.0 的MRMFig.6 MRM chromatogram of 177.1-78.0、177.1-113.0、179.0-78.0
由图4、5、6(见上页)可以看出,使用所选定的三对离子对后,TIC、MRM图在目标峰位置周围无杂峰干扰、响应值高。选取这三对离子对进行定量、定性分析较为可行。
2.3 方法学考察
2.3.1 定量限与线性关系
配制环酰菌胺农药混标溶液,稀释成一定梯度的系列标准溶液。在最佳的色谱条件和质谱条件下进行测定,以峰面积为纵坐标、浓度为横坐标进行线性回归分析。逐步稀释混合标准溶液,以10 倍信噪比所对应的质量浓度作为方法定量限,最终确定定量限为0.01 mg/kg。线性方程、相关系数见表2。

表2 环酰菌胺线性方程及相关系数Table 2 Linear equation and correlation coefficient of fenhexamid
2.3.2 回收率与精密度
在阴性桑葚、草莓、葡萄、菠菜和小白菜样品中各添加3 个浓度水平的混合标准液,按1.3.3 所述前处理方法进行处理,进行回收率实验,每个水平重复测6 次,测得精密度,结果见表3。由表3 可知,不同添加浓度的平均回收率为88.83%~98.50%,相对标准偏差为2.5%~5.5%,这表明该方法的准确度及精密度均可达到定量分析的要求。

表3 样品中环酰菌胺的回收率和精密度(n=6)Table 3 Mean recoveries and precisions of fenhexamid in sample (n=6)
2.4 实际样品分析
采用所建立的方法对市售的30 批(5 种基质各6 批次)样品进行检测,阳性检出2 批次(葡萄1 批次,小白菜1 批次),检出值分别为0.082 mg/kg 和0.051 mg/kg。证明该方法准确可靠,能够有效的为市场把关。
3 结论
本文使用QuEChERS 前处理技术的分散固相萃取技术,经离子对优化选择,建立易腐蔬菜和水果中环酰菌胺残留的气相色谱-三重四极杆串联质谱检测方法。该方法用乙腈提取样品中的环酰菌胺残留,同时采用乙二胺-N-丙基硅烷和十八烷基硅烷键合相混合吸附剂对样品提取液进行净化。将此前处理方法结合GC-MS/MS 应用于易腐果蔬中环酰菌胺的同时定性确证和定量检测,结果较好。该方法具有简单快速、灵敏、准确等特点,能完全满足国际残留限量的检测要求。
