2 600例乳腺导管内乳头状肿瘤术中冷冻诊断与常规病理诊断结果对比分析
2022-09-28杜红雁
杜红雁,雷 莹
乳腺导管内乳头状肿瘤以存在支持上皮增殖的纤维血管轴心为特征,构成一组临床表现和组织学特征均具有异质性的肿瘤,这组广谱的肿瘤具有不同的生物学行为[1-2]。良性、不典型和恶性导管内乳头状肿瘤中均存在不同程度的形态学交叉重叠,因此在术中冷冻诊断中仅凭形态学特点识别这组肿瘤具有挑战性[3]。此外,部分类型的导管内乳头状癌预后良好,只需行局部扩大切除术即可[4]。累及到导管多个分支的复杂乳头状瘤,由于病灶切除不完整,有复发并恶变为乳头状癌的可能。不同的病理专家和学者对于导管内乳头状癌的诊断标准也不完全一致[5-7]。这些复杂的临床病理特征有时会导致乳腺导管内乳头状肿瘤的诊断困难。本文现将作者的临床诊断经验介绍如下。
1 材料与方法
1.1 临床资料收集2010年1月~2020年12月西北妇女儿童医院就诊的2 600例患者,所有患者均为女性,年龄22~76岁,平均55岁。病程6天~10年,平均13个月。所有病例均有完整的临床病理资料,未合并其它肿瘤。本实验经西北妇女儿童医院医学伦理委员会批准,患者均知情同意。半硬性纤维光导乳腺导管内视镜观察至Ⅵ级导管(距乳头约5 cm),测量乳头距病变的距离和透光性定位病灶。根据情况选择钼靶、彩超、核磁共振检查,并根据乳腺影像报告和数据系统对所有病例进行BI-RADS分级诊断。手术方式采用乳腺区段切除。局部浸润麻醉或全麻下进行,术前乳腺导管镜下定位病变乳腺导管,切除病变乳腺导管及周围乳腺组织,所有病例均行术中冷冻诊断和术后常规病理诊断。根据患者临床情况、术中冷冻诊断结果与患者充分沟通并知情同意后,决定下一步手术方式。
1.2 方法术中冷冻诊断和术后常规病理诊断由两位高年资病理医师共同核实。冰余组织均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚连续切片,HE染色,镜下观察。免疫组化染色采用SP法,PBS作为阴性对照,操作步骤严格按试剂盒说明书进行。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析,分类变量用频数(%)表示,计数资料比较采用χ2检验及Fisher精确概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 术中冷冻诊断结果及其与乳腺导管内乳头状肿瘤临床病理特征的相关性2 600例乳腺导管内乳头状肿瘤中,1 964例术中冷冻诊断为良性肿瘤(75.6%,1 964/2 600),391例诊断为不典型增生、原位癌以及浸润癌(15%,391/2 600),245例难以在术中明确病变性质(9.4%,245/2 600)。统计分析发现BI-RADS高分级、导管内筛状结构和导管内灶状坏死的出现与术中冷冻诊断为非良性病变有关(P<0.001,表1,图1)。

表1 2 600例乳腺导管内乳头状肿瘤术中冷冻诊断结果与临床病理特征的相关性[n(%)]
2.2 常规病理诊断结果2 600例乳腺导管内乳头状肿瘤中,常规病理诊断与术中冷冻诊断完全符合者2 227例(85.6%,2 227/2 600),诊断不一致者373例(14.4%,373/2 600),其中诊断不足者316例(12.1%,316/2 600),诊断过度者57例(2.2%,57/2 600)。诊断不足包括:不典型增生、原位癌或浸润癌术中冷冻诊断为良性。诊断过度刚好相反。统计分析发现,与术后常规病理诊断相比,术中冷冻诊断的灵敏度为0.740,特异度为0.964。
2.3 316例术中冷冻诊断不足分析1 964例术中冷冻诊断为良性的肿瘤中,术后常规病理诊断仍然为良性者1 648例,另外316例诊断为不典型增生228例(72.2%,228/316),原位癌84例(26.6%,(84/316),浸润癌4例(1.2%,4/316)。统计分析发现术中冷冻诊断不足与患者年龄(<45岁)、多发性导管内肿物、导管上皮平坦型不典型增生和ER弥漫强阳性有关(P<0.001,表2,图1)。

表2 术中冷冻诊断不足与诊断过度的临床病理分析[n(%)]
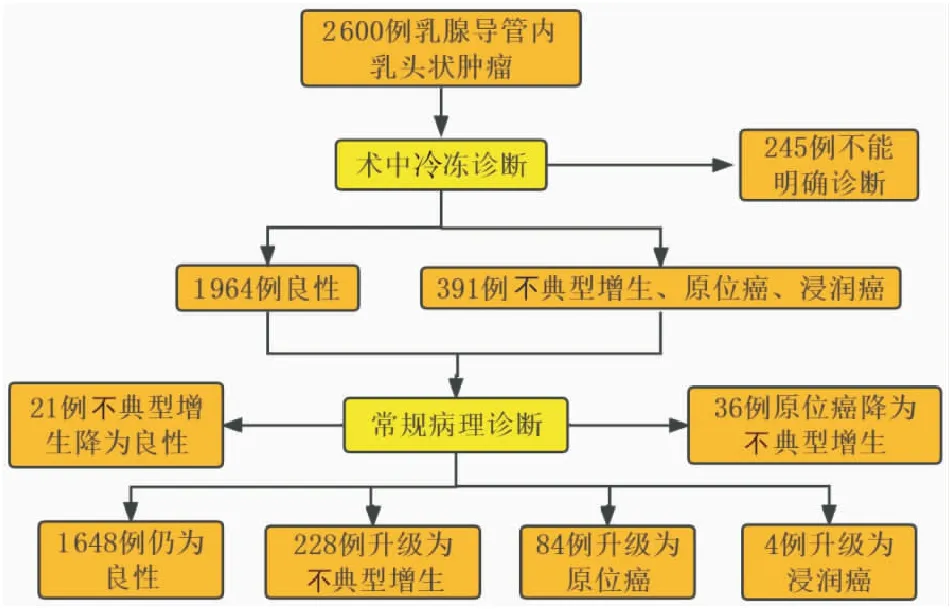
图1 2 600例乳腺导管内乳头状肿瘤诊断流程
2.4 57例术中冷冻诊断过度分析经常规病理多处取材和免疫组化染色的辅助,最终确定57例诊断过度,其中不典型增生降为良性21例(36.8%,21/57),原位癌降为不典型增生36例(63.2%,36/57)。统计分析发现与诊断过度相关的因素:术中冷冻切片细胞异型性、ER弥漫强阳性和p63肌上皮着色(P<0.001,表2,图1)。
2.5 随访2 600例患者中1 129例患者获得随访,随访时间3~120个月(中位数45个月,均数52.6个月)。死亡2例,158例乳腺导管内乳头状瘤患者出现了不同程度的复发,外周型导管内乳头状瘤比中央型导管内乳头状瘤的平均复发时间更短(P<0.05),其中外周型33个月,中央型57个月(图2)。
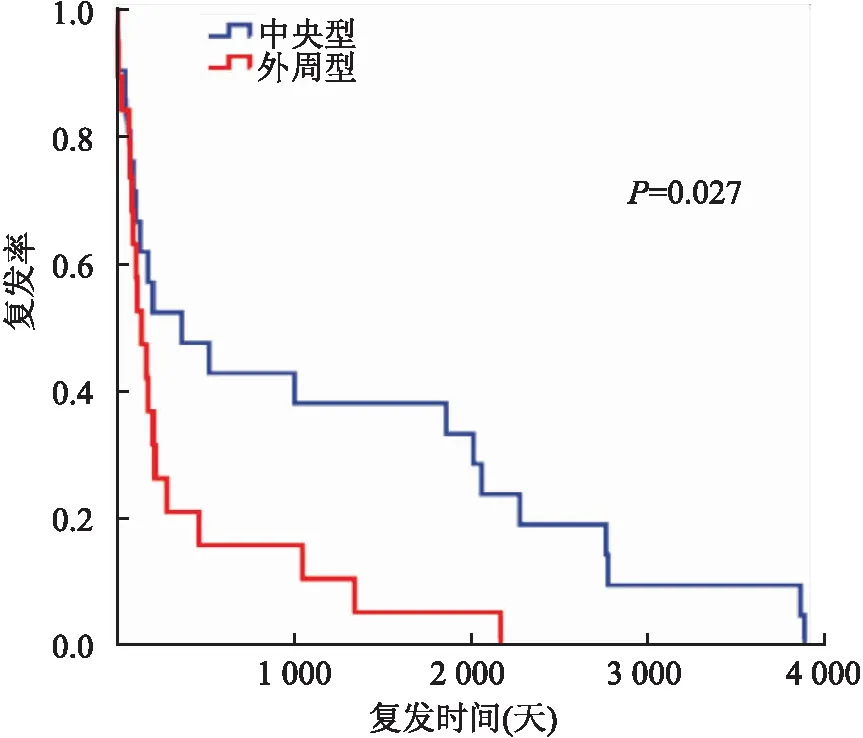
图2 中央型与外周型乳腺导管内乳头状瘤复发率
3 讨论
乳腺导管内乳头状肿瘤患者年龄分布广泛,大多数发生于30~60岁。本组患者年龄22~76岁,平均55岁,与文献报道基本一致[8]。乳腺导管内乳头状肿瘤按位置可分为中央型(大导管乳头状瘤)和外周型(小导管乳头状瘤),大多数乳腺导管内乳头状肿瘤为中央型,通常为孤立性肿瘤,经常表现为浆液性或血清性分泌物,较少触及肿块[9-10]。病理大体检查中,中央型导管内乳头状肿瘤通常肉眼可见,表现为囊性扩张的导管中局限性结节,一般为灰白色,质地较细腻,触之易碎[11-12]。外周型导管内乳头状肿瘤出现在末端导管小叶单位中,常为多发,临床表现往往比较隐匿,常常为体检时影像学检查偶然发现,外周型乳头状肿瘤的这些特点使得其比中央型乳头状肿瘤更易复发和恶变[13-14]。本组随访数据显示,外周型导管内乳头状瘤比中央型导管内乳头状瘤的平均复发时间更短。
本实验结果显示,316例诊断不足的病例多数为多发性病灶,且病变有异质性,大体取材和术中冷冻诊断易发生诊断不足的情况。导管内乳头状肿瘤具有不同的生物学行为。良性、不典型和恶性导管内乳头状肿瘤中均存在不同程度的形态学交叉重叠,因此在术中冷冻诊断中仅凭形态特点识别这组肿瘤具有挑战性[15]。肌上皮的准确识别是此类肿瘤非常重要的良、恶性鉴别点。然而,肌上皮形态多变,再加上冷冻切片时细胞肿胀的因素,会使得肌上皮的识别变得充满陷阱,有时还会因为组织的收缩裂隙出现人为的假象,种种原因使得肌上皮“真假难辨”,可能会导致诊断不足和诊断过度的问题[16]。本组过度诊断57例中均不同程度的存在肌上皮判读不足的情况。这时谨慎的等待常规石蜡切片和免疫组化的辅助诊断具有必要性[17]。
术中冷冻诊断时出现诊断过度的后果往往比较严重,应该尽量避免。本组总结以下四个常见原因:(1)术中冷冻诊断因为制片的原因细胞出现异型性并不可靠,有引起诊断过度的风险,石蜡切片的细胞异型性相对可靠。(2)ER呈弥漫强阳性着色可以辅助诊断导管上皮不典型增生,但当导管上皮细胞发生柱状细胞化生时也会出现ER弥漫强阳性,此时应避免诊断过度。(3)准确识别坏死的性质,鉴别肿瘤性坏死和梗死非常重要,后者在导管内乳头状肿瘤中并不罕见,特别是在中央型导管内乳头状肿瘤中,穿刺导致人工假象和纤维血管轴心扭转导致的缺血性改变均能引起梗死,梗死灶附近的上皮可发生鳞状上皮化生,这是一种对缺血缺氧的反应性改变,易误诊为肿瘤性坏死,而导致过度诊断。(4)间质纤维化是导管内乳头状肿瘤的另一个常见形态,特别是在较长期的病变中,纤维化的范围有时可以非常广泛,并挤压性的“破坏”周围正常的结构,压缩和扭曲的腺体陷入纤维化的间质中,形成“假浸润模式”[18-20]。术中冷冻诊断时,标本无论在大体还是镜下均类似于浸润癌,在这种情况下,判断肌上皮细胞的存在至关重要,免疫组化染色必不可少[21-23],本组数据显示p63染色有较高的特异性。
乳腺导管内乳头状肿瘤的生物学行为多样,治疗方案取决于术中冷冻诊断和常规病理诊断结果,尤其是术中冷冻诊断直接决定了患者手术方式的选择,诊断过度与诊断不足均会引起不良的临床后果。病理医师应注意避免因取材不充分而导致诊断不足的问题,而更多的情况下应着重避免可能导致诊断过度的因素,必要时应谨慎的等待常规病理诊断和免疫组化染色再做出最终诊断[24-25]。不同的病理专家和学者对于导管内乳头状癌的诊断标准也并不完全一致,这也是值得深入研究的问题,希望以后有更多的临床和病理数据对此做出更深入的探讨。
