淹水胁迫及恢复对樱桃番茄苗期根系和叶片细胞膜稳定性的影响
2022-09-28刘聪聪兰超杰李长江玉香伦
刘聪聪,兰超杰,李 欢,李长江*,邱 尧,玉香伦
淹水胁迫及恢复对樱桃番茄苗期根系和叶片细胞膜稳定性的影响
刘聪聪1,兰超杰2,李 欢3,李长江2*,邱 尧2,玉香伦2
(1.贵州省生物技术研究所,贵阳 550000;2.海南大学 热带作物学院,海口 570228;3.贵州省农作物品种资源研究所,贵阳 550000)
【目的】明确淹水天数和恢复天数对樱桃番茄苗期生长发育和生理生化指标的影响,为热带地区樱桃番茄优化栽培提供参考。【方法】以“红妃6号”(HF)和“千禧”(QX)为试验材料,设置6个不同淹水天数:淹水0 d(CK)、淹水2 d(W2)、4 d(W4)、6 d(W6)、10 d(W10)和14 d(W14);5个不同恢复天数:恢复2、4、6、10 d和14 d,探究淹水胁迫下不同樱桃番茄苗期恢复的响应规律。【结果】淹水天数和恢复天数均可显著影响樱桃番茄苗期根系生长、抗氧化酶活性及膜脂过氧化程度。在淹水2 d时解除胁迫并恢复14 d,千禧品种的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性均较CK高,丙二醛(MDA)量较CK降低;而红妃6号品种在淹水6 d时解除胁迫并恢复14 d,其过氧化氢酶(CAT)和POD活性、MDA量和超氧阴离子自由基(O2·-)产生速率较CK仍能恢复至正常水平,淹水时间相同时,红妃6号品种在恢复2~4 d时的根系活力、CAT和POD活性较CK升高,而千禧品种多在恢复6 d时CAT活性较CK提高,随着淹水天数的延长,千禧品种恢复能力逐渐减弱。【结论】不同品种对淹水胁迫及恢复的相应规律不同,淹水2~6 d时解除胁迫,红妃6号恢复效果较好,且在2~6 d后恢复能力逐渐趋于稳定。
淹水;恢复;樱桃番茄;生理生化特性
0 引言
【研究意义】樱桃番茄(Mill.)为茄科番茄属植物,已成为世界上最主要的经济蔬菜作物之一[1]。近年来,樱桃番茄在我国热带地区作为反季节果蔬被大面积推广种植,热带地区通常在每年8—10月进行育苗,育苗期正值雨季,降水集中且强度大[2-3],农田涝害时有发生,严重影响樱桃番茄苗期生长和产量的提升[4]。因此,研究淹水胁迫下不同樱桃番茄苗期恢复的响应规律十分必要。【研究进展】樱桃番茄是番茄最重要的品种之一[5],由于其口味和营养俱佳,且对于多种疾病、衰老有预防作用[6-7],现已成为广泛销售的鲜食或轻烹食物,经济价值日益增长[8-9],也是研究茄科作物遗传物质及逆境抗性的模式植物[10]。涝害是作物生长过程中遭受的主要非生物胁迫之一[11],会对作物的生长、产量以及品质等多方面造成不利影响[8-9]。涝害可抑制作物根系生长,降低根系活力[12];使细胞膜遭到破坏,胞体内丙二醛(Malondialdehyde, MDA)量增加;叶片抗氧化酶活性下降[13],活性氧代谢失衡,造成活性氧的大量积累[11]。植物体内渗透调节物质是重要的保护机制,其量会因淹水胁迫发生变化,调控体内代谢过程以适应淹水环境[14]。淹水环境导致土壤缺氧,作物根系有氧呼吸受阻,进而影响根系与地上部之间的物质运输以及叶片的光合作用[15]。不同作物、不同品种在淹水胁迫后的表现不同,恢复能力也存在较大差异。以往对多种作物在淹水条件下的生理变化及产量研究较多,试验表明,水稻在淹水胁迫下,随着淹水程度加深,地上部中的游离脯氨酸量先降低后升高,而可溶性蛋白量则表现为先升高后下降[16];在对玉米的研究中发现,淹水后叶片中脯氨酸量上升,可溶性蛋白量下降[17];甜瓜在淹水处理和恢复后,可溶性糖量下降,MDA量、超氧阴离子自由基(superoxide anion radical, O2·-)产生速率提高,淹水胁迫对植株生长的抑制作用在胁迫解除后具有不同程度的恢复[14]。【切入点】目前,对樱桃番茄的研究多集中于病害防控和优化施肥模式等方面,而对于淹水胁迫的研究较少,其中对淹水胁迫解除后的恢复效应更是鲜有报道。因此樱桃番茄在不同品种、不同淹水时间及淹水胁迫解除后恢复能力的研究十分必要。【拟解决的关键问题】鉴于此,本研究拟探究不同品种樱桃番茄苗期经过不同淹水时间处理并解除淹水胁迫后的恢复效应,为樱桃番茄的抗逆性研究及热带地区农业的发展提供理论依据。
1 材料与方法
1.1 试验概况
试验于2018年9—12月在海南省海口市海南大学热带农林学院农学基地温室(20°3'N,110°19'E)进行,根据前期研究结果[18],选取淹水不敏感型品种红妃6号(HF)和淹水敏感型品种千禧(QX),于2018年9月育苗,至三叶一心时选取长势一致的幼苗移栽入花盆中(直径×高度:15 cm×15 cm),每盆1株;采用盆栽试验,供试土壤为海南大学农学基地番茄农田0~20 cm土层的砖红壤,风干后过2 mm筛,每盆装土2.5 kg,待幼苗发育至四叶一心时开始试验。试验期间,温室昼/夜温度分别设定为当地9—10月多年平均值28/23 ℃,湿度为82%。盆栽土壤基础理化特性为pH值6.75、有机质量2.89%、碱解氮量122.90 mg/kg、速效磷量39.89 mg/kg、速效钾量0.19 g/kg。
1.2 试验设计
淹水处理设置为淹水0 d(CK)、2 d(W2)、4 d(W4)、6 d(W6)、10 d(W10)和14 d(W14),解除淹水胁迫分别恢复2、4、6、10 d和14 d。试验中,CK条件下的土壤含水率为田间最大持水率的70%~75%;淹水处理采用双套盘法,即将花盆放入上口径×底径×高为20cm×17cm×19cm的大盆中进行淹水,每天控制水面高于土面2 cm,且每天及时对蒸发失水进行补充。正常水分处理通过称盆法每2天补水1次,使得土壤含水率保持在最大持水率的75%左右。当淹水时间达到后,迅速将花盆从大盆中取出,放置3~5 h,待培养钵中无积水渗出并最终使得培养钵中土壤含水率逐渐达到并保持在土壤最大持水率的70%~75%。每个处理重复3次,每盆栽种6株。在恢复生长的第0、2、4、6、10天和第14天取样,每个重复取2株,取各植株功能叶(由下至上计数第4片完全展开叶)和根系,于-80 ℃冰箱中保存,分别用于各项生理生化指标的测定。
1.3 测定项目与方法
1.3.1 生理生化指标的测定
超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)光还原法;过氧化氢酶(CAT)活性的测定采用紫外吸收法;过氧化物酶(POD)活性的测定采用愈创木酚显色法。丙二醛的测定采用硫代巴比妥酸(TBA)比色法;超氧阴离子的测定参照Lin等[15]的方法进行;游离脯氨酸(Pro)量的测定采用酸性茚三酮显色法;可溶性糖量的测定采用硫酸-蒽酮比色法。
1.3.2 数据处理与分析
2 结果与分析
2.1 不同淹水时间对樱桃番茄根系形态恢复的影响
由表1可知,相同淹水恢复时间,红妃品种经淹水处理4、6 d和10 d的总平均直径均比CK高,淹水处理2 d和14 d的总平均直径则低于CK,各处理与CK之间均无显著差异。相同的淹水解除时间,千禧品种经淹水处理2 d和4 d的总平均直径均比CK高,经淹水处理6、10 d和14 d的总平均直径则比CK低。其中,淹水6 d处理的总平均直径仅为CK的43.1%,与CK差异显著。
相同淹水解除时间,红妃品种经淹水处理4 d和10 d的总体积均比CK高,淹水处理2、6 d和14 d的总体积则比CK低。其中,经淹水处理4 d和14 d的根系总体积与CK有显著差异,淹水处理4 d的总体积约为CK的5倍,淹水处理14 d的根系总体积比CK的低80.1%。相同淹水解除时间,千禧品种只有经淹水处理4 d的总体积比CK高,而经淹水处理2、6、10 d和14 d的总体积均比CK低。其中,淹水处理6、10 d和14 d的根系总体积与CK有显著差异,淹水处理6 d的根系总体积比CK低71.5%,淹水处理10 d的根系总体积比CK高27.9%,淹水处理14 d的根系总体积比CK的低79.9%。
相同淹水解除时间,红妃品种经淹水处理2 d和4 d的总表面积均比CK高,淹水处理6、10 d和14 d的总表面积则比CK低。其中,在经淹水处理14 d的根系表面积与CK有显著差异,比CK低79.6%。在相同的淹水解除时间下,千禧品种只有经淹水处理4 d的总表面积比CK高,而经淹水处理2、6、10 d和14 d的总表面积均比CK低。其中,在经淹水处理14 d的与CK有显著差异,比CK低71.7%。
相同淹水解除时间,红妃品种经淹水处理2、4 d和6 d的根系总长度均比CK高,淹水处理10 d和14 d的根系总长度则比CK低。其中,经淹水处理14 d的根系表面积与CK有显著差异,淹水处理比CK低64.5%。相同淹水解除时间,千禧品种经淹水处理4、6 d和10 d的根系总长度均比CK长,在经淹水处理2 d和14 d的根系总长度则比CK短。其中,经淹水处理4 d的根系表面积与CK有显著差异,为CK的3倍。

表1 樱桃番茄苗期不同淹水时间下恢复14 d根系形态的变化
注 不同小写字母表示在同一处理时间2个品种不同处理间差异显著(<0.05)。
2.2 不同淹水时间对樱桃番茄抗氧化酶系统恢复的影响
由图1可知,红妃6号在淹水解除后恢复14 d时,除W4处理与CK相近外,其他处理的CAT活性均高于CK。W2处理和W4处理在恢复期间的变化趋势与CK极为相近,但W2处理在恢复10~14 d时,其CAT活性较CK上升,其中在恢复4、10 d和14 d时差异显著;W6处理和W14处理的CAT活性整体呈升高-下降-升高趋势,W10处理的CAT活性整体呈先下降后升高趋势。

图1 樱桃番茄红妃6号苗期淹水后恢复期间过氧化氢酶活性的变化
由图2可知,千禧品种在淹水解除后恢复14 d时,除W6处理和W10处理的CAT活性与CK水平相近外,其他处理均低于CK。W2、W6处理和W14处理在恢复期间,CAT活性整体呈升高-下降-升高的趋势,在整个恢复期与CK无显著差异。W10处理在恢复第0天显著高于CK,其余时间与CK无显著差异。

图2 樱桃番茄千禧苗期淹水后恢复期间过氧化氢酶活性的变化
由图3可知,红妃6号品种W2处理和W6处理的SOD活性在恢复期间较CK先升高后下降。其中W2处理在恢复14 d高于CK,而W6处理在恢复14 d低于CK;W4处理在恢复4 d后均与CK变化趋势一致,且二者无显著差异;W10处理和W14处理则与CK的SOD活性差异较为明显,其中除W10处理在恢复4 d时略高于CK外,W10处理和W14处理在恢复2~14 d始终低于CK。

图3 樱桃番茄红妃6号苗期淹水后恢复期间超氧化物歧化酶活性的变化
由图4可知,千禧品种W2处理和W6处理的SOD活性在恢复期间较CK先升高后下降,并在恢复后期保持在较为平稳的水平,其中W6处理在恢复6~14 d显著低于CK;W4处理则整个恢复期间均与CK变化趋势一致,但自恢复2 d起低于CK;W10处理和W14处理则与CK的SOD活性变化趋势有所不同,均较CK呈下降-上升-下降的趋势,二者除在恢复6 d达到最高点并较CK上升外,在恢复2~14 d始终低于CK。
3)刚度和屈服极限随贮藏时间的延长呈逐渐下降趋势,变形能则随贮藏时间延长呈逐渐上升趋势。破裂极限和破坏能在贮藏最后3天达到最大值。

图4 樱桃番茄千禧苗期淹水后恢复期间超氧化物歧化酶活性的变化
由图5可知,红妃6号品种除W2处理外,其他处理的POD活性在恢复期间均较CK升高。W2处理在恢复前期也相比CK呈上升趋势,但在恢复6 d时开始下降,并在恢复10~14 d始终低于CK。W4处理和W6处理与CK变化趋势相近。其中,W6处理在恢复4 d时与CK差异最显著;W10处理和W14处理则与CK差异较大。

图5 樱桃番茄红妃6号苗期淹水后恢复期间过氧化物酶活性的变化
由图6可知,千禧品种W2、W4处理和W6处理的POD活性在恢复期间较CK呈下降-升高-下降的趋势,其中W2处理在恢复14 d时略高于CK,而W4处理和W6处理则均低于CK;W10处理和W14处理则较CK表现为降低-升高-降低-升高,并在恢复14 d高于CK。

图6 樱桃番茄千禧苗期淹水后恢复期间过氧化物酶活性的变化
2.3 不同淹水时间对樱桃番茄丙二醛恢复的影响
由图7可知,红妃6号品种W2处理的MDA量在恢复第0、2天和第10 天时低于CK,其中恢复2 d时具有显著差异,其余时间则高于CK;W4处理下MDA量在恢复第0天显著低于CK,在恢复第4、6、14天高于CK,但无显著差异。W6处理的MDA量在恢复2、4、6 d低于CK,在恢复10 d显著高于CK。W10处理MDA量在恢复第10天显著高于CK,在恢复第2天显著低于CK,W14处理MDA量在恢复2 d显著高于CK,其余时间与CK无显著差异。

图7 樱桃番茄红妃6号苗期淹水后恢复期间丙二醛量的变化
由图8可知,千禧品种W2处理下的MDA量在恢复第2、10天和第14天显著低于CK;W4处理在恢复第0天和第4天时,MDA量显著高于CK,其余时间与CK无显著差异。W6处理的恢复趋势与CK相似;W10处理在整个恢复期均高于CK,其中恢复2 d时差异显著;W14处理呈先降低后升高的趋势,在恢复中期(4~6 d)显著高于CK。
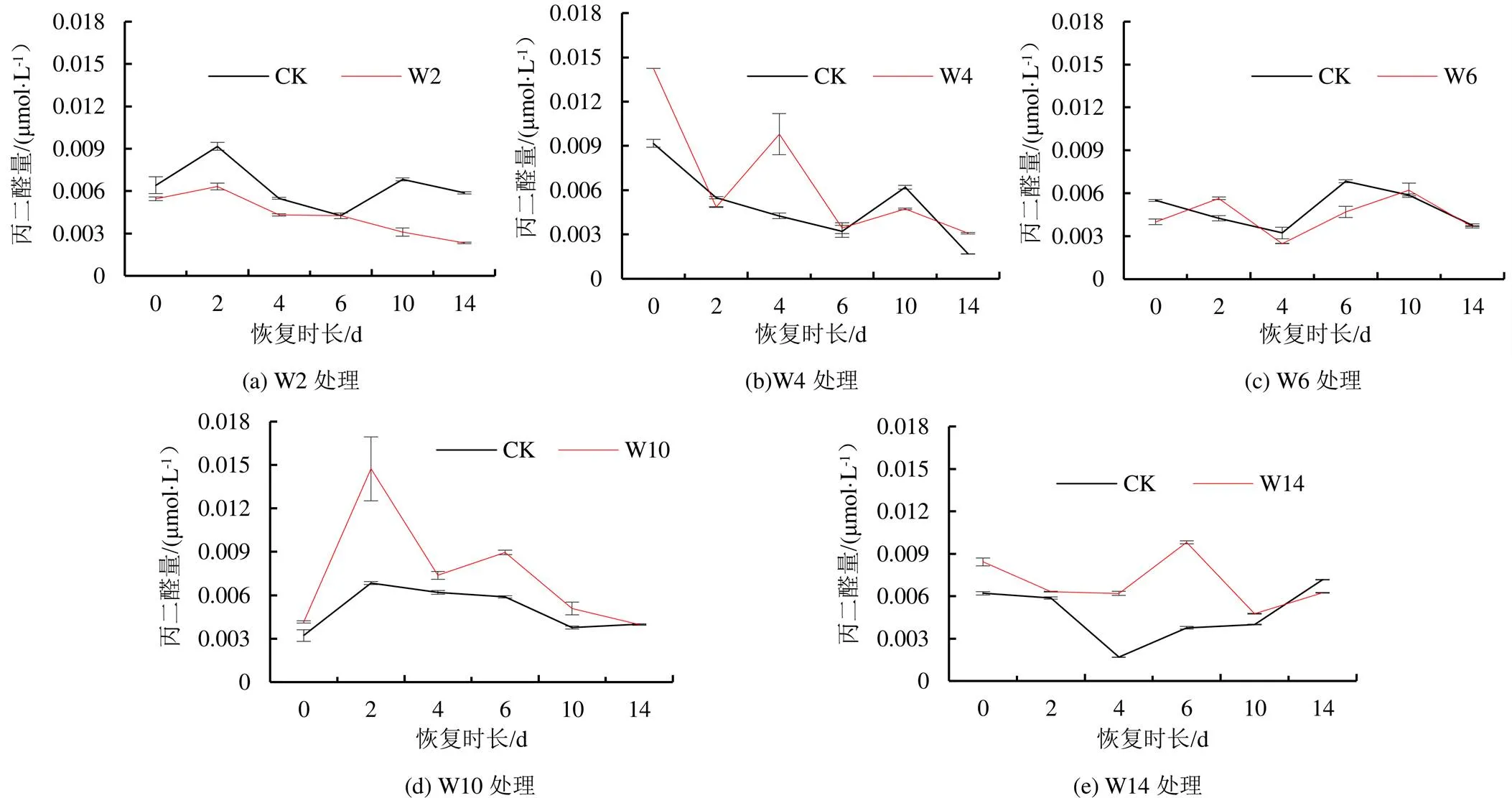
图8 樱桃番茄千禧苗期淹水后恢复期间丙二醛量的变化
2.4 不同淹水时间对樱桃番茄超氧阴离子自由基恢复的影响
由图9可知,红妃6号品种W2处理下O2·-产生速率在恢复第4天时显著高于CK,其余时间与CK无显著差异。W4、W6处理和W14处理的O2·-产生速率在恢复期间呈先升高后下降趋势,其中W4处理恢复期始终与CK无显著差异,而W6处理的O2·-产生速率在恢复第4天显著高于CK,W14处理的O2·-产生速率在恢复第4天和第6天显著高于CK,其余时间与CK无显著差异。W10处理的O2·-产生速率在恢复期变化趋势与CK相似,始终与CK无显著差异。
由图10可知,千禧品种W2处理和W4处理的O2·-产生速率在整个恢复期变化趋势与CK相似且与CK无显著差异。W6处理和W14处理的O2·-产生速率在恢复期的变化趋势呈升高-下降-升高-下降。其中,W6处理在恢复第4天时显著高于CK,W14处理的O2·-产生速率在恢复4天和14天显著高于CK,其余时间与CK无显著差异。W10处理的O2·-产生速率在恢复0天显著高于CK,随后逐渐与CK趋近。

图10 樱桃番茄千禧苗期淹水后恢复期间超氧阴离子产生速率的变化
3 讨论
根系形态可直观的体现植株根系的生长状态,根系活力也将影响植物代谢、吸收和物质转运的能力[19]。植物为了适应淹水环境及ROS的诱导作用,通过调节根系形态结构和大量生理生化过程从而增加存活率[20]。本研究发现,经过不同淹水时间的处理,红妃6号在淹水2 d时解除淹水胁迫并恢复14 d时,根系总平均直径和根系总体积较CK均有所下降,而根系总表面积和根系总长度较CK均升高,可能是由于在淹水初期,红妃6号的根系纵向生长得到促进,横向生长受到抑制。而千禧在同样条件下,根系总平均直径较CK增大。本研究结果与Omary等[21]对淹水胁迫下番茄根系的研究相似,原因可能是淹水胁迫下植物会生成直径较大的不定根,用于吸收水面上方的O2,便于植物根系有氧呼吸的正常进行,这也表明千禧品种对淹水十分敏感,在淹水初期便迅速通过不定根对胁迫做出反应。在淹水6 d时解除胁迫并恢复14 d时,千禧的根系形态除根系总长度外其他指标均低于CK;而红妃6号在淹水10 d后恢复14 d,根系形态较CK均提高。根据前人在白菜[22]和番茄[23]上的研究,可能是由于红妃6号在淹水胁迫解除后,可更快清除根系无氧呼吸产生的有害物质,促使根系更有效的恢复生长[24]。红妃6号对淹水胁迫适应性强,根系生长和功能保持较好。
抗氧化酶保护系统对植物十分重要,不仅可参与植物胞间多种生理变化,还可清除植物在逆境胁迫下产生的有毒物质[25]。红妃6号品种在淹水4 d时解除胁迫并恢复2 d时,其CAT活性就表现为升高,随后下降,但在恢复14 d时与CK接近;在淹水6、10 d和14 d时解除胁迫后恢复的期间,CAT活性几乎均高于CK。红妃6号品种在中长期(4~14 d)淹水胁迫并解除后,其POD活性较CK均呈升高趋势。赵旭等[26]的研究表明,随着根际O2量的下降,植株叶片中CAT活性和SOD量均有所升高。此现象表明抗氧化酶活性的升高,可清除植物细胞中积累的活性氧物质,降低细胞膜脂过氧化程度[27],从而使MDA量和O2·-产生速率下降。
淹水会影响植物的代谢系统,导致植株体内活性氧物质如O2·-的积累,进而引起细胞膜脂过氧化,其中MDA可作为判断细胞膜受损程度的依据[28-29]。本试验结果显示,红妃6号品种在淹水胁迫解除后,MDA量总体呈下降趋势,且在中长期淹水(6~14 d)条件下,经过恢复后MDA的量较CK降低或呈接近水平。淹水14 d时解除胁迫,MDA量先较CK大幅度升高,随后又下降并逐渐趋于CK水平,可能是由于长期淹水胁迫下,红妃6号叶片细胞膜严重受损,体内积累了较多的MDA,在胁迫解除初期(2 d)MDA仍在生成,随着淹水胁迫解除时间的延长,植株代谢能力提升进而清除大部分的MDA;而千禧品种在淹水2~6 d时胁迫解除,MDA量呈先升高后下降趋势,长期淹水(10~14 d)时则在恢复期间几乎均较CK表现为升高。这可能是由于千禧品种在长期淹水胁迫下膜脂过氧化程度过高,使细胞中的蛋白质分子失活,所以在胁迫解除后MDA量仍无法下降。这与前人在关于滴水观音[30]的研究结果相似,另外黄花忍冬在盐胁迫下MDA量也表现为上升[31],可见红妃6号品种具备更强的抗逆能力,在长期淹水后仍能使MDA量恢复至CK水平,维持体内代谢的相对平衡。红妃6号品种在淹水4、6 d及14 d时解除胁迫,恢复4 d或6 d后O2·-产生速率呈下降趋势,可能是通过调节抗氧化酶系统来清除活性氧物质,减轻O2·-对植物造成的氧化损伤[32]。而千禧品种在淹水4、6 d及14 d时解除胁迫,恢复期间的O2·-产生速率基本均较CK有所提高,可能是由于千禧品种清除活性氧物质的能力不足,在淹水胁迫解除后仍无法减缓O2·-产生速率。2个品种MDA量和O2·-产生速率变化趋势不同,说明淹水胁迫解除并恢复期间各指标变化在品种和时间上均具有特异性[33]。
4 结论
1)分别在淹水2 d和淹水6 d时解除胁迫并恢复,千禧品种和红妃6号品种的抗氧化酶活力水平、丙二醛量和O2·-产生速率各指标较CK表现更好或持平。
2)淹水胁迫解除后的恢复时间对植株各指标也有影响,红妃6号品种在恢复2~4 d时多数指标较CK表现出显著改善,而千禧品种在恢复6 d时多个指标才得到改善。
3)随着淹水天数的延长,红妃6号品种的根系活力、抗氧化酶活性等指标仍然能在胁迫解除后2~6 d期间得到恢复,而千禧品种在长期淹水胁迫下各指标恢复能力减弱,且恢复时间也逐渐延长,因此淹水后应尽快排水从而减轻对樱桃番茄幼苗的损伤。
[1] ZHAN B H, CAO N, WANG K N, et al. Detection and characterization of an isolate of Tomato mottle mosaic virus infecting tomato in China[J]. Journal of Integrative Agriculture, 2018, 17(5): 1 207-1 212.
[2] 何绍浪, 郭小君, 李凤英, 等. 中国南方地区近60 a来降雨量与降雨侵蚀力时空变化研究[J]. 长江流域资源与环境, 2017, 26(9): 1 406-1 416. HE Shaolang, GUO Xiaojun, LI Fengying, et al. Spatiotemporal variation of rainfall and rainfall erosivity in Southern China in recent 60 years[J]. Resources and Environment in the Yangtze Basin, 2017, 26(9): 1 406-1 416.
[3] 李建平, 任荣彩, 齐义泉, 等. 亚洲区域海-陆-气相互作用对全球和亚洲气候变化的作用研究进展[J]. 大气科学, 2013, 37(2): 518-538. LI Jianping, REN Rongcai, QI Yiquan, et al. Progress in air-land-sea interactions in Asia and their role in global and Asian climate change[J]. Chinese Journal of Atmospheric Sciences, 2013, 37(2): 518-538.
[4] LI C Y, JIANG D, WOLLENWEBER B, et al. Waterlogging pretreatment during vegetative growth improves tolerance to waterlogging after anthesis in wheat[J]. Plant Science, 2011, 180(5): 672-678.
[5] RAFFO A, LEONARDI C, FOGLIANO V, et al. Nutritional value of cherry tomatoes (Lycopersicon esculentum Cv. Naomi F1) harvested at different ripening stages[J]. Journal of Agricultural and Food Chemistry, 2002, 50(22): 6 550-6 556.
[6] BEECHER G R. Nutrient content of tomatoes and tomato products[J]. Proceedings of the Society for Experimental Biology and Medicine Society for Experimental Biology and Medicine (New York, N Y), 1998, 218(2): 98-100.
[7] VECCHIA C L. Mediterranean epidemiological evidence on tomatoes and the prevention of digestive-tract cancers[J]. Experimental Biology and Medicine, 1998, 218(2): 125-128.
[8] BUGIANESI R, SALUCCI M, LEONARDI C, et al. Effect of domestic cooking on human bioavailability of naringenin, chlorogenic acid, lycopene and beta-carotene in cherry tomatoes[J]. European Journal of Nutrition, 2004, 43(6): 360-366.
[9] FERRO-LUZZI A, CIALFA E, LECLERCQ C, et al. The Mediterranean diet revisited. Focus on fruit and vegetables[J]. International Journal of Food Sciences and Nutrition, 1994, 45(4): 291-300.
[10] ZHANG Y, SHI Y, GONG H J, et al. Beneficial effects of silicon on photosynthesis of tomato seedlings under water stress[J]. Journal of Integrative Agriculture, 2018, 17(10): 2 151-2 159.
[11] IPCC Climate Change 2007: Contribution of working group Ι to the fourth assessment report of the intergovernmental panel on climate change[R]. Cambridge University Press Cambridge, 2007.
[12] SETTER T L, WATERS I. Review of prospects for germplasm improvement for waterlogging tolerance in wheat, barley and oats[J]. Plant and Soil, 2003, 253(1): 1-34.
[13] RASHEED R, IQBAL M, ASHRAF M A, et al. Glycine betaine counteracts the inhibitory effects of waterlogging on growth, photosynthetic pigments, oxidative defence system, nutrient composition, and fruit quality in tomato[J]. The Journal of Horticultural Science and Biotechnology, 2018, 93(4): 385-391.
[14] 刁倩楠, 蒋雪君, 顾海峰, 等. 淹水胁迫及恢复对不同品种甜瓜幼苗生长及其生理生化指标的影响[J]. 上海农业学报, 2020, 36(1): 44-52. DIAO Qian’nan, JIANG Xuejun, GU Haifeng, et al. Effects of waterlogging stress and recovery on growth, physiological and biochemical indexes on different varieties of melon seedlings[J]. Acta Agriculturae Shanghai, 2020, 36(1): 44-52.
[15] LIN H H, LIN K H, SYU J Y, et al. Physiological and proteomic analysis in two wild tomato lines under waterlogging and high temperature stress[J]. Journal of Plant Biochemistry and Biotechnology, 2016, 25(1): 87-96.
[16] 罗昊文, 孔雷蕾, 钟卓君, 等. 淹水胁迫对水稻玉香油占秧苗生长和生理特性的影响[J]. 作物杂志, 2017(1): 135-139. LUO Haowen, KONG Leilei, ZHONG Zhuojun, et al. Effects of waterlogging stress on the rice Yuxiang youzhan growth and physiological characteristics of seedlings[J]. Crops, 2017(1): 135-139.
[17] YORDANOVA R Y, POPOVA L P. Flooding-induced changes in photosynthesis and oxidative status in maize plants[J]. Acta Physiologiae Plantarum, 2007, 29(6): 535-541.
[18] 刘聪聪, 兰超杰, 李欢, 等. 樱桃番茄苗期对淹水胁迫的响应及其耐涝性评价[J]. 核农学报, 2020, 34(3): 650-660. LIU Congcong, LAN Chaojie, LI Huan, et al. Responses of waterlogging stress and evaluation of waterlogging tolerance in cherry tomato at seedling stage[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(3): 650-660.
[19] 葛建坤, 平盈璐, 龚雪文, 等. 水分亏缺对温室覆膜滴灌番茄根系生长及吸水量的影响[J]. 灌溉排水学报, 2022, 41(3): 1-9.GE Jiankun, PING Yinglu, GONG Xuewen, et al. The effects of water deficit on root growth and water uptake of mulched greenhouse tomato under drip irrigation[J]. Journal of Irrigation and Drainage, 2022, 41(3): 1-9.
[20] QI X H, LI Q Q, MA X T, et al. Waterlogging-induced adventitious root formation in cucumber is regulated by ethylene and auxin through reactive oxygen species signalling[J]. Plant, Cell & Environment, 2019, 42(5): 1 458-1 470.
[21] OMARY M, GIL-YAROM N, YAHAV C, et al. A conserved superlocus regulates above- and belowground root initiation[J]. Science, 2022, 375(6 584): 4 368.
[22] 郭欣欣. 淹水胁迫对不结球白菜光合特性及根系生长的影响[D]. 南京: 南京农业大学, 2015. GUO Xinxin. Effects of waterlogging stress on photosynthetic characteristics and roots growth of non-heading Chinese cabbage[D]. Nanjing: Nanjing Agricultural University, 2015.
[23] COLMER T D, VOESENEK L A C J. Flooding tolerance: Suites of plant traits in variable environments[J]. Functional Plant Biology: FPB, 2009, 36(8): 665-681.
[24] WU Q S, ZOU Y N, HUANG Y M. The arbuscular mycorrhizal fungus Diversispora spurca ameliorates effects of waterlogging on growth, root system architecture and antioxidant enzyme activities of citrus seedlings[J]. Fungal Ecology, 2013, 6(1): 37-43.
[25] 靖建国, 李有芳, 贾姝萍, 等. 花后高温胁迫下外施多胺对小麦干物质转运及籽粒生理特性影响[J]. 灌溉排水学报, 2019, 38(9): 8-14. JING Jianguo, LI Youfang, JIA Shuping, et al. Effects of applied polyamines on wheat assimilates transport and grain physiological characteristics under high temperature stress after anthesis[J]. Journal of Irrigation and Drainage, 2019, 38(9): 8-14.
[26] 赵旭, 姚慧敏, 杨洁. 长期不同根际O2浓度处理对雾培番茄植株抗氧化酶系统的影响[J]. 北方园艺, 2020(17): 1-7. ZHAO Xu, YAO Huimin, YANG Jie. Effects of long-term different rhizosphere O2concentrations on antioxidant system of tomato plants in aeroponic culture[J]. Northern Horticulture, 2020(17): 1-7.
[27] TIAN L X, BI W S, LIU X, et al. Effects of waterlogging stress on the physiological response and grain-filling characteristics of spring maize (Zea mays L.) under field conditions[J]. Acta Physiologiae Plantarum, 2019, 41(5): 1-14.
[28] YIU J C, LIU C W, YI-TAN FANG D, et al. Waterlogging tolerance of Welsh onion (Allium fistulosum L.) enhanced by exogenous spermidine and spermine[J]. Plant Physiology and Biochemistry, 2009, 47(8): 710-716.
[29] WEI W L, LI D H, WANG L H, et al. Morpho-anatomical and physiological responses to waterlogging of sesame (Sesamum indicum L.)[J]. Plant Science, 2013, 208: 102-111.
[30] 夏红霞, 朱启红. 淹水对滴水观音抗氧化系统和丙二醛的影响[J]. 三峡生态环境监测, 2016, 1(3): 40-44.XIA Hongxia, ZHU Qihong. Flooding stress on antioxidant system and malondialdehyde of alocasia macrorrhiza[J]. Ecology and Environmental Monitoring of Three Gorges, 2016, 1(3): 40-44.
[31] 程淑娟. 盐胁迫下三种藤本忍冬的生理特性研究[D]. 南京: 南京林业大学, 2012. CHENG Shujuan. Research of physiological characteristics to salt stress on three climbing honeysuckle (lonicera)[D]. Nanjing: Nanjing Forestry University, 2012.
[32] 梁哲军, 陶洪斌, 王璞. 淹水解除后玉米幼苗形态及光合生理特征恢复[J]. 生态学报, 2009, 29(7): 3 977-3 986.LIANG Zhejun, TAO Hongbin, WANG Pu. Recovery effects of morphology and photosynthetic characteristics of maize (L.) seedlings after water-logging[J]. Acta Ecologica Sinica, 2009, 29(7): 3 977-3 986.
[33] JIA L T, QIN X, LYU D G, et al. ROS production and scavenging in three cherry rootsto CKs under short-term waterlogging conditions[J]. Scientia Horticulturae, 2019, 257(4): 108 647.
Effects of Flooding Stress and Recovery on Root and Leaf Cell Membrane Stability at Cherry Tomato Seedlings
LIU Congcong1, LAN Chaojie2, LI Huan3, LI Changjiang2*, QIU Yao2, YU Xianglun2
(1. Guizhou Institute of Biotechnology, Guiyang 550006, China; 2. College of Tropical Crops, Hainan University, Haikou 570228, China; 3. Guizhou Institute of Crop Varieties Resources, Guiyang 550006, China)
【Objective】To clarify the effects of flooding days and recovery days on the growth, physiological and biochemical indices of cherry tomato, and to provide a reference for the optimal cultivation of cherry tomato in tropical areas. 【Method】Five flooding days were set up: 2 days (W2), 4 days (W4), 6 days (W6), 10 days (W10) and 14 days (W14), and five recovery days: 2, 4, 10 and 14 days, and the response law of different cherry tomato seedling stage recovery under flooding stress was explored. 【Result】Flooding days and recovery days significantly affected the root growth, antioxidant enzyme activity and membrane lipid peroxidation of cherry tomato at seedling stage. The superoxide dismutase (SOD) and peroxidase (POD) activities of QX were higher than those of CK, and the content of malondialdehyde (MDA) was lower than that of CK; The catalase (CAT) and POD activity, MDA content and superoxide anion free radical (O2·-) production rate of HF varieties can still return to the normal level compared with CK after 6 days of flooding. When the flooding time is the same, the CAT and POD activity of HF varieties are higher than CK after 2 to 4 days of recovery, while the CAT activity of QX varieties are higher than CK after 6 days of recovery, With the extension of flooding days, the recovery ability of QX varieties decreased gradually.【Conclusion】The corresponding laws of flooding stress and recovery of different varieties are different, and the recovery effect of cherry tomato is better when the flooding is relieved for 2 to 6 days, and the recovery ability gradually stabilizes after 2 to 6 days of recovery.
flooding; restoration; cherry tomatoes; physiological and biochemical characteristics
1672 - 3317(2022)09 - 0061 - 10
S431.191
A
10.13522/j.cnki.ggps.2022219
刘聪聪, 兰超杰, 李欢, 等. 淹水胁迫及恢复对樱桃番茄苗期根系和叶片细胞膜稳定性的影响[J]. 灌溉排水学报, 2022, 41(9): 61-70.
LIU Congcong, LAN Chaojie, LI Huan, et al.Effects of Flooding Stress and Recovery on Root and Leaf Cell Membrane Stability at Cherry Tomato Seedlings[J]. Journal of Irrigation and Drainage, 2022, 41(9): 61-70.
2022-04-20
海南省自然科学基金项目(318QN201);国家自然科学基金项目(31860130)
刘聪聪(1993-),女,河南焦作人。研究实习员,硕士研究生,主要从事作物抗逆生理研究。E-mail: 1205879453@qq.com
李长江(1989-),男,河南安阳人。教授,博士研究生,主要从事作物高产高效研究。E-mail: lichangjiang99@163.com
责任编辑:韩 洋
