哮喘和ABPA血清蛋白质生物标志物的筛选
2022-09-27杨雷王筠金美玲帅迪全蔡慧叶伶李水明沈波
杨雷,王筠,2,金美玲,帅迪全,蔡慧,叶伶,李水明,沈波
1)深圳大学生命与海洋科学学院,广东深圳 518071;2)汕头大学医学院广东省感染病与分子免疫病理重点实验室,广东汕头 515041;3)复旦大学附属中山医院呼吸内科,上海200032
哮喘作为全球常见的慢性呼吸系统疾病,其病因复杂,病理生理特征是慢性炎症急性发作和气道过度反应,导致咳嗽、喘息、呼吸困难和胸闷.引起哮喘的内外因素很多,包括致敏原暴露、呼吸道感染、遗传因素、吸烟和肥胖等[1-2].目前全世界超过3亿人患有哮喘,已对患者、家庭和卫生保健系统造成沉重的负担[3].针对哮喘的治疗,近几十年来仍主要沿用支气管扩张和抗炎药物的传统方法[4].随着更多哮喘亚类的确认,许多个性化诊疗方案随之产生.例如,对过敏性哮喘常采用抗血清免疫球蛋白IgE 治疗和抗细胞因子治疗[5];对嗜酸性哮喘,则采用抗白细胞介素治疗[6].当前越来越多的研究关注于挖掘哮喘的新型生物标记物及其潜能,以区分不同哮喘的亚型,从而对患者进行早期精准干预.
肺部烟曲霉菌(Aspergillus fumigatus)的定植可导致肺局部组织的超敏反应,即变应性支气管肺曲霉菌病(allergic bronchopulmonary aspergillosis,ABPA).这一疾病是HINSON于1952年在英国首次发现,当时共报告了8例病例.直至1968年才在美国被确诊,并在全球范围内得以公认.患者年龄通常介于30~50 岁,儿童发病也较常见,尤其更多见于哮喘和囊性纤维化的患者.流调数据显示,在哮喘患者人群中ABPA 的患病率为2.5%[7].2013年,国际人类和动物真菌学学会(International Society for Human and Animal Mycology,ISHAM)的ABPA并发哮喘工作组,依据患者临床体征(如支气管痉挛、炎症细胞肺部浸润、嗜酸性粒细胞明显增多和血清总IgE 水平升高,特别是烟曲霉菌特异性IgE 和IgG 升高[8-9]),提出了对ABPA 的诊断、鉴别诊断、分期标准和治疗方案[10].然而,ABPA 患者的临床表现与肺部其他感染性疾病的临床特征相似,极易误诊或漏诊.由于缺乏早期有效治疗,常导致该病快速进展,形成肺部不可逆的损害(如肺纤维化、慢性支气管扩张或伴有肺功能严重下降的持续性哮喘)[11].
人外周循环血中富含多种游离蛋白质,是全身分泌型蛋白质的储存库,并富含许多与疾病发生、发展相关的特异性蛋白质生物标记物,可动态反映及调控机体的生理和病理状况,具有重要的临床应用价值[12-13].例如:许多细胞因子是调节机体免疫的关键功能分子,当患者发生感染、炎症或其他免疫响应时,体内细胞因子的浓度会发生明显异化[14].因此,细胞因子被视为是影响多种疾病发生发展的重要分子标志物.
与其他组学检测方法相比,高通量蛋白质芯片是较早广泛应用于医学领域的基础与临床研究的技术(包括癌症、自身免疫性疾病、心力衰竭和真菌感染),该技术可以定性与定量分析成千上万的蛋白质[15].
本研究拟利用已知蛋白质的高通量蛋白质芯片检测技术,通过对不同亚型类受试者血清蛋白质的比对分析,挖掘出与哮喘和ABPA疾病发生发展相关的新蛋白质生物标志物,以期开发灵敏、简便、快速地诊断与鉴别诊断检测工具,并为针对性的靶向治疗和早期预警提供新途径.
1 研究对象与材料方法
1.1 研究对象及分组
选取在上海复旦大学附属中山医院呼吸科就诊患者,依据纳入标准分组为哮喘组(61 例)、ABPA组(48例)和正常对照组(48例).
哮喘组纳入标准:①反复发作喘息、咳嗽,伴胸闷;②肺功能检查提示具有可变气流受限的客观依据.
ABPA组纳入标准:①有哮喘病史;②烟曲霉菌特异性血清/血浆IgE 水平升高(变应原水平>0.35 IU/mL),或皮肤对烟曲霉菌的直接反应过度;③总IgE 水平升高(>1 000 IU/mL);④嗜酸性粒细胞总数增加(>500 μL-1);⑤胸部电子计算机断层扫描(computed tomography,CT)见支气管扩张;⑥血清中存在抗烟曲霉菌的沉淀抗体.
正常对照组:类似年龄段和性别比,无呼吸道疾病和其他重大慢性疾病的健康志愿者.
该研究获得上海复旦大学附属中山医院医学伦理审查委员会的批准,所有参与受试者已签署了知情同意书.
1.2 血清样本的收集
抽取受试者循环外周血5 mL,常规凝血,收集血清,并以500 μL/管分装,置于-80 ℃低温冰箱保存.
1.3 蛋白质芯片的检测
血清标本按前述标准分为哮喘、ABPA 和正常对照3 组,每组提取等体积的8 例样本混成1 个待检样品,每组共混成3个待检样品.剩余标本用作候选蛋白质生物标志物的单例验证标本.采用人440 种细胞因子的抗体芯片(QAH-CAA-440,美国RayBiotech),按照产品说明书进行蛋白质检测.然后由Axon GenePix激光扫描仪采集信号强度,再将采集数据导入Raybiotech 软件,去除蛋白质芯片的非特异背景,归一化后进行分析处理.
1.4 差异表达细胞因子的筛选
将哮喘和ABPA 患者的检测数据分别与正常对照受试者的进行比较,以两组表达差异倍数(fold change,FC)大于1.5或小于0.67的细胞因子和P<0.05 的统计学显著性差异为阈值,筛选哮喘和ABPA 患者之间特异性表达差异的蛋白质,作为与疾病病变相关的候选蛋白质生物标志物.
1.5 生物信息学分析
首先,根据细胞因子的差异表达量,制作可视化基因表达热图和火山图.然后,使用David 6.8数据库(https://david.ncifcrf.gov/)进行基因本体(gene ontology,GO)功能富集和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集的分析.最后,使用STRING数据库在线平台(https://string-db.org/)进行蛋白质-蛋白质相互作用(protein-protein interactiion,PPI)网络分析.
1.6 多反应监测质谱
检测 标本为15 例哮喘、15 例ABPA 和14 例健康对照血清样本.多反应监测质谱(multiple reaction monitoring,MRM)实验过程如下:①建库:将各组血清分别混合成3组蛋白质样品,用Tripsin酶进行水解,再各取10 μg 酶解后的肽段混成1 个样品,使用Triple TOF®6600 质谱仪进行检测.使用ProteinPilot™Software 5.0.1 软件对下机数据进行蛋白质搜库,获得必要的建库信息;②获得待验证的蛋白质序列;③利用Skyline 软件选取合适质谱检测的蛋白质肽段母离子对;④将单例血清样本分别加入β-半乳糖苷酶和iRT作为内参,酶切,对肽段进行6500-QTRAP MRM 扫描;⑤将质谱检测数据导入Skyline 软件,提取目标蛋白质在质谱上的扫描信息,利用Msstats 3.18.5 软件计算蛋白质的相对丰度.通过Benjamini-Hochberg 方法对P值进行多重假设检验校正,P<0.05的差异表达蛋白质被认为是具有统计学意义的.
1.7 酶联免疫吸附实验
通过商品化酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA,武汉博士德生物),对已收集的15 例哮喘患者和15 例ABPA 患者,以及8 例正常受试者血清标本进行了8 个候选蛋白质标志物(CD14、CSF1、TNFRSF10CCSF1、CXCL9、CXCL9、CD6、TNFRSF1A 和CXCL13)的验证.
1.8 统计学处理
使用SPSS 22.0 软件分析患者的临床特征与检测数据的关联统计.计量资料以±s表示,两组之间用学生t-检验(student'st-test),多组之间用方差分析(analysis of variance,ANOVA);计数资料采用卡方检验.P<0.05 为具有统计学意义.利用MRM 或ELISA 实验数据,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC)A,并检验A是否具有统计学意义,以及计算尤登指数最大值作为最佳诊断临界值,获得对应的灵敏度、特异度和置信区间(confidence interval,CI),评估候选蛋白质生物标志物对哮喘和ABPA的诊断与鉴别诊断的价值.
2 结果与分析
2.1 研究对象临床特征
本研究共收集了61例哮喘患者、48例ABPA患者和48 例正常受试者的血清标本.所有标本的临床特征小结于表1.其中,n为样本数.由表1 可见,各组受试者的年龄和性别无统计学差异;ABPA 组、哮喘组与正常对照组的嗜酸性粒细胞计数呈现显著性差异,而且ABPA组的嗜酸性粒细胞个数明显高于哮喘组和正常对照组,ABPA 组的血清总IgE 水平明显高于哮喘组.ABPA 组和哮喘组的所有受试者都进行了血清过敏试验.所有ABPA患者均对烟曲霉特异性过敏,其中有11 例患者对屋尘螨过敏,10 例患者对粉尘螨过敏,26 例患者还对青霉菌过敏,以及16例患者对链格孢霉过敏.另外,哮喘患者有37 例对屋尘螨过敏和35 例患者对粉尘螨过敏.此外,ABPA患者的胸片多显示中央型支气管扩张伴感染.对照组没有检测血清总IgE和烟曲霉特异性IgE.
表1 不同组别受试者的临床资料1)(± s)Table 1 General characteristics of subjects in different subtypes(± s)

表1 不同组别受试者的临床资料1)(± s)Table 1 General characteristics of subjects in different subtypes(± s)
1)酸性粒细胞各组之间的P <0.01,总IgE水平两组之间P <0.01.
2.2 哮喘、ABPA与正常受试者血清蛋白质芯片的分析
2.2.1 哮喘组与正常对照组血清蛋白质差异表达分析
根据筛选阈值,对分析结果进行可视化展示见哮喘组和对照组差异表达蛋白质(differentially expressed protein,DEP)的火山图和聚类热图(图1).通过比较哮喘组与对照组血清中440个细胞因子的表达谱,共获得7个显著差异表达蛋白质.其中,表达上调的有5个;表达下调的有2个(表2).
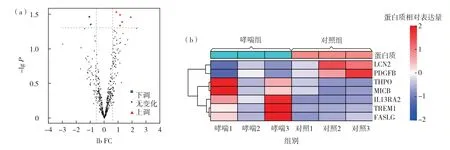
图1 哮喘组与正常对照组血清DEPs的(a)火山图和(b)聚类热图Fig.1 (a)Volcano map and(b)expression profile heatmap of serum DEPs compared asthma patients to healthy controls.
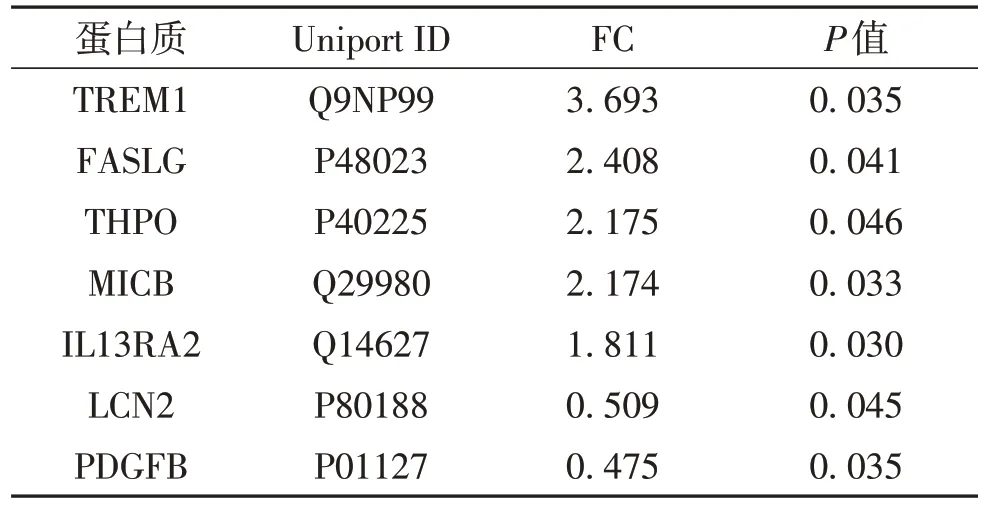
表2 哮喘与正常对照组的血清差异表达蛋白质Table 2 Serum DEPs compared asthma patients to healthy controls
对这7 个差异表达基因进行GO 和KEGG 富集分析,每个功能术语按照P值进行升序排列,对结果进行气泡图展示(图2),结果发现:①GO 富集包括生物学过程(biological process,BP)、细胞组分(cellular component,CC)和 分 子 功 能(molecular function,MF).其中,BP 中P<0.05 的有18 条,CC 中P<0.05 的有3 条,MF 中P<0.05 的有8 条.排名前3条的分别是免疫反应调控、巨核细胞正向调控和自然杀伤细胞凝集素样受体结合.②KEGG富集的通路中P<0.05的有12条,排名前3条的通路分别是Jak-STAT 信号通路、细胞因子及其受体互作通路和自然杀伤细胞毒性通路.
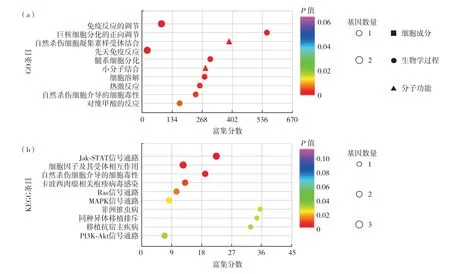
图2 哮喘组与正常对照组血清DEPs的(a)GO和(b)KEGG分析(排名前10位)Fig.2 Top 10 of(a)GO and(b)KEGG analyses of serum DEPs compared asthma patients to healthy controls.
蛋白质互作分析结果如图3,其中,血小板衍生生长因子B 亚基(platelet-derived growth factor subunit B,PDGFB)、白细胞介素13 受体α2 亚基(interleukin-13 receptor subunit alpha 2,IL13RA2)和促血小板生成素(thrombopoietin,THPO)能够形成互作网络;Fas 配体(Fas ligand,FASLG)和MHC 类多肽相关序列B(MHC class I polypeptide-related sequence B,MICB)有互作关系.
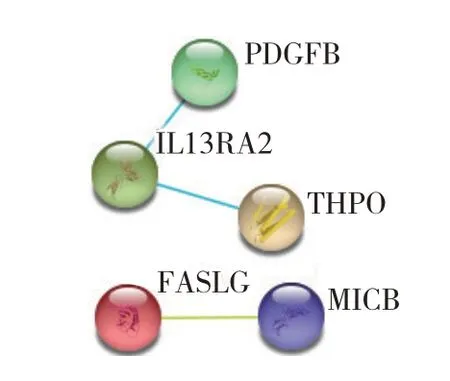
图3 哮喘与正常对照组血清候选DEP的互作网络Fig.3 PPI network of serum protein candidates between asthma patients and healthy controls.
2.2.2 ABPA组与正常对照组的蛋白质表达差异分析
比较ABPA 组和对照组血清中细胞因子的表达量,根据筛选条件,共获得15 个差异表达蛋白质(表3).其中,上调表达的有7个;下调表达的有8个.将分析结果可视化,获得ABPA组和对照组差异表达蛋白质的火山图和聚类热图(图4).对这15个差异表达基因进行GO 和KEGG 富集分析,按照P值进行升序排列,对结果进行气泡图展示(图5),结果发现:①GO富集分析,BP中P<0.05的有30条,CC中P<0.05的有5条,MF中P<0.05的有7条.前3条分别是质膜的固有成分、脂多糖应答和适应性免疫反应.②KEGG 富集的通路其中P<0.05 的有7 条,前3 条通路分别是细胞因子受体相互作用通路、趋化因子信号通路和脂肪细胞因子信号通路.
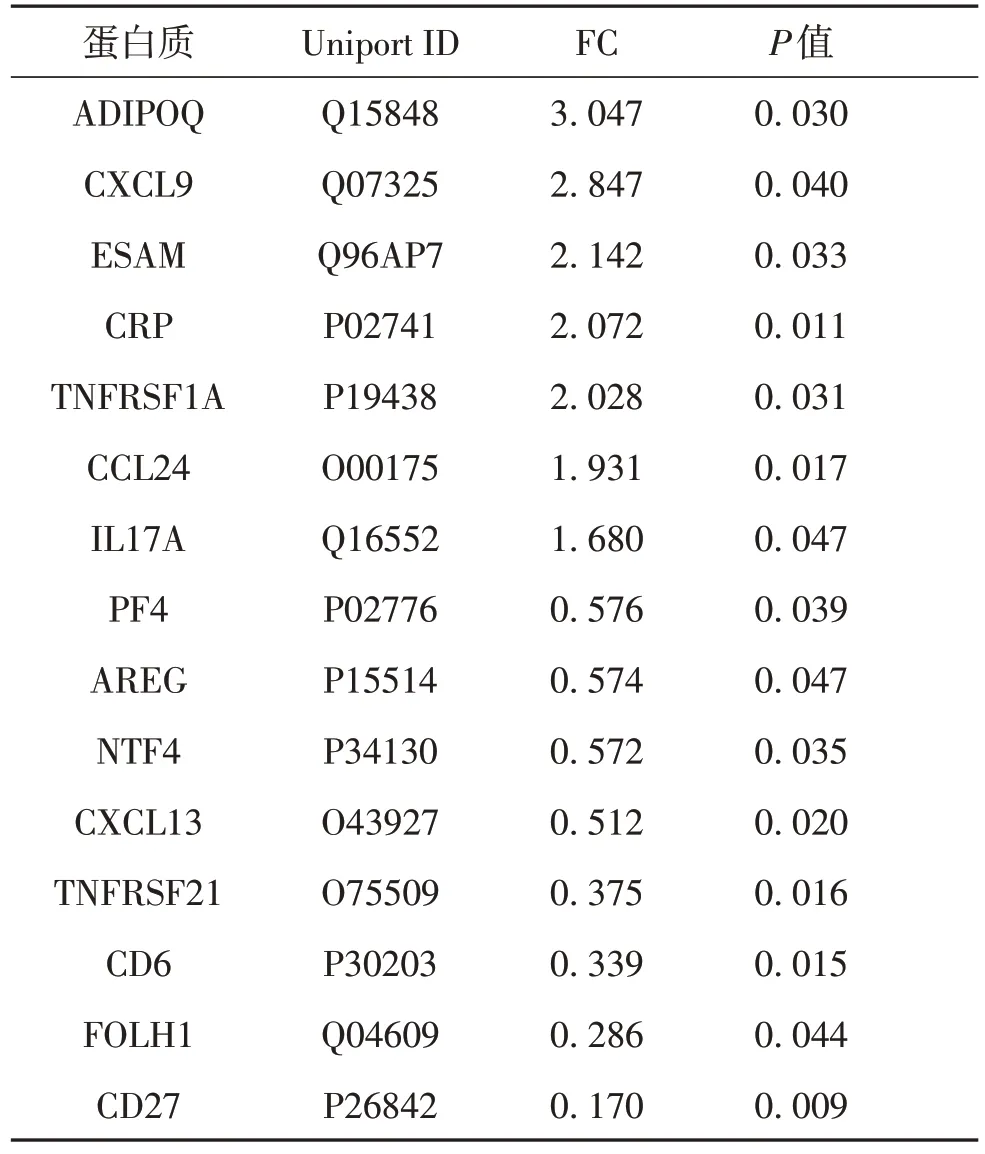
表3 ABPA组与对照组的血清差异表达蛋白质Table 3 Serum DEPs compared ABPA patients to controls
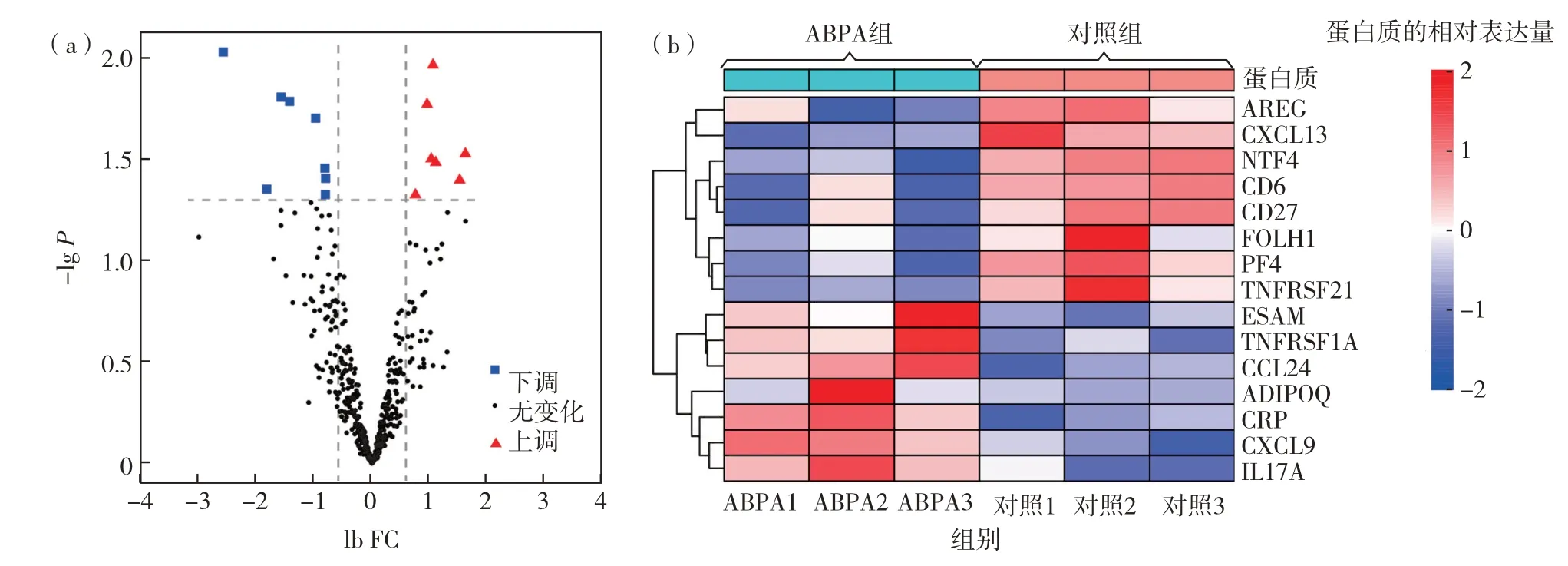
图4 ABPA与正常对照组血清DEPs的(a)火山图和(b)聚类热图Fig.4 (a)Volcano map and(b)expression profile heatmap of serum DEPs compared ABPA patients to healthy controls.

图5 ABPA与正常对照血清DEPs的(a)GO和(b)KEGG分析(排名前10位)Fig.5 Top 10 of(a)GO and(b)KEGG analyses of serum DEPs compared ABPA patients to healthy controls.
蛋白质互作分析结果如图6.由图6 可见,脂肪连接蛋白(adiponectin,ADIPOQ)、CXC趋化因子配体9(C-X-C motif chemokine ligand 9,CXCL9)、内皮细胞黏附分子(endothelial cell adhesion molecule,ESAM)、C 反应蛋白质(C-reactive protein,CRP)、TNF 受体超家族成员1A(TNF Receptor Superfamily Member 1A,TNFRSF1A)、C-C 基序趋化因子配体24(C-C motif chemokine ligand 24,CCL24)、白介素17A(interleukin 17A,IL17A)、血小板因子(platelet factor 4,PF4)、CXC 趋化因子配体13(C-X-C motif chemokine ligand 13,CXCL13)、TNF 受体超家族成员 21(TNF receptor superfamily member 21,TNFRSF21)、T 细胞分化抗原CD6 和T 细胞活化抗原CD27共12个蛋白质形成互作网络.这些互作蛋白质主要富集在细胞因子受体相互作用通路和趋化因子信号通路.
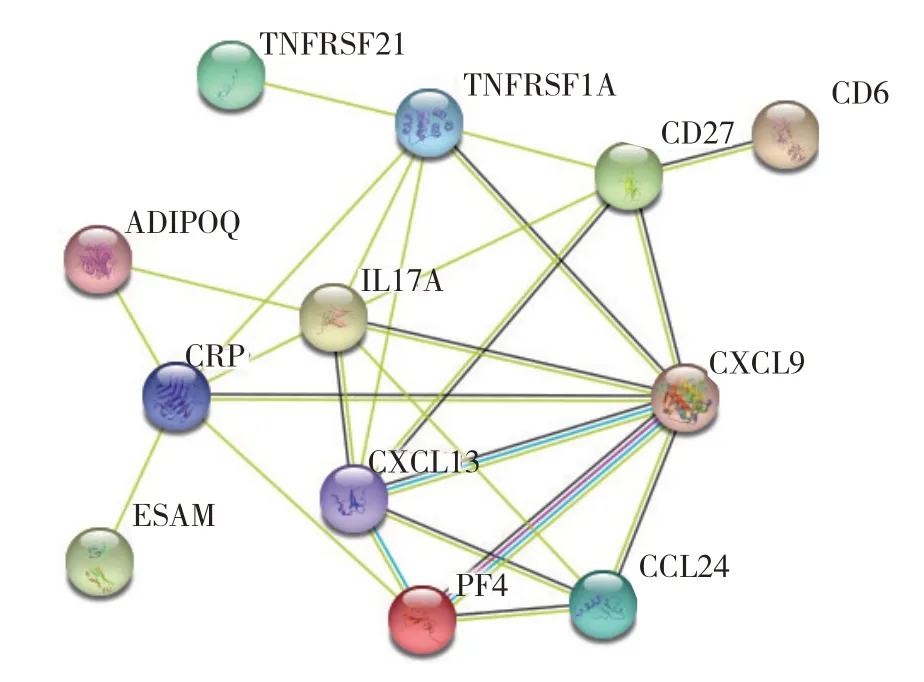
图6 ABPA与正常对照组血清候选DEPs的互作网络Fig.6 PPI network of serum candidate DEPs between ABPA patients and healthy controls.
2.2.3 ABPA组与哮喘组的差异表达蛋白质分析
依据筛选阈值,通过比较ABPA 组和哮喘组患者血清中细胞因子的表达谱,共获得15 个差异表达蛋白质(表4),其中,表达上调的有4 个;表达下调的有11 个.对分析结果进行可视化展示见ABPA 组和哮喘组差异表达蛋白质的火山图和聚类热图(图7).

表4 ABPA与哮喘两组的血清差异表达蛋白质Table 4 Serum DEPs compared ABPA patients to asthma patients
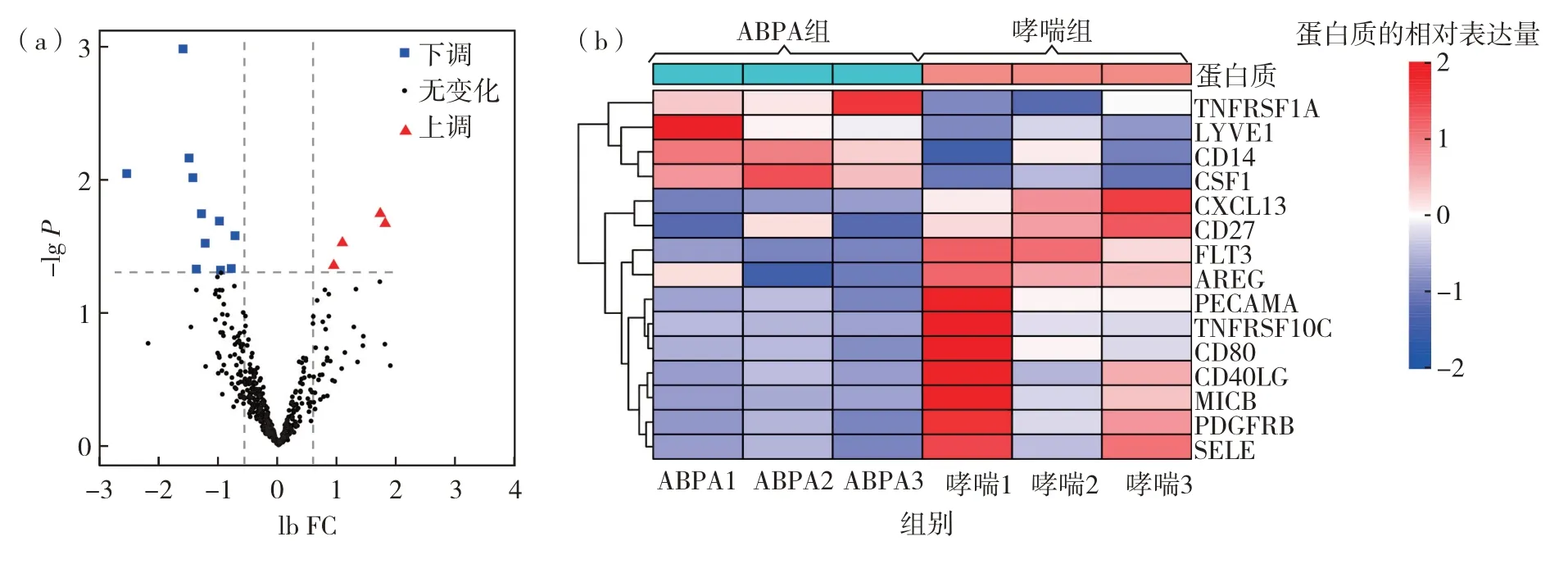
图7 ABPA与哮喘组血清DEPs的(a)火山图和(b)聚类热图Fig.7 (a)Volcano map and(b)expression profile heatmap of serum DEPs compared ABPA patients to asthma patients.
对这15 个差异表达基因进行GO 和KEGG 富集分析,按照P值进行升序排列,结果如图8.由图8可见:①GO 富集分析,BP 中P<0.05 的有39 条,CC 中P<0.05 的有5 条,MF 中P<0.05 的有9 条.前3条分别是细胞膜、跨膜信号受体活性和细胞因子介导的信号通路.②KEGG 富集的通路其中P<0.05 的有24 条,前3 条通路分别是细胞因子及其受体相互作用通路、丝裂原活化蛋白激酶信号通路和疟疾通路.
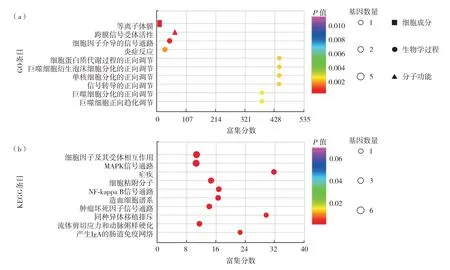
图8 ABPA与哮喘组血清DEPs的(a)GO和(b)KEGG分析(排名前10位)Fig.8 Top 10 of(a)GO and(b)KEGG analysis of serum DEPs compared ABPA patients to asthma patients.
蛋白质互作分析结果如图9,单核细胞分化抗原CD14、集落刺激因子1(colony stimulating factor 1,CSF1)、淋巴管内皮透明质酸受体1(lymphatic vessel endothelial hyaluronan receptor 1,LYVE1)、TNFRSF1A、Fms 相关受体酪氨酸激酶(fms related receptor tyrosine kinase 3,FLT3)、双调蛋白(amphiregulin,AREG)、TNF 受体超家族成员(10c TNF receptor superfamily member 10c,TNFRSF10C)、血小板衍生生长因子受体(platelet derived growth factor receptor beta,PDGFRB)、选择素E(selectin E,SELE)、T 淋巴细胞活化抗原CD80、CD40 抗原配体(CD40LG)、MHC类多肽相关序列B(mhc class I polypeptide-related sequence B,MICB)、血小板与内皮细胞黏附分子1(platelet and endothelial cell adhesion molecule 1,PECAM1)、CXCL13和CD27共14个蛋白质形成互作网络.
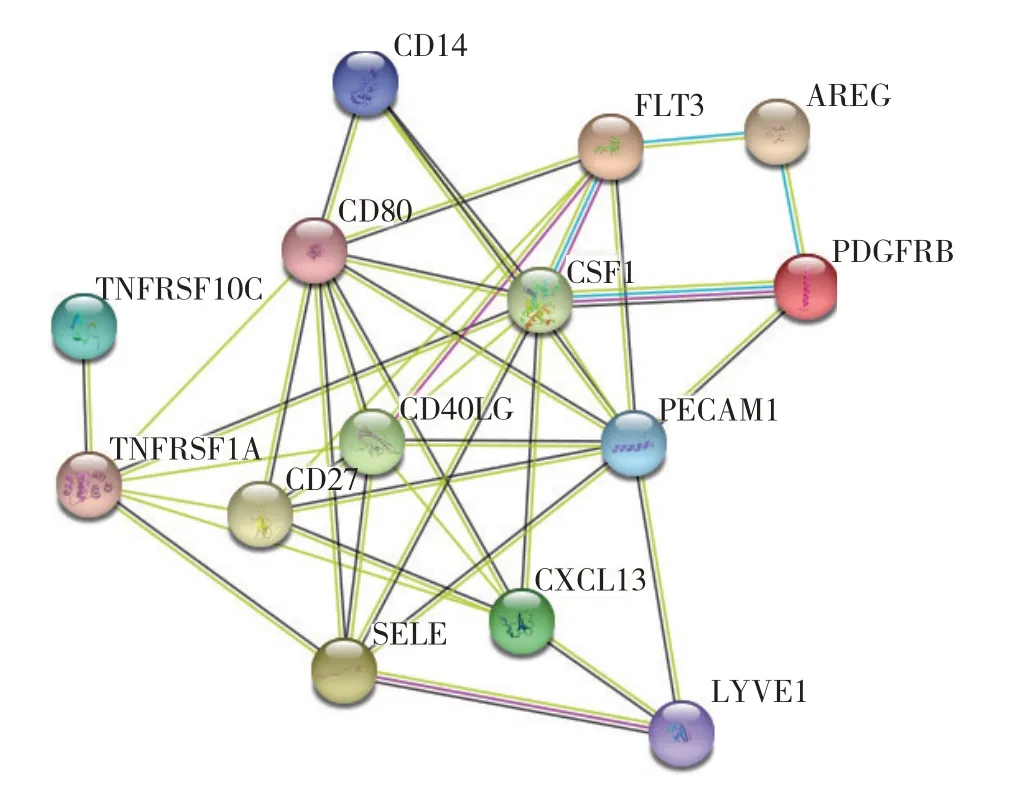
图9 ABPA与哮喘组血清候选DEPs的互作网络Fig.9 PPI network of serum candidate DEPs between ABPA patients and asthma patients.
2.3 哮喘、ABPA与正常受试者血清蛋白质MRM实验结果分析
为了获得更多的候选生物标志物,本研究从已报道过的、通过iTRAQ方法筛选ABPA和哮喘患者血清的差异表达蛋白质中挑选了38个候选靶标[16],利用MRM 方法检测ABPA 与哮喘组单个样本的蛋白质表达水平与差异.
MRM 的验证结果如下:①哮喘组和正常对照组比较,发现3 个差异表达蛋白质,分别是Serpin 家族F 成员2(serpin family F member 2,SERPINF2)、补体C6 和透明质酸结合蛋白2(hyaluronan binding protein 2,HABP2),见图10(a);②ABPA 组和正常对照组比较,发现2个差异表达蛋白质,分别是SERPINF2和凝血因子10(coagulation factor X,F10),见图10(b);③ABPA 组和哮喘组比较,发现2 个差异表达蛋白质,分别是羧肽酶N 亚基2(carboxypeptidase N subunit 2,CPN2)和免疫球蛋白类 肽5(immunoglobulin lambda like polypeptide 5,IGLL5),见图10(c).
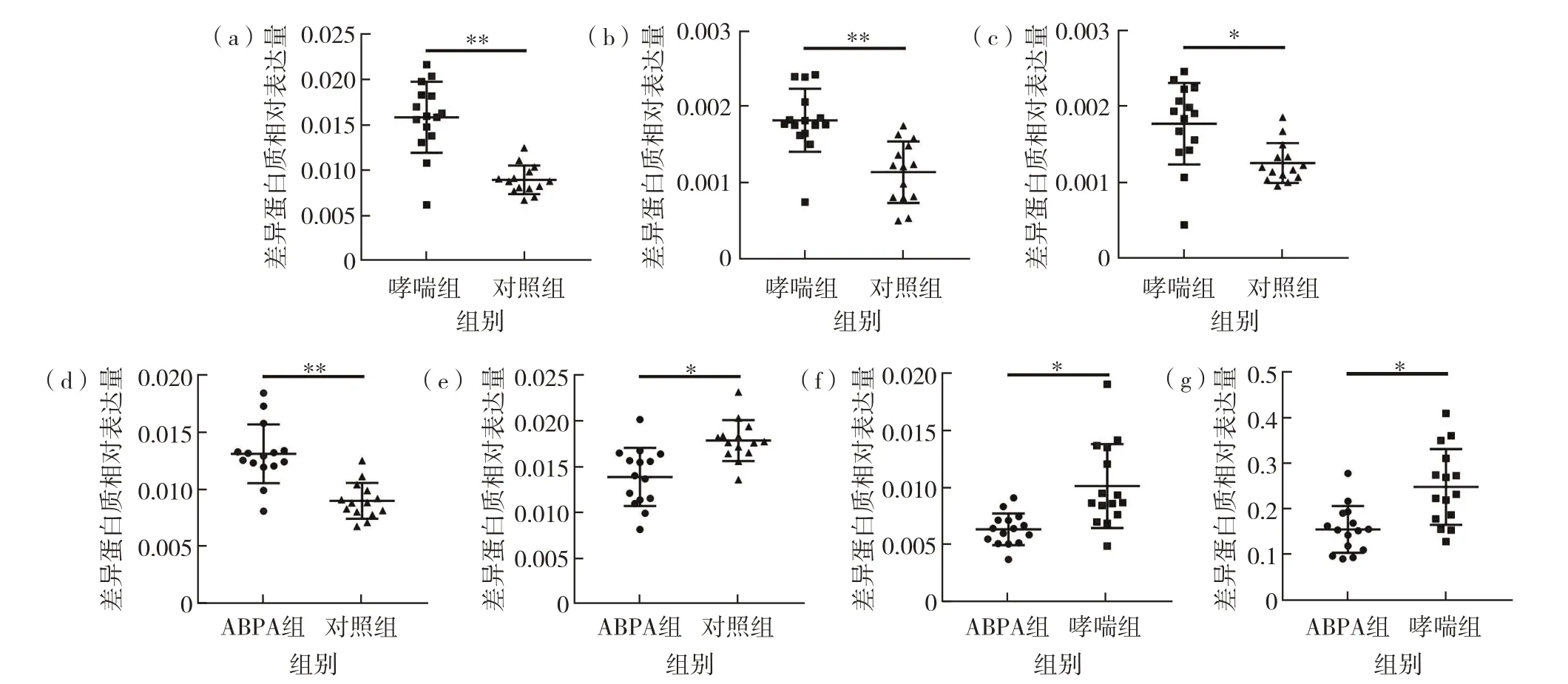
图10 MRM验证哮喘和ABPA血清候选蛋白质生物标志物(a)SERPINF2在哮喘组和正常对照组血清中的相对表达量;(b)C6在哮喘组和正常对照组血清中的相对表达量;(c)HABP2在哮喘组和正常对照组血清中的相对表达量;(d)SERPINF2在ABPA组和正常对照组血清中的相对表达量;(e)F10在ABPA组和正常对照组血清中的相对表达量;(f)CPN2在ABPA组和哮喘组血清中的相对表达量;(g)IGLL15在ABPA组和哮喘组血清中的相对表达量Fig.10 Verification of serum candidate protein biomarkers of asthma and ABPA with MRM.(a)Relative abundance of SERPINF2 in the serum of asthma and control group,(b)relative abundance of C6 in the serum of asthma and control group,(c)relative abundance of HABP2 in the serum of asthma and control group,(d)relative abundance of SERPINF2 in the serum of ABPA and control group,(e)relative abundance of F10 in the serum of ABPA and control group,(f)relative abundance of CPN2 in the serum of ABPA and asthma group,(g)relative abundance of IGLL15 in the serum of ABPA and asthma group.
2.4 与哮喘和ABPA 疾病相关的候选蛋白质的ELISA验证分析
为从以上生信分析得到的、影响哮喘和ABPA发生发展的候选细胞因子中,挑选出可能参与哮喘和ABPA发病调控的关键因子,以及具有诊断价值和预后干预潜能的相关细胞因子,本研究运用ELISA试剂盒对候选蛋白质标志物的单个样本进行验证,包括:细胞因子蛋白质芯片筛选出来的差异表达蛋白质5个(CD14、CSF1、TNFRSF10C、CXCL13 和CD6)以及MRM 检测的明显差异表达蛋白质1个(IGLL5),实验结果如图11.由图11(a)可见,CSF1蛋白质在ABPA患者血清水平显著低于哮喘组,而TNFRSF10C在ABPA患者血清水平显著高于哮喘组.其他经ELISA法验证的血清细胞因子水平,在两两比对分析时,均呈现无显著性变化,见图11(b).
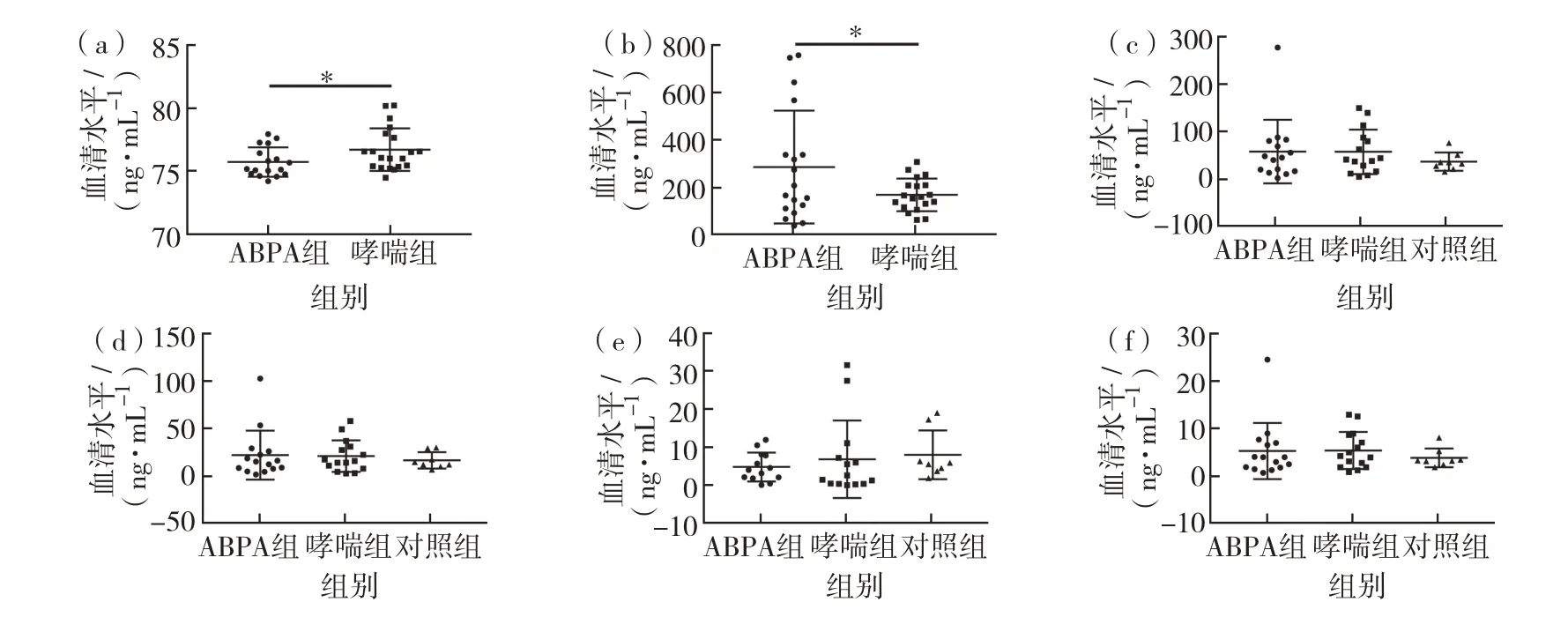
图11 ELISA验证哮喘和ABPA血清候选蛋白质生物标志物(a)CSF1在ABPA和哮喘组血清中的水平;(b)TNFRSF10C在ABPA和哮喘组血清中的水平;(c)CD6在ABPA、哮喘和正常对照组血清中的水平;(d)CD14在ABPA、哮喘和正常对照组血清中的水平;(e)CXCL13在ABPA、哮喘和正常对照组血清中的水平;(f)IGLL15在ABPA、哮喘和正常对照组血清中的水平Fig.11 Verification of serum candidate proteins between asthma and ABPA by ELISA.(a)Serum levels of CSF1 in the ABPA and asthma group,(b)serum levels of TNFRSF10C in the ABPA and asthma group,(c)serum levels of CD6 in the ABPA,asthma and control group,(d)serum levels of CD14 in the ABPA,asthma and control group,(e)serum levels of CXCL13 in the ABPA,asthma and control group,(f)serum levels of IGLL15 in the ABPA,asthma and control group.
2.5 哮喘和ABPA 患者血清差异表达蛋白质的ROC曲线分析
利用MRM 和ELISA 的检测结果,绘制ROC 曲线,评估经验证表现出有显著表达差异蛋白质的诊断价值.在MRM结果中,由于SERPINF2在哮喘与正常对照组、ABPA 与正常对照组两两比较中都有明显的差异表达,表明它不具有对这两个亚型的鉴别诊断价值,故没有进行ROC曲线分析.
ROC 曲线分析结果如下:①差异蛋白质对哮喘与正常对照组的诊断价值,见图12(a).由图12(a)可见,A(C6)=0.914(95%CI为0.797~1.000,P<0.05),敏感度为73.3%,特异性为99.9%.A(HABP2)=0.833(95% CI 为0.670~0.996,P<0.05),敏感度为86.7%,特异性为78.6%.两个指标联合诊断的ROC 曲线AUC 为0.905(95% CI 0.784~1.000,P<0.05),敏感度为80.0%,特异性为92.9%.以上结果表明,对于哮喘和正常对照组比较A(C6)高于A(HABP2)以及两个指标的联合诊断,提示C6 可能是哮喘的生物标志物的AUC.②差异蛋白质对ABPA与正常对照组的诊断价值见图12(b).由图12(b)可见,A(F10)=0.871(95%CI 为0.734~1.000,P<0.05),敏感度为80.0%,特异性为85.7%.A(F10)较高,说明F10 可能是ABPA 的生物标志物.③差异蛋白质对ABPA 和哮喘组的诊断价值见图12(c).A(CPN2)=0.867(95% CI 为0.726~1.000,P<0.05),敏感度为86.7%,特异性为80.0%.A(IGLL5)=0.827(95%CI 为0.678~0.975,P<0.05),敏感度为93.3%,特异性为66.7%.CPN2 和IGLL5 联合诊断的ROC 曲线AUC 为0.902(95% CI 为0.781~1.000,P<0.05),敏感度为100%,特异性为80.0%.A(TNFRSF10C)=0.576(95% CI 为0.726~1.000,P=0.44),由于AUC <0.7,并且P>0.05,没有统计学意义.所以,TNFRSF10C的诊断价值较差,不能作为生物标志物.以上结果表明,CPN2 和IGLL5联合诊断的AUC最高,敏感度和特异性也较好,所以CPN2 和IGLL5 的组合是区分ABPA 和哮喘的较佳指标.
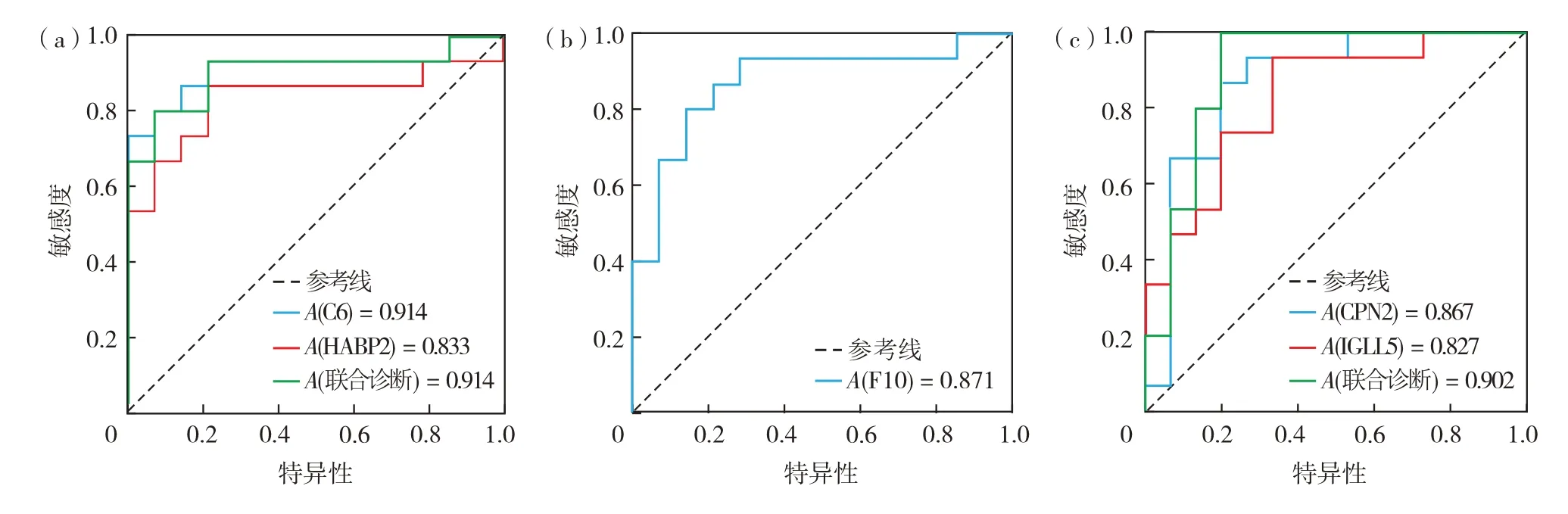
图12 哮喘、ABPA和正常对照组之间血清差异表达蛋白质的诊断价值ROC曲线评估(a)C6和HABP2的ROC曲线;(b)F10的ROC曲线;(c)CPN2和IGLL5的ROC曲线Fig.12 Diagnotic values of serum DEPs for asthma and ABPA by ROC.(a)ROC curves of C6 and HABP2,(b)ROC curve of F10,(c)ROC curves of CPN2 and IGLL5.
3 讨论
本研究利用440种细胞因子特异性抗原-抗体反应的蛋白质芯片来检测哮喘和ABPA患者血清多种与炎症-免疫相关蛋白质的表达水平,这是一种检测与分析体液样本中蛋白质表达水平的大通量定性和定量的方法.该方法本身具有较高的灵敏度,可发现样本中与疾病病变和特征密切相关的一些低丰度蛋白质生物标志物.多反应监测质谱(multiple reaction monitoring mass spectrometry,MRM-MS)是一种靶向质谱方法,已在临床实验中用于血浆、血清和尿液中小分子的准确定量.通过以上两种高通量研究方法,筛选并验证哮喘和ABPA的蛋白质诊断标志物,可以更好地鉴别这两种不同病因所致临床表型相近的肺过敏反应.并通过ROC 曲线分析候选蛋白标志物-与疾病相关差异表达蛋白质的诊断价值,可挖掘潜在的、有助于精准诊疗的新生物标志物.
基于大通量细胞因子蛋白质芯片的方法,本研究针对哮喘、ABPA 和健康对照3 组受试者,比较不同组别血清中的细胞因子表达谱,并通过生物信息学分析ABPA 比对照组、哮喘比对照组、ABPA比哮喘组,获得1批与这两个不同亚型疾病发生发展相关的候选蛋白质标志物.
通过MRM 和ELISA 方法,比较分析哮喘与正常对照组结果,发现SERPINF2、C6 和HABP2 这3个蛋白质的表达具有明显的差异表达.SERPINF2是一种纤溶酶的抑制剂,长期持续性哮喘可能发生肺部纤维化,而SERPINF2 与纤维化的进展有关,可能充当纤维化变化的局部调节剂[18].C6 是补体级联的组成部分,由C5b、C6、C7、C8 和C9 组成一种独立于C3a 和C5a 活性的另一途径的复合物,在体内激活核苷酸结合域和NLRP3 炎症小体.活化后,产生具有生物活性的IL-1β和IL-18,促进中性粒细胞募集和Th17 细胞的极化.已发现重症哮喘、类固醇抵抗性哮喘和中性粒细胞性哮喘都与C6 参与激活的NLRP3 表达增加有关[17].血浆蛋白HABP2,也被称为因子Ⅶ激活蛋白酶,编码透明质酸结合蛋白.文献[19]报道,HABP2 通过激活因子Ⅶ和前尿激酶降解细胞外基质,并在凝血过程中发挥作用.
在ABPA 与正常对照组比较的结果中,F10 和SERPINF2呈显著性差异表达,SERPINF2也出现在哮喘和正常对照组的比较中,说明SERPINF2 的表达差异不是特异性的,可能是过敏反应的1个关键调控因子.F10 基因编码血凝级联的维生素K 依赖凝血因子Ⅹ,可能在哮喘中发挥重要作用,参与凝血酶激活,并且是蛋白酶激活受体-1(recombinant protease activated receptor 1,PAR-1)激动剂[20].在本研究中F10 的ROC 曲线AUC 较高,敏感度和特异性也较好,这说明F10 可能可开发作为ABPA 的诊断生物标志物.
本研究还发现,ABPA 组与哮喘组的差异表达蛋白质有TNFRSF10C、CSF1、CPN2 和IGLL5.TNFRSF10C 是TNF 受体超家族的成员;CSF1 是调节多种细胞功能的多效细胞因子;CSF1 及其受体(CSF1R)能够调节骨髓细胞的功能,在先天免疫应答中发挥关键作用[21].本研究中,TNFRSF10C 和CSF1 在蛋白质芯片和ELISA 实验中的表达趋势是相反的,这可能是由于ELISA 实验时同1批样本中部份样本所剩量不足,造成被检样本数量偏低,使得样本的个体差异偏大,需要扩大样本进一步验证.
经过对这些候选蛋白质进行ROC 分析,发现C6 的AUC 高于HABP2.另外,如果将它们两两组合用于诊断,其灵敏度和特异性也比较高,由此表明,C6 蛋白质可能可以作为哮喘诊断的一个优质生物标志物.另外,ROC 分析结果还表明CPN2 和IGLL5联合诊断的AUC最高,敏感度和特异性也较好,所以CPN2 和IGLL5 的组合可能是区分ABPA和哮喘的较佳指标.
结语
利用蛋白组学和生物信息学技术,筛选哮喘患者和ABPA 患者血清发现1 批与疾病病变相关的蛋白质生物标志物.通过ROC 曲线分析,预估了这些新型蛋白质生物标志物的诊断与鉴别诊断的潜能.下一步需深入了解它们在哮喘和ABPA病变中的分子调控机制,以更好地开发它们临床应用的价值.
