BET选择性抑制剂38号化合物对急性肝损伤小鼠保护作用研究*
2022-09-27吴康卉石翠翠范建高李光明
付 荣,吴康卉,石翠翠,范建高,李光明
急性肝损伤(acute liver injury,ALI)是临床常见的由肝炎病毒、药物副作用、酒精滥用、代谢综合征或细菌感染等引起的肝脏疾病。尽管病因有相当大的差异,但这些病因均能激活免疫反应,在最初的损伤后增强炎症反应,并可能导致肝细胞过度死亡,进而导致肝功能衰竭[1]。目前,尚无针对ALI的特异性临床治疗方法。溴结构域(bromodomains,BRDs)是一个蛋白质相互作用模块,具有表观遗传调控作用。通过特异性的结合组蛋白和其他蛋白上的乙酰化赖氨酸调控基因表达。根据结构/序列相似性,人类基因组中的61个BRD聚类为8个家族[2,3]。在这8个家族中,溴域和末端外结构域(bromodomain and extra-terminal,BET)蛋白家族最为突出。BET家族由BRD2、BRD3、BRD4和BRDT结构域组成[4,5]。BET蛋白作为转录调控元件,参与基因转录调控的多个层面,在表观遗传方面展现出了重要的作用。BET家族蛋白功能失调参与了多种疾病的发生发展。靶向抑制BET已经被报道可以应用于多种炎症相关性疾病和肿瘤的治疗[6-9]。研究表明,炎症和氧化应激反应在肝损伤的发生发展过程中发挥重要作用,抑制肝脏炎症反应能够有效地缓解肝损伤[10,11]。38号化合物作为选择性的BET抑制剂,能够选择性地抑制组织BRD2、BRD3、BRD4和BRDT表达[12],推测它也可以通过缓解炎症反应对ALI起保护作用。CCl4诱导的小鼠ALI模型被广泛应用于评价保护性实验,因为CCl4通过细胞色素P450代谢形成中间体,进而能产生脂质过氧化和肝损伤,与人类急性化学性肝损伤的发生机制相似[13]。本研究旨在使用CCl4诱导的小鼠ALI模型,探究了38号化合物对ALI的保护作用。
1 材料与方法
1.1 动物、药物和主要试剂 8~10周龄雄性C57BL/6小鼠24只,由中科院药物研究所实验动物中心提供,饲养于SPF级实验动物房,自由食水。所有的动物实验手术操作均通过中科院上海药物研究所动物伦理委员会批准。LPS(EColi,菌株O111.B4)购自美国Sigma公司。羟丙基甲基纤维素(HPMC)、CCl4、橄榄油均购自上海国药集团化学有限公司。38号化合物由中科院上海药物研究所惠赠。RNA抽提和逆转录剂购自诺唯赞南京生物技术有限公司。HE、F4/80+和 LY-6G+免疫组化染色试剂盒购自武汉谷歌生物。检测ALT和AST试剂盒购自南京建成生物工程研究所。
1.2 细胞培养和细胞炎症模型的建立 取鼠源的巨噬细胞系Raw264.7细胞(中科院上海药物研究所),培养于含1%链霉素和青霉素的高糖DMEM完全培养基,加10%血清(Gibco澳洲胎牛血清),培养于CO2体积分数为0.05的、恒温37℃的培养箱。以每孔1×106的密度接种于六孔板中。待细胞贴壁后,加入LPS(1 μg/mL)[14,15]和38号化合物(浓度分别为80 nM、40 nM、20 nM、10 nM)共刺激培养4 h,培养条件同前。去上清,采用Trizol法提取细胞RNA,反转录成cDNA,采用qRT-PCR法检测IL-1β、IL-6和TNF-αmRNA水平。以Gapdh为内参,采用2-ΔΔCT分析数据。引物序列为:反向IL-1β :TGGATGCTCTCATCAGGACAG;GAPDH:TGTAGACCATGTAGTTGAGGTCA;IL-6:AGTGGTATAGACAGGTCTGTTGG;TNF-α:CGATCACCCCGAAGTTCAGTAG;正向IL1-β :GAAATGCCACCTTTTGACAGTG;GAPDH:AGGTCGGTGTGAACGGATTTG;IL-6:CTGCAAGAGACTTCCATCCAG;TNF-α:CAGGCGGTGCCTATGTCTC。
1.3 ALI小鼠模型的建立 取C57BL/6小鼠,饲养于SPF级动物房。取CCl4,溶于橄榄油,配成10% 的CCl4溶液。取38号化合物,溶解于0.5%HPMC、1%DMSO和PBS溶剂中配制成溶液。取24只小鼠,随机分为对照组、模型组和干预组,每组8只。在对照组,给予溶剂橄榄油2 ml.kg-1,腹腔注射,0.5%HPMC、1%DMSO和PBS溶剂灌胃;在模型组,给予10% CCl4溶液2 ml.kg-1,腹腔注射1次[16],0.5%HPMC、1%DMSO和PBS溶剂灌胃;在干预组,给予化合物溶液10 mg.kg-1,灌胃,提前给药2次。在第2次给药后2 h,给予10% CCl4溶液2 ml.kg-1,腹腔注射。在CCl4注射后48 h,结束实验。在实验终点,给予异氟烷吸入麻醉、经眼球取血,处死。全血经4℃、3000 r/m离心15 min,取上层血清,保存于-80℃冰箱。取肝组织,部分保存于-80℃冰箱,另一部分置于4%多聚甲醛溶液中固定。在固定48 h后,常规石蜡包埋、切片,行HE染色。用抗F4/80 (1:100,MAB5580,RD)、抗Ly-6G(1:100,MAB1037-100,RD)行免疫组化染色。
1.4 血清检测 使用日立全自动Hitachi 7020生化分析仪 检测血清ALT和AST。
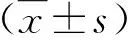
2 结果
2.1 各组细胞细胞因子mRNA水平比较 与对照组比,模型组细胞IL-1β、IL-6和TNF-α mRNA水平显著升高(P<0.05),而干预组显著下降(P<0.05),且呈现出浓度依赖性(表1)。
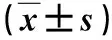
表1 各组细胞细胞因子mRNA水平比较
2.2 各组血生化指标比较 模型组血清ALT和AST水平显著高于对照组(P<0.05),而干预组血清ALT和AST水平显著低于模型组(P<0.05,表2)。

表2 各组血清ALT和AST水平比较
2.3 各组肝组织病理学表现比较 模型组小鼠肝组织结构紊乱,炎症反应明显,肝细胞坏死,正常小叶结构遭到破坏,提示造模成功;在药物干预处理后,肝组织坏死面积减少,结构紊乱和小叶结构破坏减轻(图1);与对照组比,模型组小鼠肝组织间隙巨噬细胞和中性粒细胞大量聚集,炎症反应明显,而经过38号化合物干预处理后,肝组织间隙浸润的巨噬细胞和中性粒细胞明显减少(图2、图3)。

图1 各组小鼠肝组织病理学表现①对照组;②模型组;③干预组
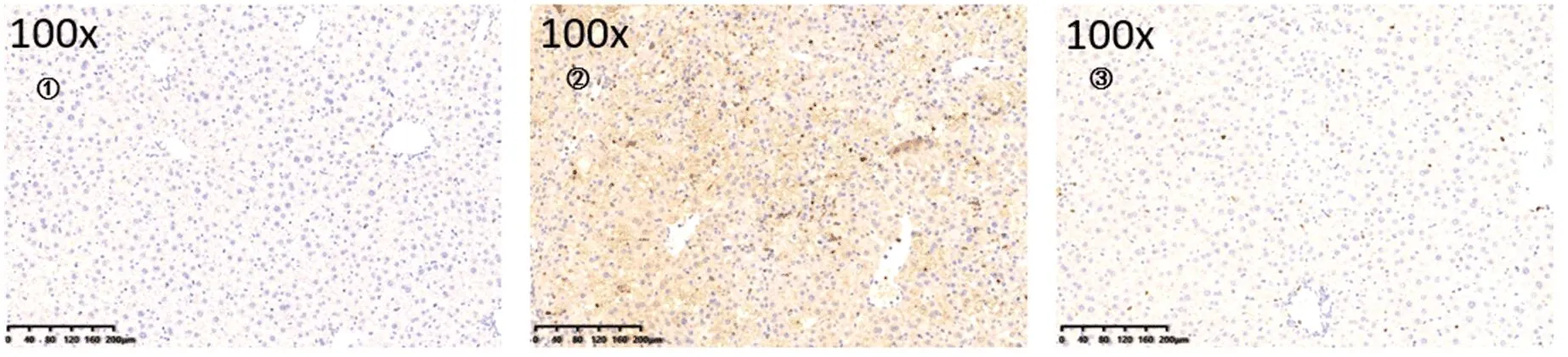
图2 各组小鼠肝组织LY-6G+中性粒细胞表现①对照组;②模型组;③干预组

图3 各组小鼠肝组织F4/80+巨噬细胞表现①对照组;②模型组;③干预组
3 讨论
炎症反应在急性肝损伤的发生发展过程中至关重要。在肝组织受损后,肝组织巨噬细胞启动炎症反应,释放促炎细胞因子和趋化因子,导致旁分泌激活肝细胞保护或者凋亡相关信号通路,招募更多与炎症反应相关的细胞进入受损部位,形成级联反应,进一步加重肝损伤[17-20]。因此,调控炎症反应可能对肝损伤起到保护作用[21,22]。在LPS刺激构建的巨噬细胞炎症模型实验证明,不同浓度38化合物干预处理能明显降低巨噬细胞炎症因子IL-1β、IL-6和TNF-α mRNA水平,且该作用呈现出浓度依赖性。进一步构建体内模型评价38号化合物在体内的抗炎作用,用CCl4腹腔注射一次构建ALI小鼠模型,结果模型组小鼠出现了明显的ALI病理学表现,包括肝组织结构紊乱,肝细胞坏死,正常肝小叶结构遭到破坏,大量炎症细胞聚集等,而药物干预组上述病理学表现均显著减轻。本实验从血清生化水平和组织病理学表现等方面进行了较全面的评价,表明该化合物在体内外具有良好的抗炎效果。
本实验从体内体外两方面分别评价了38号化合物(其分子结构式见图4)的抗炎效果,证明了该化合物可以缓解CCl4注射引起的ALI小鼠肝损伤,其机制可能与减少炎症因子的释放和炎症细胞的聚集有关。ALI经常伴随着较高的死亡率,目前并没有特异的治疗药物,38号化合物所呈现的保护作用提示其可能作为一个潜在的候选药物而应该得到进一步的验证。

图4 38号化合物化学结构
