绿色木霉内切葡聚糖酶基因EgⅦ的克隆及其表达
2022-09-26闫建英冯丽荣汤华京杨可心张晓彤
闫建英,张 智,冯丽荣,汤华京,杨可心,魏 罡,张晓彤
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.黑龙江国宏节能环保有限公司,黑龙江 哈尔滨 150040)
纤维素是自然界含量最丰富,分类最广的可再生资源[1]。它虽具有很大的利用价值,却由于结构稳定很难降解无法直接利用。而纤维素酶可以水解纤维素,作用于纤维素β-1,4 糖苷键,最终生成纤维二糖和葡萄糖[2]。纤维素酶是一组具有协同作用的酶系[3],应用前景很广泛[4],而内切葡聚糖酶作为纤维素酶的核心成分,参与自然界的碳循环,打破纤维素链,水解糖苷键,在纤维素降解中意义非凡。
目前国内外对内切葡聚糖酶基因克隆及表达研究较多,而丝状真菌是常用的产酶菌株,近年来丝状真菌内切葡聚糖酶在不同受体中成功表达,Tao[5]等人将里氏木霉的内切葡聚糖酶基因在毕赤酵母中成功表达,生产低聚糖。董自星[6]等人将黑曲霉中3 个内切葡聚糖酶的基因在毕赤酵母中进行了克隆与表达。韩学易[7]等克隆米曲霉giF-10内切葡聚糖酶基因并在大肠杆菌中成功表达。
由于纤维素酶只有分泌到胞外才可对底物进行降解,所以选择胞外分泌性能良好的菌株尤为重要,枯草芽孢杆菌作为表达系统,具有高效的蛋白分泌能力,可以直接在培养基中分泌蛋白,表达的产物也不容易形成包涵体[8-9],构建得到的工程菌兼具产酶效率高、易培养、生长快的优点,在食品工业生产中有广泛的应用[10-11]。Nobuyuki[12]将嗜碱芽孢杆菌KSM-64的碱性内切葡聚糖酶基因构建的新载体pHSP64 在枯草芽孢杆菌中进行表达,得到了高产的内切葡聚糖酶和氯霉素乙酰转移酶。Cho[13]构建了两个编码纤维素梭菌EngB内切葡聚糖酶和mini-CbpA1支架蛋白的基因,并在枯草芽孢杆菌WB800 中进行了共表达,得到了微纤维素小体。王远[2]等人将来源于热纤梭菌的内切葡聚糖酶基因celA与来源于多粘芽孢杆菌的β-葡萄糖苷酶基因bglA和bglB在枯草芽孢杆菌WB800 中进行了分泌型的单独表达及共表达,实现了分泌表达及分泌型共表达。
本研究将高产纤维素酶绿色木霉的内切葡聚糖酶基因Eg Ⅶ在胞外分泌性能良好的枯草芽孢杆菌WB600 中进行表达,克隆内切葡聚糖酶基因Eg Ⅶ并进行生物信息学分析,构建重组表达载体pMA5-Eg Ⅶ,转化到枯草芽孢杆菌WB600 中,获取枯草芽孢杆菌重组菌株,并对其表达量及分泌的重组酶酶学特性进行研究。为构建高产纤维素酶菌株及纤维素的高效利用奠定了基础。
1 材料与方法
1.1 材料与仪器
大肠杆菌(Escherichia coli,E.coli)top10 实验室保存;枯草芽孢杆菌(Bacillus subtilis,B.subtilis)WB600、pMA5 质粒,北京天恩泽生物科技有限公司;限制性内切酶、T4 DNA 连接酶、DNA 聚合酶、DNA Marker、PCR 产物纯化试剂盒、质粒DNA 小量提取试剂盒、胶回收试剂盒TaKaRa 公司(大连);氨苄青霉素(Ampicillin,Amp)和氯霉素(Chloramphenicol,Cm)均购于上海源叶有限公司;其他生化试剂均为国产分析纯。
ABI 2720 PCR 扩增仪,美国ABI 公司;UV-1780 紫外分光光度计,日本岛津公司;DYCZ-20B DNA 分析电泳仪,北京优尼康生物科技有限公司;UV-1780 紫外分光光度计,日本岛津公司;THZ-98A 振荡培养箱,上海一恒公司;EBA 280/280S 多功能离心机,德国Hettich 公司;STIK高压灭菌器,美国STIK 公司。
1.2 实验方法
1.2.1 EgⅦ 基因编码的蛋白质生物信息分析
利用NCBI 在线网站中BLAST 功能对Eg Ⅶ基因进行同源性进行比对分析[14];采用ExPASy在线软件分析蛋白质的理化性质及二级结构和三级结构[15-16];运用TMHMM 软件预测分析蛋白质的初级结构[17];利用SignalP 软件预测信号肽[18]。
1.2.2 绿色木霉纤维素酶基因EgⅦ 的克隆
根据GenBank 数据库中绿色木霉纤维素酶基因Eg Ⅶ(GenBank 登录号:EU518927)的序列设计引物,F:5′-CCGGAAAGAGCGAAAAT GCC-3′(NdeI),R:5′-CCGGGAGCTGCATGTGTC AGAGG-3′(BamHI)。以mRNA 为模板,在逆转录酶的催化下,引物的引导下合成互补的cDNA,再按照PCR 的方法用两条引物以cDNA 为模板进行扩增。反应条件是:94℃5 min,94℃30 s,55℃30 s,72℃1 min,循环26 次,72℃10 min。反应结束后,取5 µLPCR 产物在1%琼脂糖凝胶中检测扩增结果,用回收试剂盒回收目的基因片段。
1.2.3 重组表达载体的构建
利用NdeI 和BamH I 限制性内切酶分别对基因目的片段和表达载体pMA5 进行双酶切,回收目的条带后用T4连接酶进行连接,转化E.coli感受态细胞top10,涂布含有氨苄青霉素抗性的LB固体平板,37 ℃恒温培养12~16 h。随机挑取生长出的单克隆菌落进行菌液PCR 验证,并将阳性转化子送吉林库美生物有限公司测序。同时,利用小型质粒提取试剂盒提取质粒进行酶切验证,进一步验证重组表达载体构建是否成功。
1.2.4 枯草芽孢杆菌的转化
参照Spizizen 制作感受态细胞的方法[19],制作枯草芽孢杆菌WB600 感受态细胞。利用热激转化法,将pMA5-EgⅦ的质粒转入WB600 感受态细胞中,为了促进转化效率,在转化过程中添加10 µg/mL 的溶菌酶来促进转化[20],将重组菌涂布在含有氯霉素抗性的LB 固体平板上,随机挑取生长出的单克隆菌落进行菌液PCR 验证。为了进一步验证转化是否成功,对正确的菌株提取质粒,进行PCR 鉴定,并将构建成功的重组质粒作为阳性对照,观察是否出现相同大小的目的条带。
1.2.5 重组枯草芽孢杆菌工程菌的表达及酶活测定
由于pMA5 载体是分泌性表达载体,且枯草芽孢杆菌可以直接将蛋白分泌到胞外。利用刚果红染色法观察分析水解圈来验证内切葡聚糖酶在枯草芽孢杆菌中是否分泌表达,即:在含有氯霉素抗性的LB 液体培养基中活化培养重组菌株,37℃摇床内培养12 h。将活化后的菌液涂布到含有纤维素的平板上过夜培养48 h。利用刚果红染色,观察是否出现透明水解圈,原菌株WB600 作为对照,观察并测量透明水解圈的大小;以CMC 为底物,采用3,5-二硝基水杨酸比色定糖(DNS)法测定胞外酶活[21-22],以U/mL 作为酶活力单位,即在特定条件下,1 分钟内转化1 微摩尔底物所需的酶量为一个活力单位(U)。将重组枯草芽孢杆菌株接种到5 mL 的LB 液体培养基中,培养条件为37 ℃、200 r/min,当重组枯草芽孢杆菌达到对数生长期OD600值为0.7~0.8 时,将菌株接种到50 mL 液体发酵培养基中,培养条件为37℃、200 r/min培养,测量周期为12 h,将培养好的菌液4℃,10 000 g,离心10 min,收集上清液,即胞外酶液进行测定。
1.3 重组酶酶学性质的测定
1.3.1 最适反应温度及最适pH 值
取上清粗酶液与底物CMC 反应1 h,反应分别在20~90℃不同温度梯度下进行,以最高酶活为100%参照值,测定内切葡聚糖酶的酶活力。取上清粗酶液在最适反应温度条件下与底物CMC 反应1 h,控制柠檬酸-柠檬酸钠缓冲液的pH 值分别为3.2、4.0、4.8、5.6、6.4、7.2、8.0,以最高酶活作为100%参照值,测定重组酶的内切葡聚糖酶的酶活力[23]。
1.3.2 温度稳定性及pH 值稳定性
在20~90℃不同温度梯度下将粗酶液降保温30 min,然后在50℃条件下反应1 h 来测定剩余酶活力分析其热稳定性。取上清粗酶液,在不同的pH 值环境条件下保温30 min 后测定残留酶活性,由此确定酶的pH 值稳定性[24]。
2 结果与分析
2.1 内切葡聚糖酶基因生物信息学分析
经BLAST 对Eg Ⅶ基因同源对比发现,与Eg Ⅶ基因序列同源性最高(相似度大于99%)的是瑞士木霉QM6a 的Cel61b基因(XM_006963817.1)。利用Protparam 在线分析Eg Ⅶ蛋白质理化性质结果表明:Eg Ⅶ基因编码249 个氨基酸,其蛋白质的分子量为26.800 2 kD,分子式为C1210H1822N322O354S8,理论等电点7.62,原子总数为3 716,不稳定指数为31.12,可以认定为是稳定蛋白,脂溶指数(Aliphatic index)77.63,属于脂溶性蛋白,体外网状蛋白中半衰期为30 h。其氨基酸组成如表1所示,其中带正电荷氨基酸(Arg+Lys)所占百分比为4.8%,共12个,带负电荷氨基酸(Asp+Glu)所占百分比4.4%,共11 个。
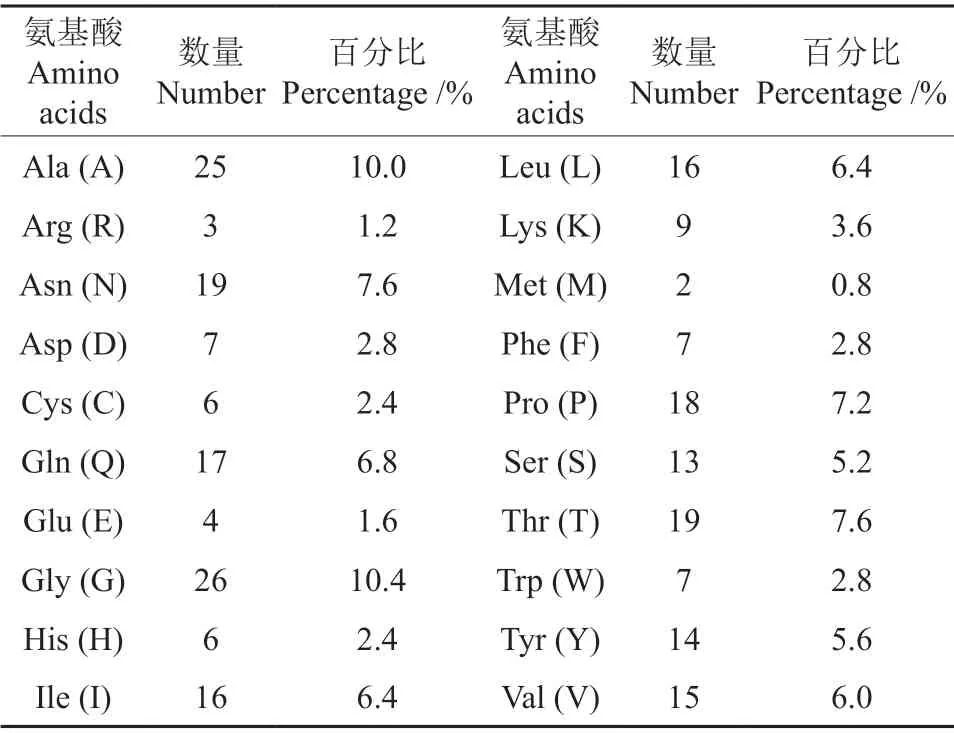
表1 内切葡聚糖酶Eg Ⅶ氨基酸的组成Table 1 Amino acid composition of the endoglucanase EgⅦ
利用TMHMM 在线软件预测内切葡聚糖酶Eg Ⅶ蛋白质初级结构,内切葡聚糖酶Eg Ⅶ跨膜区预测结果(图1A)显示该蛋白不含跨膜区,是胞外蛋白,适合分泌型表达;利用SignalP 在线分析软件对基因进行信号肽的预测,结果(图1B)显示该基因信号肽的剪切位点在19~20 号氨基酸之间;利用ExPaSy 中SOPMA 在线软件预测Eg Ⅶ蛋白质的二级结构结果,表明内切葡聚糖酶Eg Ⅶ蛋白中α-螺旋占到10.84%,延伸链占到26.51%,β-转角占到6.83%,无规则卷曲占到55.82%(图2A);利用ExPaSy 中Swiss model 预测Eg Ⅶ蛋白质的三级结构,内切葡聚糖酶Eg Ⅶ蛋白空间构象由a-螺旋、延伸链区、β-转角和无规则卷曲构成(图2B),与二级结构一致。
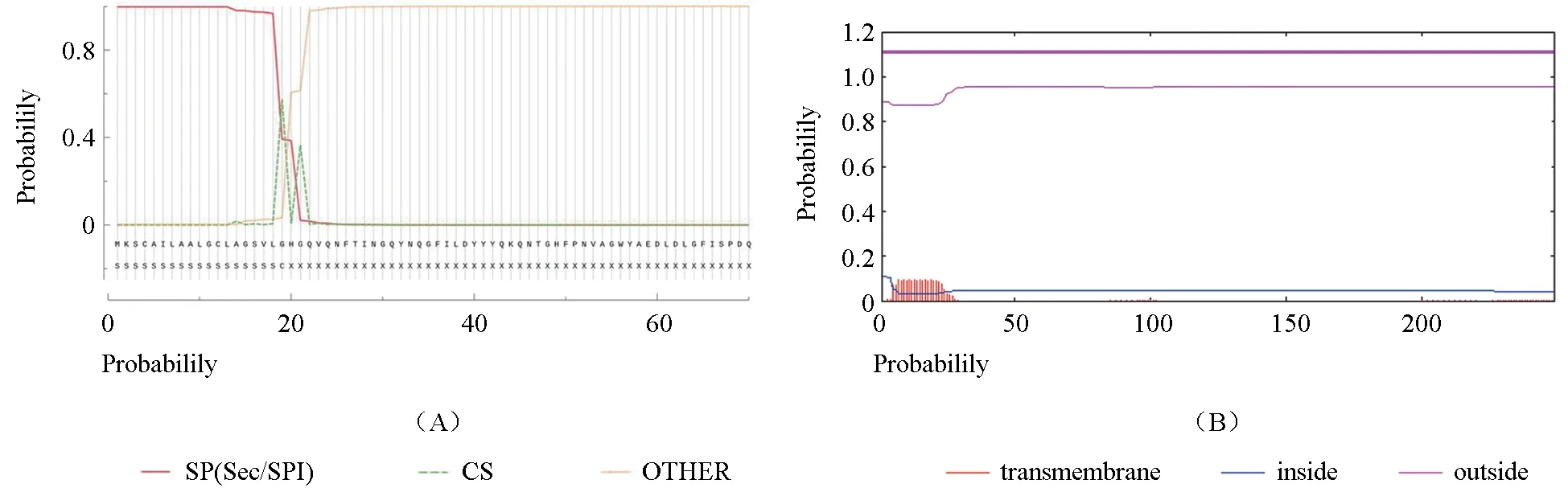
图1 内切葡聚糖酶Eg Ⅶ跨膜段预测(A)、信号肽预测(B)Fig.1 Prediction of the transmembrane region (A) and signal peptide (B) of Eg Ⅶ
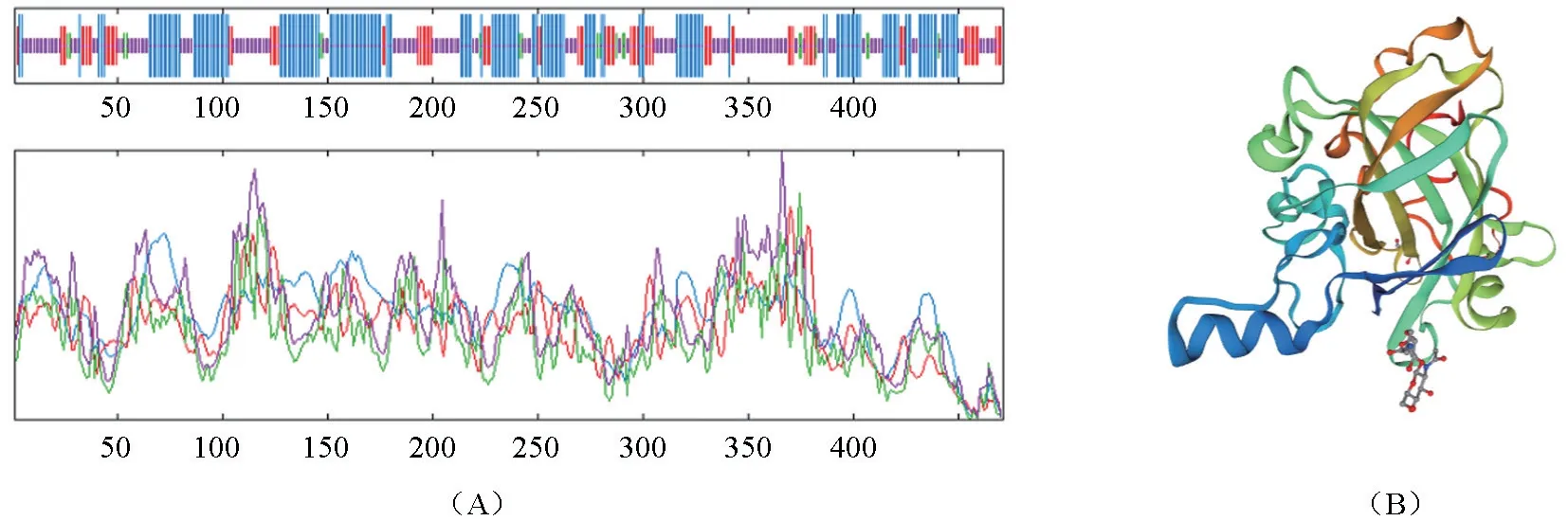
图2 内切葡聚糖酶Eg Ⅶ蛋白二级结构预测(A)、三级结构预测(B)Fig.2 Prediction of secondary structures (A),and tertiary structures (B) of Eg Ⅶ
2.2 内切葡聚糖酶基因克隆与重组载体构建
按照PCR 的方法克隆内切葡聚糖酶基因EgⅦ,通过电泳验证得到大小约750 bp 的条带(图3A);重组表达载体Eg Ⅶ-pMA5 构建图谱见图3B,其条带大小为7 913 bp,符合目的基因与载体条带大小相加之和。挑取抗性平板生长出的单克隆菌落进行菌液PCR鉴定,得到约1 156 bp条带(图4A),与预期片段大小相符。提取质粒利用NdeI和BamHI 酶对重组质粒EgⅦ-pMA5 进行双酶切,获得约750 bp 的目的基因条带(图4A,泳道2、3、4 下)和空载体(图4A,泳道2、3、4 上),还有约大于7 kb 的条带,长度为空载体和目的基因之和(图4B,泳道1),符合预期结果,证明成功地构建了重组载体Eg Ⅶ-pMA5;
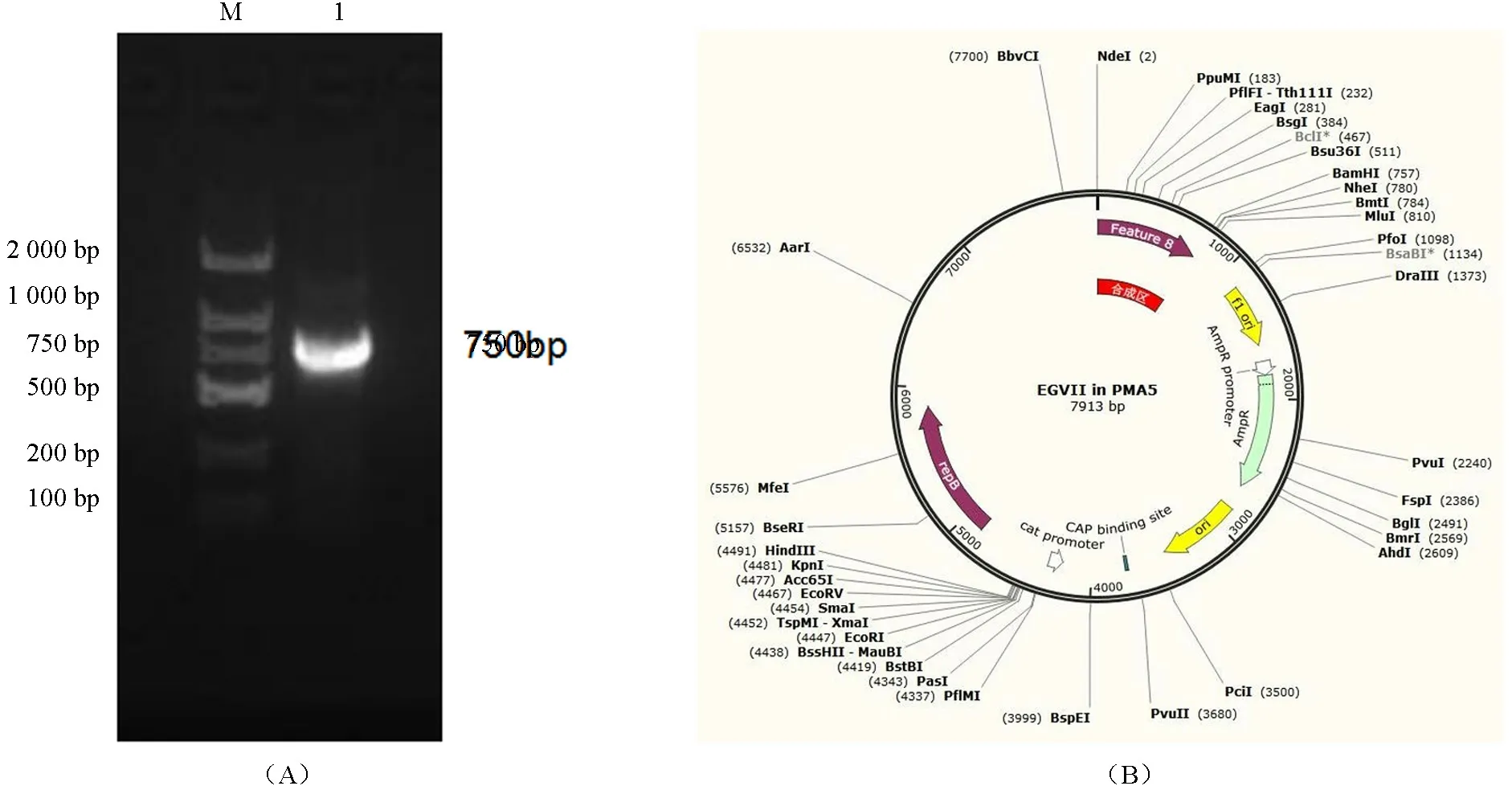
图3 基因Eg Ⅶ的PCR 扩增产物(A)、重组质粒Eg Ⅶ-pMA5 图谱(B)Fig.3 PCR product of Eg Ⅶ (A) and the map pf pMA5-Eg Ⅶ (B)
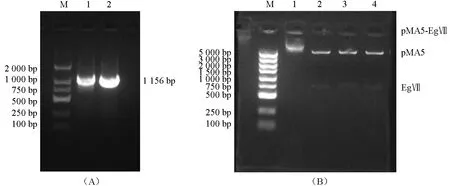
图4 大肠杆菌菌落PCR 鉴定电泳结果(A)、重组质粒Eg Ⅶ-pMA5 的酶切验证(B)Fig.4 Electrophoresis results of E.coli colonies PCR (A) and enzyme digestion of Eg Ⅶ-pMA5 plasmids (B)
2.3 内切葡聚糖酶基因转化
随机挑取抗性平板上转化后的单菌落进行菌液PCR 的验证是否出现目的条带,结果如图5A所示。在与目的基因片段大小符合处出现条带,且对PCR 产物进行测序验证,结果表明重组质粒Eg Ⅶ-pMA5 成功转化到B.subtilisWB600 中。然后对验证条带正确的菌株,使用高纯度质粒小提试剂盒提取质粒,进行PCR 鉴定,电泳结果如图5B,与构建成功的重组质粒Eg Ⅶ-pMA5 条带位置相同,证明已成功将重组质粒Eg Ⅶ-pMA5 转化到B.subtilisWB600 菌株中得到重组菌。

图5 重组枯草芽孢杆菌菌落PCR 鉴定电泳结果(A)、质粒PCR 鉴定电泳结果(B)Fig.5 Electrophoresis results of PCR identification of transformed B.subtilis colonies (A),PCR identification of plasmid (B)
2.4 重组内切葡聚糖酶表达
采用刚果红染色法对重组菌染色后的得到透明圈,如图6所示。经过染色后重组菌株WB600-EgⅦ-pMA5 产生了直径较大透明水解圈(图6),且对原菌株WB600 染色并未出现透明水解圈,说明枯草芽孢杆菌成功表达了目的基因,且分泌表达的纤维素酶具有活性。每隔12 h 对重组菌株WB600-Eg Ⅶ-pMA5 的上清粗酶液进行酶活力测定,结果见图7,重组菌株WB600-Eg Ⅶ-pMA5在0~48 h,酶活呈现增长趋势,到48 h 时,WB600-Eg Ⅶ-pMA5 的酶活力达到最大值为22.71 U/mL;48h 之后酶活力逐渐下降,因此可以确定重组菌株的纤维素酶活最高的培养时间为培养48 h左右,也更进一步表明重组菌株可以将纤维素酶分泌到胞外培养基中。
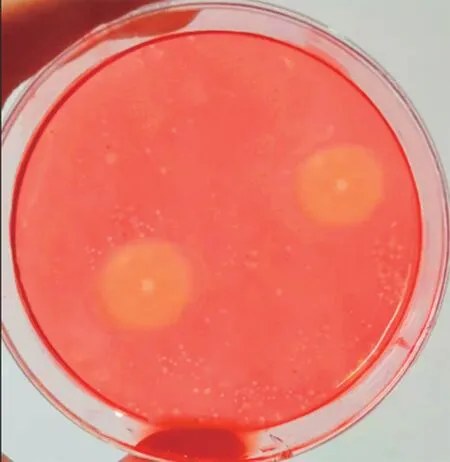
图6 重组菌在CMC 培养基上的水解圈Fig.6 Hydrolysis circle of recombinant bacteria on CMC medium

图7 重组菌酶活力Fig.7 Enzyme activity of recombinant B.subtilis
2.5 重组内切葡聚糖酶的酶学性质分析
温度及pH 值对重组内切葡聚糖酶的影响见图8A,结果表明,此重组酶在20~60℃的条件下,其酶活力随着温度的升高而提高,在60℃的条件下培养时,酶活力达到最大值,但在60℃以上的温度下酶活力有下降的趋势,因为重组酶是由蛋白质构成,而太高的温度则会让蛋白质发生变性,所以重组酶的酶活在过高温度下会发生下降甚至失活的现象。由图8B 可知,当pH 值在5.0~7.0的条件下,酶活力呈现上升的趋势,在pH 值为6.4的条件下,此时是酶活最高的状态。说明重组酶是一种偏酸性的酶,在中性和碱性的条件下酶活会受到大的影响,呈现下降趋势,甚至在强碱的条件下可能会失活,当然在pH 值太小的情况下酶活也会相应地降低。
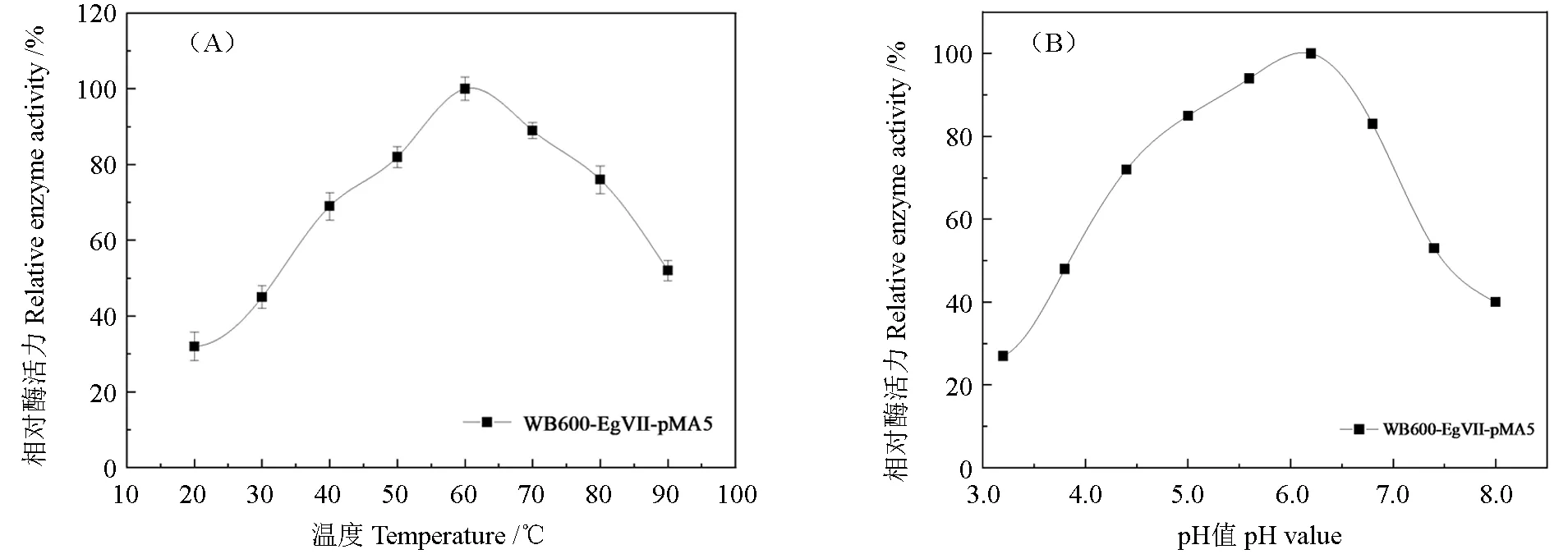
图8 温度对酶活性的影响 (A)、pH 值对酶稳定性的影响 (B)Fig.8 Influences of temperature (A) and pH (B) on enzyme activity
2.6 重组内切葡聚糖酶的温度稳定性及pH 值稳定性
重组酶的热稳定性及pH 稳定性见图9A。以未保温的在4℃下保存的酶样为100%酶活力,重组内切葡聚糖酶在20~50℃时表现出很好的稳定性,重组酶的相对酶活均保持在80%以上,但在50℃之后重组酶的酶活呈现下降的趋势,在90℃下保温30 min 则完全丧失酶活力,表明高温会使重组酶的酶活产生较大的影响;图9B 表示重组酶在pH 值5~8 时酶活比较稳定,pH 值在6 左右时,重组酶的稳定性最好,但在强酸或者强碱条件下,酶活的稳定性则会受到较大影响。
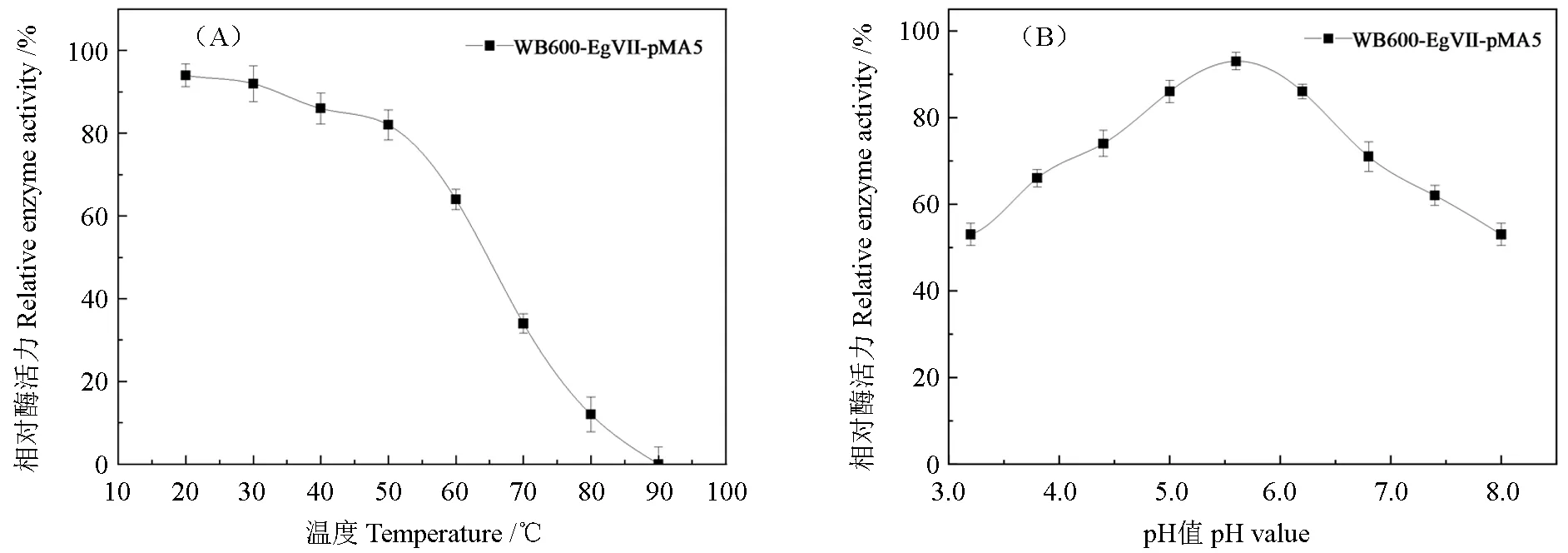
图9 重组酶的热稳定性(A)、重组酶的pH 值稳定性(B)Fig.9 Thermal stability of recombinant enzyme (A) and pH stability of recombinant enzyme (B)
3 结论与讨论
3.1 讨 论
纤维素酶是目前研究发现的糖苷酸类数量巨大且具有利用潜力的酶,纤维素酶中的内切葡聚糖酶是纤维素降解的主要成分,而绿色木霉作为常用分泌纤维素酶系最多的真菌,有重要的应用价值,绿色木霉的基因克隆已有一定的进展[25-27],基于前人研究方法,本试验克隆绿色木霉内切葡聚糖酶基因Eg Ⅶ,并对其生物信息进行分析预测可知与Eg Ⅶ基因序列同源性最高的是瑞士木霉QM6a 的Cel61b基因,相似度大于99%;内切葡聚糖酶Eg Ⅶ属于稳定蛋白,说明其蛋白稳定性不易受到环境中因素的影响,预测可能与其蛋白质构象有关。对于基因表达系统,本试验选择了pMA5 载体和枯草芽孢杆菌作为受体。pMA5 作为双抗载体,更利于筛选,且由于其存在强启动子,所以无需诱导即可进行蛋白表达,陈毅鹏[28]以pMA5 作为载体在枯草芽孢杆菌中成功表达了链丝菌素乙酰基转移酶的基因sat;目前用于内切葡聚糖酶表达的受体大多数为大肠杆菌[29]和酵母菌[30],选用枯草芽孢杆菌作为受体,克服了大肠杆菌只在胞内分泌表达蛋白的缺点,可在培养基中直接分泌蛋白,且安全无致病性,有助于纤维素酶的分离与提取,随着基因工程的不断完善,为了防止枯草芽孢杆菌体内的胞外蛋白酶降解外源蛋白,枯草芽孢杆菌WB600 菌株敲除了6 个胞外蛋白酶基因[31],为外源基因的高效表达奠定了基础。本试验已经完成内切葡聚糖酶Eg Ⅶ克隆及表达,还应在重组酶酶活的提高及重组枯草芽孢杆菌发酵条件的优化方面进一步研究,为日后纤维素酶的应用提供参考。
3.2 结 论
通过RT-PCR 技术成功克隆了绿色木霉内切葡聚糖酶基因Eg Ⅶ,通过生物信息分析可知其编码了249 个氨基酸,预测了其蛋白质二级结构及三级结构,结果表明内切葡聚糖酶Eg Ⅶ蛋白中α-螺旋占到10.84%,延伸链占到26.51%,β-转角占到6.83%,无规则卷曲占到55.82%;构建了重组载体Eg Ⅶ-pMA5,利用热激法成功转入枯草芽孢杆菌WB600 菌株中,筛选出重组菌株进行刚果红染色及DNS 酶活测定,得到较大直径透明圈且DNS 酶活达到22.71U/mL,表明内切葡聚糖酶基因Eg Ⅶ在枯草芽孢杆菌中成功表达;对重组酶酶学性质研究表明,重组内切葡聚糖酶最适的反应温度是60℃、最适的反应pH 值是6.4;且在20~50℃温度范围内,在5.0~8.0pH 值范围内,重组酶酶活有良好的稳定性。
