血清Cys-C、α1-MG 联合检测在早期肝肾综合征诊断中的意义
2022-09-26李运泽彭继承屈茵萍蔡怀阳
叶 亮,李运泽,彭继承,龙 颖,屈茵萍,蔡怀阳
(广西医科大学附属柳州市人民医院消化内科,广西 柳州 545000)
肝肾综合征(hepatorenal syndrome)是有效血容量不足导致肾功损害的一组临床综合征[1]。而肾功能损伤是肝硬化腹水最常见的并发症,也是影响肝硬化腹水转归和预后的重要原因。目前国内外对肝肾综合征是否为肝硬化腹水肾损害的早期病变尚无明确定论,肝肾综合征的诊断主要依赖于血肌酐(serum creatinine,Scr),但既往研究表明[2-4],以肝硬化腹水合并Scr 升高作为诊断肝肾综合征的标准无法早期预测肝肾综合征并及时作出治疗。因此,寻找新的标记物来早期诊断肝肾综合征尤为重要,对患者预后的判断及治疗同样具有十分重要的意义[5]。胱抑素C(cystatin C,Cys-C)及α1-MG 是目前研究较多的肾损伤指标物[6]。本研究主要探讨Cys-C、α1-MG 在肝肾综合征的诊断价值,以期为早期诊断肝肾综合征提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料 收集2018 年3 月-2021 年5 月广西医科大学附属柳州市人民医院收治的肝硬化失代偿患者40 例设为肝硬化失代偿组,肝肾综合征患者40 例设为肝肾综合征组。肝硬化失代偿组男30 例,女10 例;年龄34~75 岁,平均年龄(52.5±9.4)岁;病程6 个月~5 年8 个月,平均病程(49.12±5.32)个月。肝肾综合征组男30 例,女10 例;年龄34~86 岁,平均年龄(54.05±12.8)岁;病程8 个月~6 年1 个月,平均病程(52.68±6.79)个月;两组性别、年龄、病程比较,差异无统计学意义(P>0.05),具有可比性。本研究经广西医科大学附属柳州市人民医院伦理委员会审批批准,患者知情同意并签署知情同意书。
1.2 纳入及排除标准 纳入标准:符合肝硬化失代偿、肝肾综合征诊断标准;临床资料完整。排除标准:腹水、肝细胞癌、继发性肾功能损害者;服用利尿剂、β 受体阻滞及其他影响肾脏血流动力学的药物。
1.3 方法
1.3.1 仪器及材料 α1-MG、Gys-C 采用美国Beckman 公司Array360 全自动特定蛋白分析仪,所用试剂为该公司配套试剂。
1.3.2 操作方法 于入院次日抽取空腹静脉血5 ml,使用普通促凝管保存,运用罗氏全自动生化分析仪测定Cys-C 并记录数值,Array360 全自动特定蛋白分析仪测定α1-MG 并记录数值。
1.4 统计学方法 采用SPSS 24.0 统计学软件对数据进行分析。计量资料以(±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验。使用MedCalc v19.6.4 统计软件评价各实验指标对肝肾综合征的早期诊断价值,计算ROC 曲线下面积AUC、敏感性、特异度、约登指数(YI)、阳性预测值(PPV)、阴性预测值(NPV)、阳性似然比(+LR)、阴性似然比(-LR),以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组Cys-C、α1-MG 比较 肝肾综合征组Cys-C、α1-MG 水平高于肝硬化失代偿组,差异有统计学意义(P<0.05),见表1。
表1 两组Cys-C、α1-MG 比较(±s,mg/L)
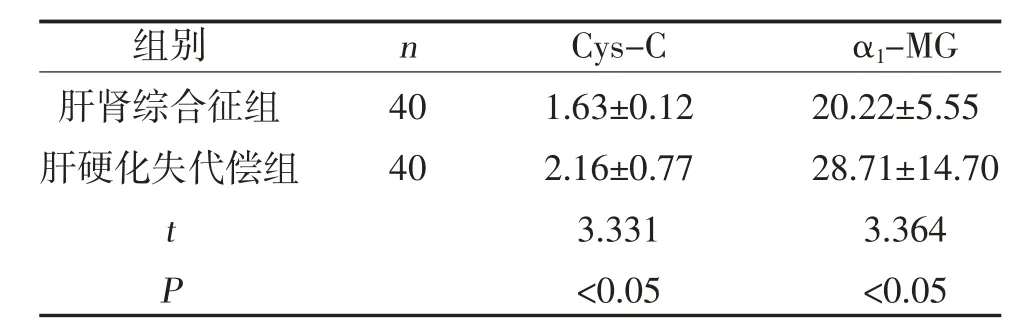
表1 两组Cys-C、α1-MG 比较(±s,mg/L)
2.2 Cys-C、α1-MG 诊断肝肾综合征的ROC 分析以临床诊断为参考标准,ROC 曲线分析显示,Cys-C+α1-MG 诊断肝肾综合征的AUC 高于单独Cys-C、α1-MG 诊断,见表2、图1。
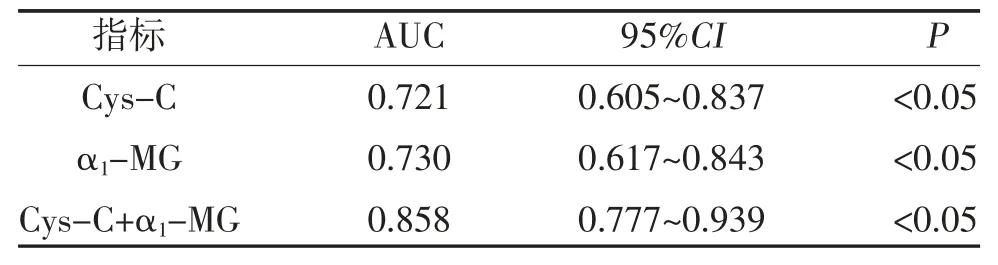
表2 Cys-C、α1-MG 诊断肝肾综合征的ROC 分析
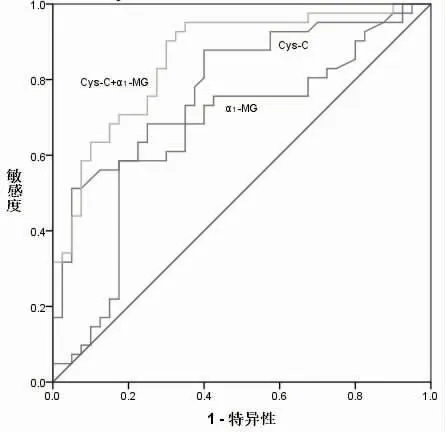
图1 Cys-C、α1-MG 单独及联合诊断肝肾综合征的ROC图
2.3 Cys-C、α1-MG 单独及联合应用在诊断肝肾综合征的阈值及精度 Cys-C+α1-MG 联合诊断肝肾综合征的敏感性及阴性预测值高于单独Cys-C、α1-MG诊断,见表3。
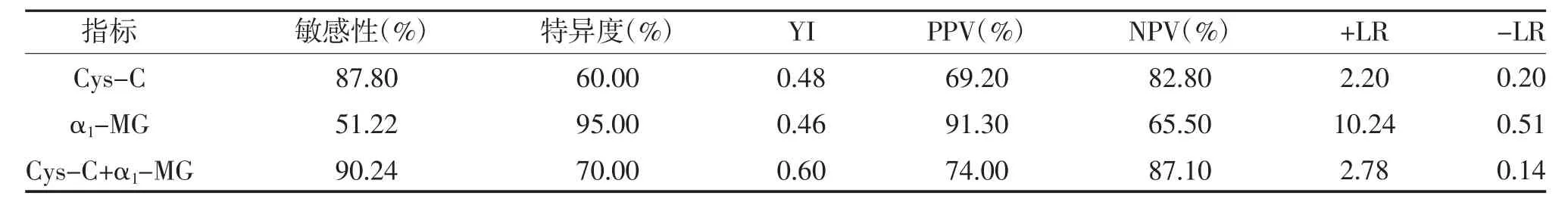
表3 Cys-C、α1-MG 单独及联合应用在诊断肝肾综合征的阈值及精度比较
3 讨论
肝肾综合征对治疗的反应较差,如扩容治疗,即使使用特利加压素联合人白蛋白及血液透析治疗,也无法很好的改善患者预后[7-9]。而肝移植虽可治愈肝肾综合征,但其费用高、肝源不足,且移植远期效果不佳,无法作为临床上常规的治疗手段[10,11]。不仅如此,与无肝肾综合征的移植患者对比,合并肝肾综合征患者术后存生存率较低,且并发症风险也更高[12]。因此,肝肾综合征的早期诊断尤为重要。Cys-C在所有细胞核的细胞中产生,是一种半胱氨酸蛋白酶抑制剂,分子量低且为碱性非糖化蛋白质,无任何组织特异性,其血液浓度不受性别、年龄、炎症状态等外在因素干扰,且Cys-C 不与血浆蛋白结合,循环中仅被肾小球过滤清除,因此被当作肾功能受损的早期敏感性指标之一[13,14]。α1-MG 是一种低分子量蛋白质,由淋巴细胞和肝脏产生,通过肾小球滤过,并被肾小管上皮重吸收分解,因此其可反映肾小球滤过功能损害,是判断肾小管功能障碍的敏感指标[15,16]。
本研究结果显示,肝肾综合征组Cys-C、α1-MG水平高于肝硬化失代偿组,差异有统计学意义(P<0.05),考虑肝硬化失代偿期在无腹水情况下无肾功能损伤,而在出现腹水后出现肾小管功能损伤,因此肝肾综合征患者血液中Cys-C、α1-MG 升高,可早期反映肝肾综合征,与既往研究基本相符[17,18]。对Cys-C、α1-MG 两个指标进行ROC 曲线分析显示,Cys-C、α1-MG 诊断肝肾综合征的AUC 分别为0.721、0.730,表明Cys-C、α1-MG 对肝肾综合征具有诊断价值。除此之外,Cys-C、α1-MG 在慢性肾小球肾炎同样具有较好的诊断价值[19,20]。研究证实[21,22],Cys-C水平在肝肾综合征早期升高较血肌酐异常早,而在肝肾综合征恢复期,其水平降低亦早于血肌酐,表明Cys-C 不仅可作为肝肾综合征的早期监测指标,也可作为肝肾综合征治疗有效的早期监测指标。本研究为提高对肝肾综合征诊断的敏感性及特异度,建立了Cys-C、α1-MG 联合检测的诊断模型并计算出不同联合指标的AUC,通过对比发现Cys-C、α1-MG联合诊断模型的AUC 为0.858,具有较高敏感性(90.24%)、特异度(70.00%)。因此,联合预测模型在诊断肝肾综合征更有优势。
综上所述,Cys-C、α1-MG 联合诊断肝肾综合征的预测价值高于单一指标,可作为肝肾综合征早期诊断的重要指标之一。然而本研究存在不足之处,如纳入样本量较少且为单中心研究,存在样本选择性偏倚,可能对结果的可靠性有影响,因此需要大样本、跨地区的随机对照试验来证实这一结果。
