全内镜下腰椎椎体间融合术和可扩张通道下微创经椎间孔腰椎椎体间融合术的前瞻性对照研究
2022-09-26王金昌李振宙曹峥朱加亮赵宏亮侯树勋
1994 年 Foley 等
首次应用可扩张通道在显微内镜下行椎间盘摘除术,2002 年他们在显微内镜椎间盘摘除术的基础上,联合经皮椎弓根螺钉系统,对 12 例实施了可扩张通道下腰椎椎体间融合术
,在随后的回顾性研究中发现,其技术可有效解除神经压迫,减少术中出血量,缩短住院时间,相对于开放腰椎椎体间融合术有潜在优势
。目前,大量的对照性研究已证实,对 Ⅱ 度及以下的退变性腰椎滑脱、腰椎不稳、峡部裂、盘源性腰痛和医源性损伤所致椎体间不稳的患者,实施可扩张通道下微创经椎间孔腰椎椎体间融合术 ( minimally invasive transformational lumbar interbody fusion,MIS-TLIF ),能获得与开放手术相似的临床效果和融合率
。全内镜下腰椎椎体间融合术 ( full endoscopic lumbar interbody fusion,FE-LIF ) 是另外一种微创的腰椎椎体间融合技术,最早由 Leu 等
在 1996 年报道。FE-LIF 视野清晰,可确保神经充分减压,彻底止血,相对可扩张通道下的微创腰椎椎体间融合术,可以避免扩张器对椎旁肌肉的挤压,减少腰椎后外侧结构的破坏,理论上更微创。但 2013 年 Jacquot等
对 57 例患者实施了经皮内镜下腰椎椎体间融合术,总并发症发生率高达 36%,考虑到如此高的并发症发生率,如无确定性技术改进,Jacquot 不推荐此技术。随着 Yeung
、Hoogland 等
和 Ruetten等
对脊椎内镜设备的改进,已有大量研究进行了经椎间孔入路或椎板间隙入路 FE-LIF,并获得了有效的神经减压和相对较高的椎体间融合率
,但是临床上缺乏 FE-LIF 与可扩张通道下 MIS-TLIF的前瞻性对照研究。为了进一步研究 FE-LIF 的安全性和有效性,笔者开展了 FE-LIF 与可扩张通道下MIS-TLIF 的前瞻性对照研究。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 伴有或不伴有腰椎间盘突出、腰椎管狭窄的腰椎节段性不稳定者;( 2 ) Ⅰ 度或 Ⅱ 度退行性或峡部裂型腰椎滑脱症者;( 3 ) 复发性腰椎间盘突出症者;( 4 ) 椎间盘纤维环撕裂、Schmorl 结节或椎体终板炎等导致的盘源性腰痛者;( 5 ) 腰椎椎弓峡部裂者;( 6 ) 腰椎手术破坏稳定结构可能导致术后腰椎不稳的医源性腰椎不稳定者。
2. 排除标准:( 1 ) Ⅲ 度及以上退变性或峡部裂型腰椎滑脱症者;( 2 ) 手术区域皮肤或深部组织感染者;( 3 ) 凝血功能障碍,经纠正后仍未达到手术标准者;( 4 ) 心肺功能不足,无法耐受全身麻醉者;( 5 ) 未取得患者及家属知情同意。
二、一般资料
2018 年 8 月至 2020 年 8 月,我科收治 100 例符合纳入标准的单节段腰椎退变性疾病患者。非随机化采用 FE-LIF ( FE-LIF 组,
= 50 ) 或 MIS-TLIF( MIS-TLIF 组,
= 50 例 ) 治疗。共 70 例 ( FE-LIF组 32 例,MIS-TLIF 组 38 例 ) 获得完整随访资料( 表 1 ),两组患者在性别、年龄、病变节段分布、术前融合原因以及术前神经致压因素等方面差异无统计学意义 (
> 0.05 )。本研究获得解放军总医院第四医学中心伦理委员会批准及授权。赞成对手术方法、手术知情同意书内容、手术机制、预期疗效、潜在风险及副损伤等内容的描述。

三、手术器械
FE-LIF 组:手术使用工作通道为 7.1 mm 的大通道全内镜手术系统 Lusta ( Spinendos,德国 )、LiZZ
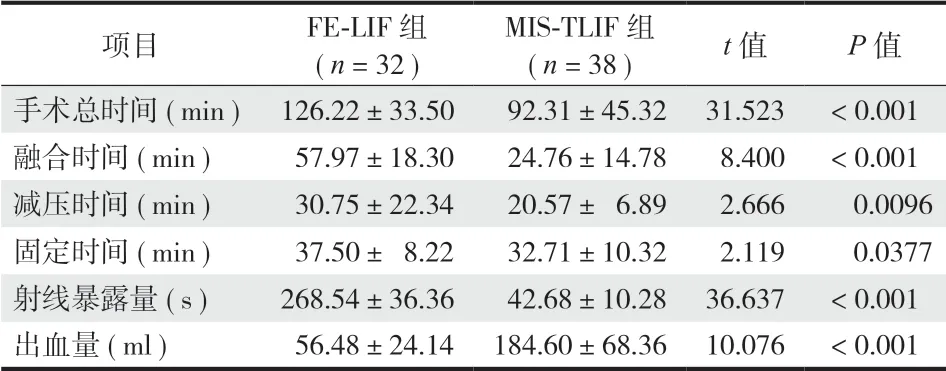
安全环锯系统 ( 珠海康弘医疗科技公司,中国 ) 及高频双极射频系统 ( Elliquence LLC,美国 )。前方可撑开圆柱形融合器 ( LiFus 系统,北京富乐科技有限公司 ) 是一种钛合金材料制造的椎间融合器,撑开前呈圆柱形 ( 图 1a ),前方撑开高度后可增加 2.5~3.0 mm ( 图 1b ),融合器尾端有植骨通道,在融合器完成撑开后可进一步向融合器内及周围打压植骨 ( 图 1c ),植骨完成后有尾帽封闭植骨通道口,即使使用人重组骨形态蛋白 2 ( recombinant human bone morphogenetic protein-2,rh-BMP-2 ) 等生物促成骨材料也可以防止其向后方椎管内渗漏( 图 1d )。FE-LIF 常规采用自体减压骨、同种异体骨( 山西奥瑞,中国 ) 及 rh-BMP-2 ( 骨优导,杭州九源基因工程有限公司 ) 进行混合植骨。
MIS-TLIF 组:手术使用可扩张通道系统 Pipeline( Depuy,美国 ),融合器采用不可膨胀 PEEK 融合器Capstone ( Medtronic,美国 )。
旅游管理专业是在了解旅游业态及基本知识的基础上,通过学习各种管理知识,以便在旅行社、景区、酒店、会展等行业的经营管理中进行应用的一门实践性非常强的专业。这要求学生在大学期间必须具备相关的理论知识与实践技能,熟悉企业内部经营、管理与服务,能够在毕业之后迅速融入到企业生产经营中去。
大跨度钢结构玻璃采光顶施工技术应用于本工程,1#~4#楼与6#楼之间为商业步行街,商业步行街全部为钢结构玻璃采光顶,玻璃采光顶有椭圆型和圆弧型两种组成,投影面积约为1500m2。该玻璃顶短跨为18m、24m,距地面高度为20m。采用此施工技术玻璃采光顶造型美观、施工进度快、周期短、现场焊接量减少近一半;可以减少施工现场阶段对构件的测控工作,减少对焊缝的检测量,在加工厂焊接,可提高焊接质量及精度,是值得推广的一项施工技术。本钢结构玻璃采光顶:整体材料采用矩形管,架体安装采用分条分块吊装的方式。
四、手术方法
3. 术后第 2 天复查 X 线片评估内植物位置,术后 3 个月复查腰椎 MRI 和 ( 或 ) CT 评估脱出物摘除及神经减压的彻底性。术后 6 个月及 1 年复查腰椎CT 及二维重建评估腰椎椎体间融合情况。腰椎椎体间融合评估采用 Mannion 等
提出的分级标准:完全融合指骨小梁贯通椎间隙,并与骨性终板再塑型;部分融合指骨小梁从骨性终板向椎间隙延伸,但未贯通椎间隙;不融合指椎间隙未见从骨性终板长入骨小梁。如果术后 6 个月随访时未获得完全融合结果,术后 1 年时需再次复查 CT。
外墙保温性能的高低,将会直接影响旧工业建筑改造后日常运营中的能耗,利用原有厚砖墙的畜热性能在此基础上采取修复、增加保温层等措施进行外墙的改造设计。一般情况下,旧工业建筑的外窗气密性和保温性能差,应进行节能计算采取相应的改造更换措施,将原单层平板玻璃更换位为中空低辐射节能玻璃。屋顶保温性能设计。采取更新原来保温层的办法进行改造设计。
( 2 ) 经椎板间隙入路 FE-LIF:俯卧位全身麻醉下施术。按 Ruetten 等
介绍的经单侧椎板间隙入路双侧椎管减压的技术进行神经背侧减压。同侧关节突关节需大部分切除,仅保留上关节突外侧壁以保护出口神经根。将内镜工作鞘转移至椎间孔,在上关节突外侧壁和走行神经根之间,旋转工作鞘,以舌状叶保护走行神经根,将椎间孔内的后纤维环隔离,以镜下纤维环切开刀切开纤维环,摘除椎间盘内髓核组织;透视下使用终板铰刀及终板刮刀初步处理相邻椎体软骨终板;使用内镜下终板铰刀及终板刮刀精细化处理植骨床,获得高质量的植骨床。先向椎间隙打压植骨,植骨材料包括手术部位减压骨、同种异体骨及 rh-BMP-2;然后将 LiFus融合器经工作通道置入椎间隙,X 线透视证实位置合适后进行融合器撑开;经融合器植骨通道向融合器内打压植骨;植骨完毕后以螺母封闭植骨通道,防止植骨材料渗漏入后方椎管。全内镜下探查融合器与上下终板的位置关系及贴合程度;探查融合器尾部与走行神经根之间的位置关系,确保走行神经根无任何压迫。最后导丝引导下植入双侧经皮腰椎弓根螺钉系统辅助固定。
双端预制光缆指光缆的两端均采用预制接口,现场施工免熔接,可实现光缆连接“即插即用”,但由于双端预制光缆长度现场无法调节,因此对于光缆长度的精确度要求很高。对于双端均不具备良好熔接环境的预制光缆,建议采用双端预制光缆。
2. 经 Wiltse 肌间隙入路可扩张通道下 MIS-TLIF手术方法:透视定位责任节段,取双侧旁中央切口,经多裂肌和最长肌肌间隙 ( Wiltse 入路 ) 显露关节突关节及上下方椎弓根螺钉进针点,制备椎弓根螺钉针道,插入导丝,透视证实位置合适。置入可扩张手术通道,对严重椎管狭窄者可以采用单侧开窗双侧减压技术或双侧开窗减压技术进行椎管背侧减压。切除症状侧关节突关节、显露 Kambin 三角,切除椎间盘及软骨终板,制备好植骨床,将手术部位减压骨植入椎间隙,并将充填手术部位减压骨的不可膨胀 PEEK 融合器植入椎间隙。最后沿导丝植入椎弓根螺钉系统并固定。
五、疗效评价
需背侧减压者,更适合选择经椎板间隙入路进行手术。经皮内镜下经椎板间隙入路神经减压术,最早由 Gun 等
报道,但术后有 11 例 ( 16.7% ) 出现了神经根受损症状。2004 年 Ruetten 等
发明了全脊柱内镜系统,在全内镜监视下经椎板间隙入路进行神经减压,提高了手术安全性。大通道全内镜系统允许使用环锯和骨凿等器械,在保留上关节突外侧壁的基础上切除下椎板和部分关节突,扩大椎板间隙,不仅可对椎管背侧和双侧椎间孔进行减压,而且经此通道可进行 FE
LIF
。目前,FE
LIF 可经椎间孔或椎板间隙入路进行。FE
LIF 入路选择要充分考虑神经减压的需求,对于不需要进行神经减压或者神经压迫主要来自腹侧的患者,可选择经椎间孔入路,对于神经压迫主要来自背侧黄韧带肥厚及关节突关节增生者,可选择经椎板间隙入路
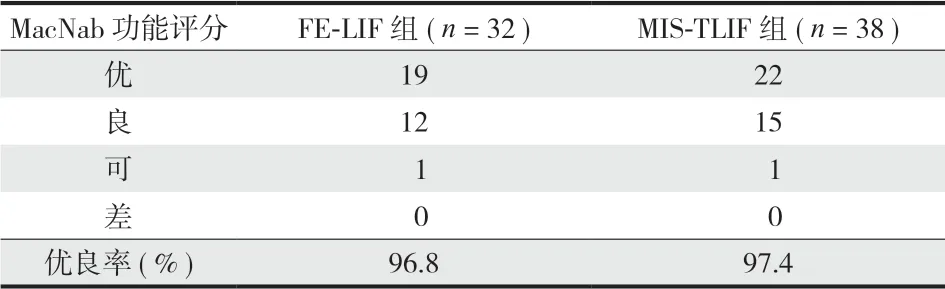
。笔者通过术后复查两组患者的腰椎 MRI,发现所有患者的神经致压物全部清除,术后所有患者腿部及腰部疼痛较术前明显缓解,双下肢的肌力和感觉明显好转,ODI 评分明显改善,全内镜下神经减压可达到与可扩张通道下神经加压相似的效果。根据MacNab 标准,FE
LIF 组优良率 96.8%,MIS
TLIF 组优良率 97.4%,两者之间差异无统计学意义。有研究选择经椎板间隙入路进行神经减压,经椎间孔入路进行椎体间融合,也取得了良好的临床效果
。但是,通过现有的技术完全可以经单一入路完成腰椎椎体间融合术,避免不必要的损伤。
2. 随访患者术后 1 周、3 个月、6 个月、1 年时的腰痛及腿痛的疼痛视觉模拟评分 ( visual analogue scale,VAS ),100 分制;随访患者术后 3 个月、6 个月、1 年时的腰椎 Oswestry 功能障碍指数( oswestry disability index,ODI )。术后 1 年采用MacNab 评估患者腰椎功能恢复情况,评估神经根功能恢复情况。
1. FE-LIF 手术方法:根据神经受压部位,选择不同手术入路。对于不需要进行神经减压或者神经压迫主要来自腹侧的病例,选择经椎间孔入路手术;对于神经压迫主要来自关节突关节背侧增生及肥厚黄韧带者,选择经椎板间隙入路手术
。
( 1 ) 经椎间孔入路 FE-LIF:俯卧位全身麻醉下施术。按 Yeung
和 Hoogland 等
的方法定位经椎间孔入路手术切口;按 Li 等
的方法使用安全环锯系统在透视监视下切除上关节突,全内镜下充分暴露 Kambin 三角,旋转内镜工作鞘,保护出口神经根。全内镜下切除椎间盘内髓核、软骨终板,准备好植骨床,椎间隙打压植骨,植入 LiFus 融合器并撑开,经融合器植骨通道继续打压植骨,用尾帽封闭植骨通道。下压内镜工作鞘,全内镜下切除硬膜囊及神经根腹侧致压物。最后导丝引导下植入双侧经皮椎弓根螺钉系统辅助固定。
六、统计学处理
他望着眼前的巨石,心里一阵发毛,又忍不住将耳朵附到其上,细细分辨那个响声。于是,他更清楚地听到了那个声音。它像是有什么尖利的金属,在坚硬的岩石上敲打刮划,频率忽急忽缓,不知节奏,偶尔会有石块碎裂的声音传出,应是有着极大的力量。
结 果
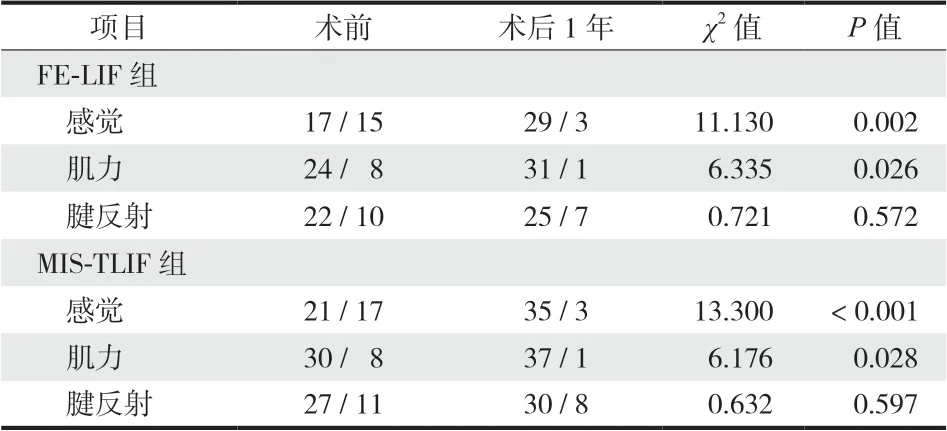
所有手术均顺利完成,无术中更改手术方式发生。术中无硬膜撕裂、神经损伤并发症发生,术后无感染、脑脊液漏、神经根功能损伤加重等并发症发生。FE-LIF 组术中总手术时间、减压、固定及融合等关键步骤耗费时间均明显长于 MIS-TLIF 组;FE-LIF 组射线暴露量明显高于 MIS-TLIF 组;但FE-LIF 组术中出血量明显少于 MIS-TLIF 组,差异均有统计学意义 (
< 0.05 ) ( 表 2 )。两组患者术后腰痛 VAS 评分、腿痛 VAS 评分及 ODI 评分较术前均明显改善,差异有统计学意义 (
< 0.01 ) ( 表 3 );术后 1 年随访时,两组患者受累神经根支配区感觉较术前明显恢复 (
< 0.05 );但腱反射功能无明显恢复 (
> 0.05 ) ( 表 4 )。术后 1 年随访 MacNab 评估结果,两组患者差异无统计学意义 (
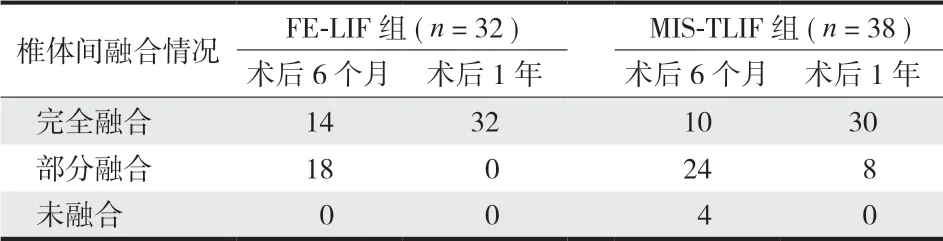
> 0.05 ) ( 表 5 ),FE-LIF 组中有 1 例椎间盘突出症术后出现受累神经根神经病理性疼痛残留,经药物治疗仍不能满意缓解,评定为可;MIS-TLIF 组中 1 例盘源性腰痛术后疼痛缓解不满意,评定为可。所有患者术后 3 个月复查腰椎 MRI 均显示神经减压充分。按照 Mannion的腰椎体间融合标准,术后 6 个月及 1 年随访 CT,椎体间融合结果显示,FE-LIF 组椎体间融合率明显优于 MIS-TLIF 组,差异有统计学意义 (
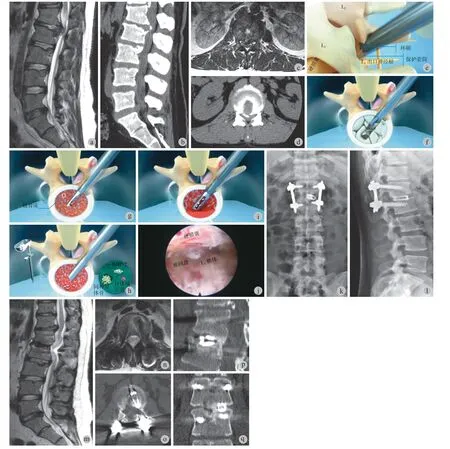
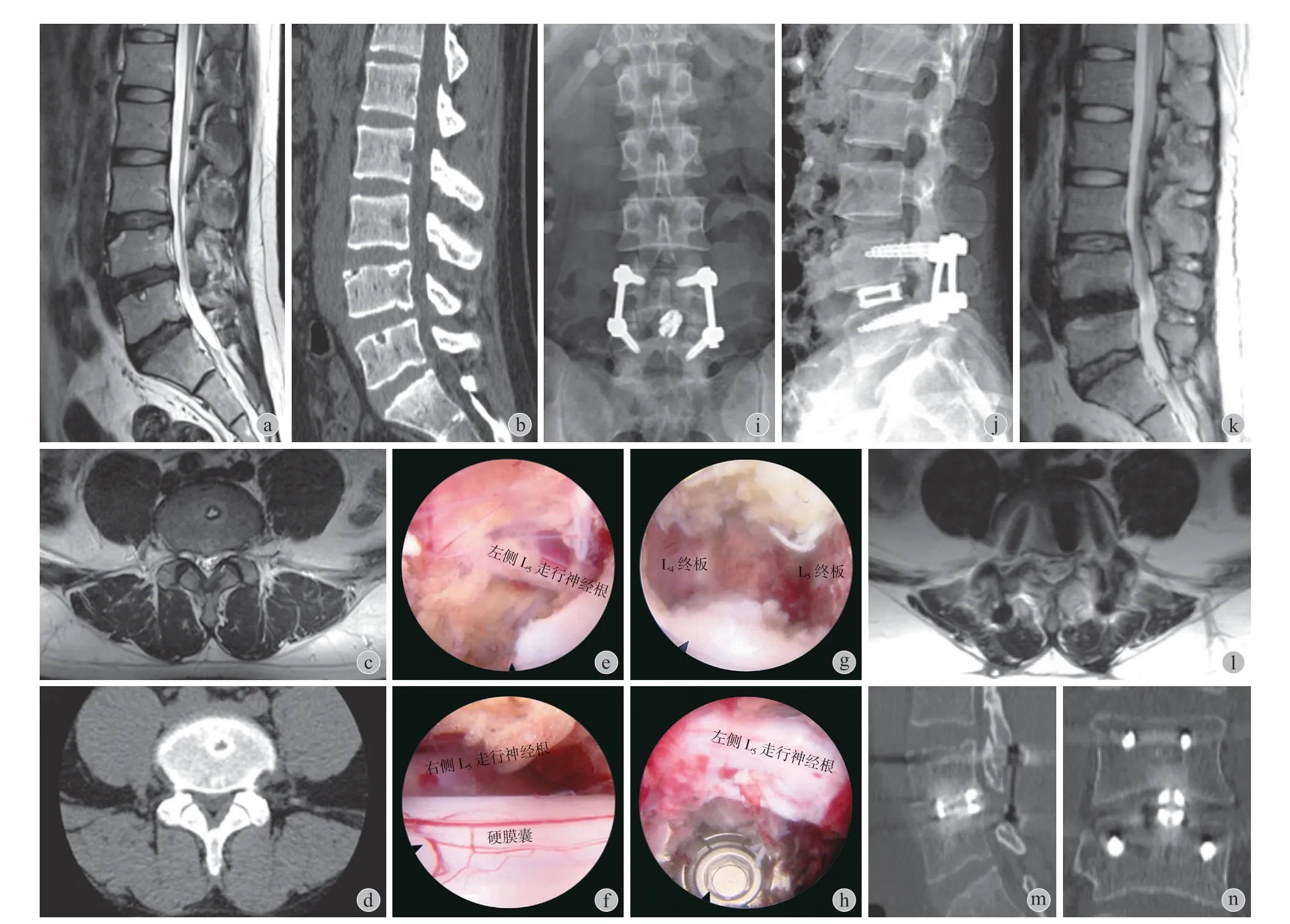
< 0.01 )( 表 6 )。典型病例见图 2~3。

讨 论
1972 年 Kambin 等
提出了安全三角的概念,即由下位椎体的上缘、硬膜囊或行走神经根的外缘和出口神经根内缘组成的三角形区域,是手术操作相对安全的区域,也是经皮或全内镜经椎间孔入路神经减压、椎体融合的通道。但是,腰椎退变引起的椎间盘塌陷、上下关节突关节周围的骨性增生可致椎间孔狭窄,缩小了 Kambin 三角的可利用空间,直接经 Kambin 三角进行神经减压和椎体融合,造成神经损伤的风险较高
。为了充分暴露 Kambin 三角,提高手术安全性,Hoogland 等
发明了环锯系统,在透视下通过切除上关节突扩大操作空间。但Lewandrowski 等
按照 Hoogland 椎间孔成形的方法对 48 例实施了 FE-LIF,结果 29 例 ( 60.4% ) 出现了一过性的神经根刺激症状;另外 Morgenstern 等
采用同样的椎间孔成形方法对 51 例实施了全内镜下经椎间孔入路腰椎椎体间融合术,12 例 ( 22% ) 发生了暂时性感觉障碍。除了神经减压和椎体间融合过程中可能造成神经损伤外,椎间孔成形过程也可能致神经根损伤。为了降低椎间孔成形时神经根损伤的风险,笔者自主设计了安全环锯系统,通过一个远端鸭嘴状的保护套筒将成形部位和神经根隔离开,X 线透视下可安全地切除上关节突,降低了神经根损伤的风险
。另外,大通道的全脊椎内镜系统可实现全程可视化的椎间孔扩大成形、神经减压和椎体间融合操作,有效地降低了神经根损伤的风险
。
采用 SPSS 26.0 软件对数据进行收集、整理及统计学分析。术前不同手术组患者一般资料比较采用
检验 ( 定性资料 ) 和独立样本
检验 ( 定量资料 )。各手术组术前及术后不同时间点的腰痛 VAS评分、腿痛 VAS 评分及 ODI 评分采用单因素方差分析 ( ANOVA ),不同时间点之间的分析采用 LSD 检验;术前及术后 1 年时神经根功能的相关定性指标对比采用
检验。组间术中定量资料对比采用
检验;组间不同时间点腰痛 VAS 评分、腿痛 VAS 评分及 ODI 评分比较采用
检验;组间术后椎体间融合情况及 MacNab 比较采用 Wilcoxon 等级资料比较。
< 0.05 为差异有统计学意义。
全内镜下经椎间孔入路可进行椎间孔外、椎间孔及椎管内的绝大多数腰椎间盘突出的摘除和椎间孔及侧隐窝狭窄等部位的减压,对于 L
~S
节段椎间盘突出以及各腰椎节段严重的中央椎管狭窄症
1. 记录两组患者术中射线暴露量、出血量、手术总时间及不同手术操作步骤耗费时间等指标。
虽然,有研究曾进行了多节段可扩张通道下的MIS
TLIF
,但大多数可扩张通道下 MIS
TLIF 的研究将多节段、椎体滑脱 Ⅲ 度及以上和腰椎后凸或侧弯畸形的患者排除在外
。FE
LIF 的适应证与可扩张通道下腰椎椎体间融合的适应证相似。在开展该技术早期,为了确保患者的安全,应选择单节段腰椎病变患者,随着技术经验的积累,可进行较为复杂的腰椎椎体间融合术。
目前,有关 FE
LIF 的椎体间融合率结果报道不一,融合率在 56.9%~100% 之间,这些研究在评估腰椎椎体间融合情况时,选择了不同时间点和不同的方法,这是造成结果差异的主要因素
。大多数研究在术后 6 个月或 1 年时通过动态的腰椎 X 线检查间接地观察腰椎椎体间融合情况,未提供椎体间融合的直接证据。Mannion等
通过 CT 平扫观察椎体间融合情况,相对动态的 X 线检查更为可靠。本研究使用 Mannion 等提出的腰椎椎体间融合分级标准,通过术后 6 个月、1 年时对患者进行 CT 随访发现:在术后 6 个月时,FE
LIF 组获得 100% 椎体间融合,完全融合率43.8%,MIS
TLIF 组获得 89.5% 椎体间融合,完全融合率 36.8%,有 4 例未融合;在术后 1 年时,FE
LIF组均获得完全融合,MIS
TLIF 组有 30 例 ( 78.9% )获得椎体间完全融合,其中有 8 例 ( 21.1% ) 获得部分融合,FE
LIF 组椎体间融合率明显优于 MIS
TLIF组。影响椎体间融合率的因素很多,本研究中 FE
LIF组椎体间融合效率较高,可能与以下原因有关。首先在 FE
LIF 术中使用了 rh
BMP
2,术中将 rh
BMP
2和自体减压骨、同种异体骨混合后,打压植入椎体间前半部分,在植入前方可撑开的圆柱形融合器后,进一步向融合器内部通道进行植骨。BMP 作为自体骨的替代植骨材料,能诱导间充质细胞转位为成骨细胞,促进骨的生长,已广泛应用于开放和微创的腰椎椎体间融合术。大多数研究将 BMP 和同种异体骨或人工骨混合后,进行椎体间充分的打压植骨,术后 1 年腰椎椎体间可获得 99.5%~100% 融合
。有研究发现,在使用了 BMP 的侧后路微创腰椎椎体间融合的患者中,有部分出现了神经炎和异位骨化
。为了预防 BMP 相关的并发症,建议在植骨时尽量将其植入到椎间隙前半部分,后方使用凝胶海绵或融合器进行阻隔,防止 BMP 向椎管和椎间孔周围渗漏。有研究将自体髂骨作为植骨材料进行 FE
LIF,虽然提高了椎体间融合率,但造成了取骨部位新的创伤
。其次,充分的植骨床准备可为椎体间融合提供有利条件。大通道的全内镜系统,允许使用终板铰刀及终板刮刀,可在全内镜下或全内镜监视下进行椎板处理,直至观察到漏出渗血骨面,同时应避免终板过度处理,防止融合器下沉
。最后,本研究中 FE
LIF 使用了可膨胀的融合器,这是可能造成两者在融合率方面差异的另一个原因。目前,虽然没有研究证实可膨胀椎体间融合器相对不可膨胀融合器在提高融合率方面有优势
,但可扩张的融合器具有“小体积植入,大体积撑开”的特性,可降低融合器植入过程可能造成的神经损伤风险,撑开后可进一步加强椎体间稳定性
。本研究使用的钛合金前端可撑开圆柱形融合器,植入后前端可撑开 2.5~3.0 mm,与上下终板紧密接触,提供即时支撑作用,另外,圆柱体外形与内镜通道相契合,能直接经内镜通道植入,可完全避免植入过程可能造成的神经损伤。为了增加椎体间稳定性,提高椎体间融合率,在两组患者中均联合使用了双侧椎弓根螺钉系统。经皮椎弓根螺钉系统专门为可扩张通道下的腰椎椎体间融合设计,可经皮植入,符合腰椎微创理念,已经成为腰椎微创融合手术最受欢迎的辅助固定方法。虽然有研究采用关节突螺钉或棘突间融合器进行辅助固定,但两者的适应证有限
,另外有部分研究未采用辅助固定,发现腰椎椎体间融合率较低,融合器发生移位的风险较高
。
全内镜和可扩张通道下腰椎椎体间融合,最常见的并发症有神经根损伤、硬脊膜撕裂、融合器下沉、移位和伤口感染等,在本研究中,两组患者均未出现上述并发症。有对照性研究发现,相比可扩张通道下腰椎椎体间融合术,FE
LIF 并没有增加上述并发症发生风险
。本研究发现,与可扩张通道下 MIS
TLIF 相比 FE
LIF 术中出血量更少,但是,FE
LIF 组术中总的手术时间和减压、固定及融合等关键步骤耗费时间均明显长于 MIS
TLIF 组,同时放射量较大,这是 FE
LIF 的不足之处。虽然全脊椎内镜系统较初期已获得了很大的改进,但相对开放或可扩张通达下的神经减压、终板处理和融合过程所使用的器械微型低效,这是造成 FE
LIF 耗时较多的主要原因。另外,全内镜腰椎椎体间融合的学习曲线较长,这是造成两者手术耗时差异的另一个原因。随着大通道脊椎内镜的使用,尽管已实现椎间孔成形和神经减压、终板处理的内镜下操作,但还是无法避免术中使用 X 线透视进行切口定位和检查融合器与椎弓根螺钉植入的位置。
2)大力推行“项目驱动、案例教学、1+2+3课程改革”等教学模式,实施“1+2+3”校企深度融合课程改革,即在专业课程中遴选8-10门课程,每一门课程至少两位教师(在校教师和企业资深工程师)协作完成教学,至少有三种以上的考核方式(项目答辩、小组讨论、期中测试、期末测试、实验考核等)完成课程考核。
本研究属于前瞻性的非随机对照研究,通过短期的随访研究发现 FE
LIF 可获得可扩张通道下MIS
TLIF 相似的临床效果,而且在融合效率上,前者要优于后者,但本研究随访时间较短,最短时间为1 年,远期临床效果需要更长时间的随访研究。
FE
LIF 是安全、有效的微创融合技术,临床疗效等同于 MIS
TLIF,但手术时间延长、射线暴露量增多。rh
BMP
2 的使用可以明显提高椎体间融合率、缩短椎体间融合时间。
[1] Foley K. Microendoscopic discectomy[J]. Tech Neurosurg,1997, 3(4):301-307.
[2] Foley KT, Holly LT, Schwender JD. Minimally invasive lumbar fusion[J]. Spine, 2003, 28(Suppl 15):S26-S35. DOI:10.1097/01.BRS.0000076895.52418.5E.
[3] Schwender JD, Holly LT, Rouben DP, et al. Minimally invasive
transforaminal lumbar interbody fusion (TLIF): technical feasibility and initial results[J]. J Spinal Disord Tech, 2005,18(Suppl):S1-S6. DOI: 10.1097/01.bsd.0000132291.50455.d0.
[4] Peng CW, Yue WM, Poh SY, et al. Clinical and radiological outcomes of minimally invasive versus open transforaminal lumbar interbody fusion[J]. Spine, 2009, 34(13):1385-1389.DOI: 10.1097/BRS.0b013e3181a4e3be.
[5] Gu G, Zhang H, Fan G, et al. Comparison of minimally invasive versus open transforaminal lumbar interbody fusion in two-level degenerative lumbar disease[J]. Int Orthop, 2014,38(4):817-824. DOI: 10.1007/s00264-013-2169-x.
[6] Zhao J, Zhang S, Li X, et al. Comparison of minimally invasive and open transforaminal lumbar interbody fusion for lumbar disc herniation: a retrospective cohort study[J]. Med Sci Monit,2018, 24:8693-8698. DOI: 10.12659/MSM.912808.
[7] Le H, Anderson R, Phan E, et al. Clinical and radiographic comparison between open versus minimally invasive transforaminal lumbar interbody fusion with bilateral facetectomies[J]. Global Spine J, 2021, 11(6):903-910. DOI:10.1177/2192568220932879.
[8] Qin R, Wu T, Liu H, et al. Minimally invasive versus traditional open transforaminal lumbar interbody fusion for the treatment of low-grade degenerative spondylolisthesis: a retrospective study[J]. Sci Rep, 2020, 10(1):21851. DOI: 10.1038/s41598-020-78984-x.
[9] Kim C, Cohen DS, Smith MD, et al. Two-year clinical and radiographic outcomes of expandable interbody spacers following minimally invasive transforaminal lumbar interbody fusion: a prospective study[J]. Int J Spine Surg, 2020,14(4):518-526. DOI: 10.14444/7068.
[10] Leu FH, Hauser RK, Schreiber A. Lumbar percutaneous endoscopic interbody fusion[J]. Clin Orthop Relat Res, 1997,337:58-63. DOI: 10.1097/00003086-199704000-00008.
[11] Jacquot F, Gastambide D. Percutaneous endoscopic transforaminal lumbar interbody fusion: is it worth it[J]?Int Orthop, 2013, 37(8):1507-1510. DOI: 10.1007/s00264-013-1905-6.
[12] Yeung AT. Minimally invasive disc surgery with the yeung endoscopic spine system (YESS)[J]. Surg Technol Int, 1999,8:267-277.
[13] Hoogland T, Schubert M, Miklitz B, et al. Transforaminal posterolateral endoscopic discectomy with or without the combination of a low-dose chymopapain: a prospective randomized study in 280 consecutive cases[J]. Spine, 2006,31(24):E890-E897. DOI: 10.1097/01.brs.0000245955.22358.3a.
[14] Ruetten S, Komp M, Godolias G. A new full-endoscopic technique for the interlaminar operation of lumbar disc herniations using 6-mm endoscopes: prospective 2-year results of 331 patients[J]. Minim Invasive Neurosurg, 2006, 49(2):80-87. DOI: 10.1055/s-2006-932172.
[15] Ruetten S, Komp M, Merk H, et al. Use of newly developed instruments and endoscopes: full-endoscopic resection of lumbar disc herniations via the interlaminar and lateral transforaminal approach[J]. J Neurosurg Spine, 2007, 6(6):521-530. DOI: 10.3171/spi.2007.6.6.2.
[16] Ruetten S, Komp M, Merk H, et al. Full-endoscopic interlaminar and transforaminal lumbar discectomy versus conventional microsurgical technique: a prospective,randomized, controlled study[J]. Spine, 2008, 33(9):931-939.DOI: 10.1097/BRS.0b013e31816c8af7.
[17] Morgenstern R, Morgenstern C. Percutaneous transforaminal lumbar interbody fusion (pTLIF) with a posterolateral approach for the treatment of denegerative disk disease: feasibility and preliminary results[J]. Int J Spine Surg, 2015, 9:41. DOI:10.14444/2041.
[18] Wang MY, Grossman J. Endoscopic minimally invasive transforaminal interbody fusion without general anesthesia:initial clinical experience with 1-year follow-up[J]. Neurosurg Focus, 2016, 40(2):E13. DOI: 10.3171/2015.11.FOCUS15435.
[19] Kim JE, Choi DJ. Biportal endoscopic transforaminal lumbar interbody fusion with arthroscopy[J]. Clin Orthop Surg, 2018,10(2):248-252. DOI: 10.4055/cios.2018.10.2.248.
[20] Nakamura S, Taguchi M. Full percutaneous lumbar interbody fusion: technical note[J]. J Neurol Surg A Cent Eur Neurosurg,2017, 78(6):601-606. DOI: 10.1055/s-0037-1604360.
[21] Lee SH, Erken HY, Bae J. Percutaneous transforaminal endoscopic lumbar interbody fusion: clinical and radiological results of mean 46-month follow-up[J]. Biomed Res Int, 2017,2017:3731983. DOI: 10.1155/2017/3731983.
[22] Wu J, Liu H, Ao S, et al. Percutaneous endoscopic lumbar interbody fusion: technical note and preliminary clinical experience with 2-year follow-up[J]. Biomed Res Int, 2018,2018:5806037. DOI: 10.1155/2018/5806037.
[23] Krishnan A, Barot M, Dave B, et al. Percutaneous transforaminal endoscopic decompression and cageless percutaneous bone graft transforaminal lumbar interbody fusion: a feasibility study[J]. J Orthop Allied Sci, 2018,6:S21-S27. DOI: 10.4103/joas.joas_62_17.
[24] Yang J, Liu C, Hai Y, et al. Percutaneous endoscopic transforaminal lumbar interbody fusion for the treatment of lumbar spinal stenosis: preliminary report of seven cases with 12-month follow-up[J]. Biomed Res Int, 2019, 2019:3091459.DOI: 10.1155/2019/3091459.
[25] Kolcun JPG, Brusko GD, Wang MY. Endoscopic transforaminal lumbar interbody fusion without general anesthesia: technical innovations and outcomes[J]. Ann Transl Med, 2019,7(Suppl 5):S167. DOI: 10.21037/atm.2019.07.92.
[26] Kamson S, Lu D, Sampson PD, et al. Full-endoscopic lumbar fusion outcomes in patients with minimal deformities:a retrospective study of data collected between 2011 and 2015[J]. Pain Physician, 2019, 22(1):75-88.
[27] Shen J. Fully endoscopic lumbar laminectomy and transforaminal lumbar interbody fusion under local anesthesia with conscious sedation: a case series[J]. World Neurosurg,2019, 127:e745-e750. DOI: 10.1016/j.wneu.2019.03.257.
[28] Kim HS, Raorane HD, Pang HW, et al. Feasibility of endoscopic transforaminal lumbar interbody fusion through the posterior paraspinal approach: technical note and preliminary result[J].Neurospinekim, 2020. DOI: 10.21203/rs.3.rs-28307/v1.
[29] Fiori R, Forcina M, Spiritigliozzi L, et al. Full percutaneous treatment of degenerative disc disease with intradiscal lumbar interbody fusion and posterior stabilization: preliminary results[J]. Cardiovasc Intervent Radiol, 2020, 43(6):889-896.DOI: 10.1007/s00270-020-02465-x.
[30] Kim HS, Wu PH, Lee YJ, et al. Technical considerations of uniportal endoscopic posterolateral lumbar interbody fusion: a review of its early clinical results in application in adult degenerative scoliosis[J]. World Neurosurg, 2021, 145:682-692. DOI: 10.1016/j.wneu.2020.05.239.
[31] Ao S, Zheng W, Wu J, et al. Comparison of Preliminary clinical outcomes between percutaneous endoscopic and minimally invasive transforaminal lumbar interbody fusion for lumbar degenerative diseases in a tertiary hospital: is percutaneous endoscopic procedure superior to MIS-TLIF? A prospective cohort study[J]. Int J Surg, 2020, 76:136-143. DOI: 10.1016/j.ijsu.2020.02.043.
[32] Dowling Á, Lewandrowski KU. Endoscopic transforaminal lumbar interbody fusion with a single oblique peek cage and posterior supplemental fixation[J]. Int J Spine Surg, 2020,14(s3):S45-S55. DOI: 10.14444/7126.
[33] Harakuni T, Iwai H, Oshima Y, et al. Full-endoscopic lumbar interbody fusion for treating lumbar disc degeneration involving disc height loss: technical report[J]. Medicina (Kaunas), 2020,56(9):478. DOI: 10.3390/medicina56090478.
[34] Li ZZ, Wang JC, Cao Z, et al. Full-endoscopic oblique lateral lumbar interbody fusion: a technical note with 1-year follow-up[J]. Int J Spine Surg, 2021, 15(3):504-513. DOI:10.14444/8072.
[35] Sharma M, Chhawra S, Jain R, et al. Full endoscopic lumbar transforaminal interbody fusion in ddd lumbar degenerative disc disease: a latest technique[J]. Int J Spine Surg, 2021,14(s4):S71-S77. DOI: 10.14444/7168.
[36] Zhang H, Zhou C, Wang C, et al. Percutaneous endoscopic transforaminal lumbar interbody fusion: technique note and comparison of early outcomes with minimally invasive transforaminal lumbar interbody fusion for lumbar spondylolisthesis[J]. Int J Gen Med, 2021, 14:549-558. DOI:10.2147/IJGM.S298591.
[37] Wu PH, Kim HS, Lee YJ, et al. Uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion with endoscopic disc drilling preparation technique for symptomatic foraminal stenosis secondary to severe collapsed disc space:a clinical and computer tomographic study with technical note[J].Brain Sci, 2020, 10(6):373. DOI: 10.3390/brainsci10060373.
[38] Li Y, Dai Y, Wang B, et al. Full-endoscopic posterior lumbar interbody fusion via an interlaminar approach versus minimally invasive transforaminal lumbar interbody fusion: a preliminary retrospective study[J]. World Neurosurg, 2020, 144:e475-e482.DOI: 10.1016/j.wneu.2020.08.204.
[39] Wang JC, Li ZZ, Cao Z, et al. Technical notes of full endoscopic lumbar interbody fusion with anterior expandable cylindrical fusion cage: clinical and radiographic outcomes at 1-year follow-up[J]. World Neurosurg, 2021, S1878-8750(21)01731-9. DOI: 10.1016/j.wneu.2021.11.030.
[40] Li Z, Hou S, Shang W, et al. New instrument for percutaneous posterolateral lumbar foraminoplasty: case series of 134 with instrument design, surgical technique and outcomes[J]. Int J Clin Exp Med, 2015, 8(9):14672-14679.
[41] Li ZZ, Hou SX, Shang WL, et al. Percutaneous lumbar foraminoplasty and percutaneous endoscopic lumbar decompression for lateral recess stenosis through transforaminal approach: Technique notes and 2 years follow-up[J]. Clin Neurol Neurosurg, 2016, 143:90-94. DOI: 10.1016/j.clineuro.2016.02.008.
[42] Li ZZ, Hou SX, Shang WL, et al. Modified percutaneous lumbar foraminoplasty and percutaneous endoscopic lumbar discectomy: instrument design, technique notes, and 5 years follow-up[J]. Pain Physician, 2017, 20(1):E85-E98.
[43] Mannion RJ, Nowitzke AM, Wood MJ. Promoting fusion in minimally invasive lumbar interbody stabilization with low-dose bone morphogenic protein-2--but what is the cost[J]? Spine J, 2011, 11(6):527-533. DOI: 10.1016/j.spinee.2010.07.005.
[44] Kambin P, Gellman H. Percutaneous lateral discectomy of the lumbar spine[J]. Clin Orthop Surg, 1983, 174:127-132.DOI:10.1097/00003086-198304000-00015.
[45] Osman SG. Endoscopic transforaminal decompression,interbody fusion, and percutaneous pedicle screw implantation of the lumbar spine: a case series report[J]. Int J Spine Surg,2012, 6:157-166. DOI: 10.1016/j.ijsp.2012.04.001.
[46] Lewandrowski KU, Ransom NA, Ramírez León JF, et al. The concept for a standalone lordotic endoscopic wedge lumbar interbody fusion: the LEW-LIF[J]. Neurospine, 2019, 16(1):82-95. DOI: 10.14245/ns.1938046.023.
[47] Morgenstern C, Yue JJ, Morgenstern R. Full percutaneous transforaminal lumbar interbody fusion using the facet-sparing,trans-kambin approach[J]. Clin Spine Surg, 2020, 33(1):40-45.DOI: 10.1097/BSD.0000000000000827.
[48] Choi G, Lee SH, Raiturker PP, et al. Percutaneous endoscopic interlaminar discectomy for intracanalicular disc herniations at L
- S
using a rigid working channel endoscope[J].Neurosurgery, 2006, 58(Suppl 1):ONS59-68. DOI: 10.1227/01.neu.0000192713.95921.4a.
[49] Min SH, Yoo JS. The clinical and radiological outcomes of multilevel minimally invasive transforaminal lumbar interbody fusion[J]. Eur Spine J, 2013, 22(5):1164-1172. DOI: 10.1007/s00586-012-2619-y.
[50] Park Y, Ha JW, Lee YT, et al. Minimally invasive transforaminal lumbar interbody fusion for spondylolisthesis and degenerative spondylosis: 5-year results[J]. Clin Orthop Relat Res, 2014, 472(6):1813-1823. DOI: 10.1007/s11999-013-3241-y.
[51] Siddiqui MM, Sta Ana AR, Yeo W, et al. Bone morphogenic protein is a viable adjunct for fusion in minimally invasive transforaminal lumbar interbody fusion[J]. Asian Spine J, 2016,10(6):1091-1099. DOI: 10.4184/asj.2016.10.6.1091.
