黄芩苷镁对脂多糖联合D-氨基半乳糖致急性肝损伤大鼠炎症因子的影响
2022-09-26白冰1郭亚春1石凯行
肝脏是人体内物质代谢和起生物转化作用的重要器官,急性肝损伤(acute hepatic injury,AHI)是指由于酒精、病毒、化学药物等一种或多种因素导致的短时间内肝功能急剧损伤,损伤严重还可能导致肝功能衰竭伴有很多并发症,具有很高的致死率
。对于治疗肝损伤,目前国内外并没有合适的药物,因此寻找在临床上能够有效治疗肝损伤的药物成为研究热点。中药黄芩性苦寒,具有清热泻火、燥湿解毒之效,可以治疗黄疸
。黄芩主要成分为黄芩苷,具有抗炎、抗氧化等药理作用。据文献报道,黄芩苷对非酒精性脂肪性肝炎具有一定的治疗作用
,还对对乙酰氨基酚诱导的急性肝损伤小鼠具有保护作用
。由于水溶性差的特点,致使黄芩苷临床应用受到限制,而水溶性及稳定性极好的黄芩苷镁解决了这一问题
。脂多糖(lipopolysaccharide,LPS)联合D-氨基半乳糖(D-Galactosamine,D-GalN)制备急性肝损伤模型是国内外公认的经典方法
,其诱导的急性肝损伤病理变化与临床乙肝病理变化类似
,主要是由炎症介导的免疫性肝损伤。当中毒、感染等内外因素刺激下,免疫调节作用失控,二者比例失衡,活化的免疫细胞分泌大量炎症因子,就可能会引起免疫功能紊乱,进而造成肝细胞损伤
。有报道D-GalN 致急性肝衰竭大鼠模型中存在Th 细胞分泌的炎症因子失衡
,在肝损伤的过程中IL-6、IFN-γ、TNF-α 等Th1 类细胞因子发挥主要作用
。因此,本研究拟通过检测炎症因子水平来探究黄芩苷镁尾静脉给药对LPS/D-GalN 诱导急性肝损伤大鼠的影响。
1 材料与方法
1.1 材料与试剂 54 只SPF 级雄性SD 大鼠购于维通利华,许可证号SCXK(京)2016-0006,5 周龄,重(170±10)g,本研究已通过我校伦理委员会审批,批准文号:CDMULAC-20181219-006。大鼠饲养于SPF级环境。试剂及仪器:LPS、D-GalN(Sigma-Aldrich),异甘草酸镁(正大天晴药业),黄芩苷镁(纯度为85%,由承德医学院刘翠哲教授课题组提供),红帽负压液体采集管(不抗凝)国产(Bebolabs),大鼠IL-1β、IL-6、IFN-γ、TNF-α 试剂盒(联科生物),SIM-F124 制冰机(日本SANYO 公司),PrimeScript RT Master Mix(Perfect Real Time)(TaKaRa),DEPC处理水(DNase、RNase free)(Beyotime),普通RIPA(组织/细胞)裂解液(附PMSF 1.5 ml)(Solarbio),引物(TaKaRa),PCR 仪(BIO-RAD)。
1.2 方法
1.2.1 动物分组及处理 大鼠适应性饲养1 周,按照随机数字表法分为模型组、正常组、黄芩苷镁(BAMg)高、中、低剂量组(100、50、25 mg/kg),异甘草酸镁组(MgIG)(18 mg/kg),每组9 只。给药组尾静脉注射相应浓度的药物连续7 d,1 次/d,模型及正常组以相同方法给予等量生理盐水。根据前期实验结果,确定造模条件为20 μg/kg LPS 联合400 mg/kg D-GalN,于12 h 后取材
。
1.2.2 ELISA 法检测血清炎症因子 取材,大鼠血液离心后得到血清置于冰上备用;在标准品孔中,分别加入呈比例稀释的标准品100 μl 作为标准曲线,加100 μl 标准品稀释液于空白孔内作为空白对照,在样本孔中,加入样本溶液20 μl、1×检测缓冲液80 μl;然后所有孔加入稀释好的检测抗体溶液50 μl;37 ℃孵育1.5 h;冲洗6 次;加辣根酶标记的链霉亲和素100 μl/孔;37 ℃孵育30 min;冲洗6 次;避光加入显色底物100 μl/孔,避光室温孵育30 min;加终止液100 μl/孔;30 min 内,上机检测450 nm 条件下的OD 值;处理数据,检测血清样本中IL-6、IL-1β、TNF-α、IFN-γ 含量。
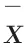
2 结果
黄芩苷镁是黄芩苷与镁离子耦合形成的水溶性化合物,它是黄芩苷在植物中的主要存在形式
。有文献报告黄芩苷在肾损伤、心肌损伤、脊髓损伤、肺损伤等方面均有一定的治疗作用
。课题组前期研究发现BA-Mg 可改善CCl
诱发的大鼠急性肝损伤
,其可能通过Nrf2/ARE 信号通路抑制氧化应激反应发挥保护作用
。有研究报道了黄芩苷镁对急性肺损伤小鼠就有一定保护作用
。因此本研究通过BA-Mg 预处理大鼠1 周后,进行LPS/D-GalN 诱导急性肝损伤
,研究BA-Mg 对LPS/D-GalN 诱导急性肝损伤是否有保护作用。
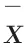
3 讨论
模型组血清IL-6、IL-1β、TNF-α、IFN-γ 水平高于正常组,差异有统计学意义(
<0.05);黄芩苷镁高、中剂量组、异甘草酸镁组血清IL-6、IL-1β、IFN-γ水平低于模型组,差异有统计学意义(
<0.05);黄芩苷镁低剂量组血清IFN-γ 水平低于模型组,差异有统计学意义(
<0.05);黄芩苷镁低剂量组血清IL-6、IL-1β、TNF-α 水平与模型组比较,差异无统计学意义(
>0.05);黄芩苷镁中、低剂量组血清IL-6、IL-1β、IFN-γ 水平高于异甘草酸镁组,差异有统计学意义(
<0.05);黄芩苷镁高剂量组血清IL-6、IL-1β、IFN-γ 水平与异甘草酸镁组比较,差异无统计学意义(
>0.05);黄芩苷镁高、中、低剂量组血清TNF-α水平与异甘草酸镁组比较,差异无统计学意义(
>0.05),见表1。
综上所述,融合生产在技术上是可行的,虽然短期内还不能见效,但从发展的角度来看,融合生产相对常规生产具有不可比拟的优势,同时也将发挥更大作用。
免疫应答是机体免疫系统识别并清除“非己”物质的整个过程,需要T、B 细胞及多种固有免疫细胞相互协调、共同作用完成
。T 细胞来源于骨髓造血干细胞,在胸腺发育成熟后定居在外周淋巴器官中的胸腺依赖区,当受到某些特定的抗原刺激后就会被激活、增殖,并分化为发挥效应的T 细胞和具有记忆作用的T 细胞,通过淋巴细胞再循环周游全身发挥免疫调节和细胞免疫功能
。依据T 细胞在免疫应答中的功能,将其分为辅助性T 细胞(Th 细胞)、细胞毒性T 细胞(Tc 细胞)和调节性T 细胞(Treg 细胞)。Th 细胞主要分为Th1、Th2 细胞,其中Th1 细胞活化分泌IL-1、IL-2、IFN-γ、TNF-α 等因子,Th2 细胞活化分泌IL-4、IL-6、IL-10 等因子。正常生理状态下,Th1/Th2 细胞处于动态平衡,调节机体正常免疫应答,在肝损伤状态下导致二者比例失衡,促炎因子大量分泌,进而可能会引起免疫功能紊乱
。由此,实验研究检测了大鼠血清中促炎因子IL-6、IL-1β、TNF-α、IFN-γ 含量。
中医讲究辨证施治,而不是西医的辨病,西医师对中医不甚了解,只能做到辨病,开出的中成药方很大部分药不对证。中药的使用应该咨询中医师。
中国石油大学胜利学院是由国家教育部批准设立,教育部直属高校中国石油大学(华东)和国家特大型企业胜利石油管理局合作举办的按新的办学模式和运行机制运作的全日制普通本科高等院校,是山东省首家由重点大学申办的规范化独立学院。
本研究发现,AHI 大鼠血清IL-6、IL-1β、TNF-α、IFN-γ 水平高于正常组(
<0.05),与文献报道相一致
,提示LPS/D-GalN 诱导的AHI 过程中,可能使Th1 细胞过度活化,大量分泌IL-6、IL-1β、TNF-α、IFN-γ 等因子,进而导致炎症反应。黄芩苷镁高、中、低剂量组可以降低LPS 联合D-GalN 致急性肝损伤大鼠血清中IL-6、IL-1β、IFN-γ的水平,其中以黄芩苷镁高、中剂量组较为突出(
<0.05)。黄芩苷镁高、中、低剂量组血清中TNF-α 水平有下降的趋势,与模型组比较,差异无统计学意义(
>0.05),提示TNF-α 可能并不是BA-Mg 影响的主要因子。因此,BA-Mg 可能通过抑制Th1 细胞的过度活化,进而抑制分泌促炎因子,发挥抗炎作用。黄芩苷镁高剂量组血清炎症因子IL-6、IL-1β、IFN-γ 水平与异甘草酸镁组比较,差异无统计学意义(
>0.05),黄芩苷镁中、低剂量组血清炎症因子IL-6、IL-1β、IFN-γ水平较异甘草酸镁组高(
<0.05),提示高浓度BA-Mg 可能与MgIG的抗炎效果一致。
综上所述,LPS 联合D-氨基半乳糖可造成急性肝损伤,释放大量炎症因子。基于前期AHI 模型建立的条件,黄芩苷镁可以通过抑制炎症因子产生来发挥保肝作用,但黄芩苷镁是否通过影响Th1、Th2细胞增殖来抑制炎症因子产生,有待进一步研究。
[1] Li Z,Feng H,Han L,et al.Chicoric acid ameliorate inflammation and oxidative stress in Lipopolysaccharide and d-galactosamine induced acute liver injury [J].J Cell Mol Med,2020,24(5):3022-3033.
[2] 胡泊,孟祥云,丁瑞洁,等.基于网络药理学研究黄芩治疗慢性乙型病毒性肝炎的作用机制[J].宁夏医科大学学报,2022,44(3):296-302.
[3] 史会连,车军勇,陆玮婷,等.基于TLR-4/Caspase-3 信号通路参与黄芩苷治疗非酒精性脂肪性肝炎的机制研究[J].辽宁中医杂志,2022,49(5):143-146,224.
[4] 常虎林,刘司南,苗润晨,等.黄芩苷对急性药物性肝损伤小鼠的保护机制[J].中华实验外科杂志,2021,38(7):1280-1282.
[5] 金鹏,李景,刘翠哲.注射用黄芩苷镁盐冻干粉在大鼠体内的药代动力学及组织分布[J].中国实验方剂学杂志,2019,25(10):102-108.
[6] 何佳,刘根玉,张耀林,等.脂多糖/氨基半乳糖(LPS/D-GalN)体外诱导肝细胞损伤模型的建立和评价[J].细胞与分子免疫学杂志,2021,37(6):495-500.
[7] 白冰,郭亚春,宋鸿儒.脂多糖联合D-氨基半乳糖致大鼠急性肝损伤模型的最佳条件研究[J].现代预防医学,2018,45(14):2623-2626.
[8] 朱立娜,黄初军,赵秋燕等.组合型人工肝对肝功能衰竭患者血清Th1/Th2 型细胞因子的影响 [J].临床消化病杂志,2020,32(1):41-45.
[9] 李小鹏,李明,雷弯,等.异甘草酸镁对D-氨基半乳糖致急性肝衰竭大鼠模型的保护作用[J].临床肝胆病杂志,2016,32(3):545-548.
[10] 邢文改.黄芩苷镁盐肠溶颗粒药动学及其磷脂复合物制备和在体肠吸收研究[D].承德:承德医学院,2020.
[11] 邢兆国,王彦志,贾东昭,等.黄芩苷对挤压综合征大鼠急性肾损伤的保护作用机制研究[J].现代中西医结合杂志,2022,31(9):1204-1211,1217.
[12] 靳莉丹.草本植物中的活性物质黄芩苷对运动后大鼠心肌损伤的医学功能研究[J/OL].分子植物育种:1-11.http://kns.cnki.net/kcms/detail/46.1068.S.20220419.1051.010.html,2022-04-20/2022-06-04.
[13] 王笑,刘卿,谷成旭,等.汉黄芩苷对大鼠脊髓损伤的修复效果[J].解剖学报,2022,53(2):173-182.
[14] 夏金婵,从人愿,袁静,等.黄芩苷通过p38 MAPK/NLRP3通路对脂多糖诱导大鼠急性肺损伤的影响[J].中国实验方剂学杂志,2022,28(2):79-86.
[15] 郭亚春,李卫,黄群,等.黄芩苷镁盐对CCl_4 诱导的SD 大鼠急性肝损伤的影响[J].中国老年学杂志,2019,39(12):3017-3020.
[16] 王朔,李卫,白冰,等.黄芩苷镁盐对CCl4 诱导SD 大鼠急性肝损伤保护机制[J].中国老年学杂志,2022,42(9):2253-2256.
[17]杨禄坤.黄芩苷镁盐对LPS 诱导急性肺损伤小鼠的保护作用[D].承德:承德医学院,2021.
[18] 金敏.炎症免疫应答中T 细胞效应的调控机制及干预策略[D].苏州:苏州大学,2017.
[19] 曹雪涛,何维.医学免疫学[M].北京:人民卫生出版社,2015:197-199.
[20] 卢任玲,马丽杰.红花清肝十三味丸对急性肝损伤大鼠的影响[J].中成药,2022,44(2):564-568.
[21] 金少举,郭昆鹏,黄亚男,等.鸟苷酸二钠通过抑制Caspase 3/Bax/Bcl-2 凋亡通路保护LPS/D-GalN 致小鼠急性肝损伤[J].现代预防医学,2021,48(23):4365-4369,4402.
