LncRNA HEIH 对胶质瘤细胞侵袭能力的影响及机制
2022-09-25田少辉张学浩徐江龙乔晓霞张雨豪徐灿李春晖
田少辉 张学浩 徐江龙 乔晓霞 张雨豪 徐灿 李春晖
(河北大学附属医院神经外科,河北 保定 071000)
胶质瘤是最常见的中枢神经系统恶性肿瘤,由于肿瘤细胞高度的侵袭性,患者死亡率居高不下。因此,探讨和揭示调控胶质瘤转移的关键基因和信号分子对于提高患者预后意义重大。随着高通量RNA测序技术的发展,RNA测序提示70%~90%的人类基因组被转录成RNA,而其中约68%的转录子为不能编码蛋白质的非编码RNA〔1,2〕。长链非编码RNA(LncRNA)是一类长度不小于200 nt的非编码RNA,能够以“分子海绵”的形式吸附miRNA影响其对下游靶基因的调节作用,或通过与蛋白质结合参与蛋白质相互作用〔3,4〕。有研究报道LncRNA在多种病理生理过程中发挥重要作用〔5,6〕。LncRNA在多种肿瘤中异常表达,并且参与肿瘤细胞的增殖、侵袭、转移〔7~9〕。研究表明LncRNA HEIH在肝癌组织和细胞中高表达,促进肝癌细胞生长、侵袭、转移〔10〕。在结直肠癌中LncRNA HEIH高表达,通过与miR-939相互作用,促进结直肠癌细胞增殖,抑制其凋亡〔11〕。另有证据显示LncRNA HEIH促进非小细胞肺癌生长和转移〔12〕。LncRNA HEIH是一类促进肿瘤生成和进展的基因。研究表明多种LncRNA在胶质瘤组织中异常表达影响胶质瘤的发生发展〔13〕。然而,目前尚不清楚LncRNA HEIH对胶质瘤细胞表型和功能的影响及相关的调控机制。本研究旨在阐明LncRNA HEIH在胶质瘤细胞侵袭、转移中的作用和调控机制。
1 材料与方法
1.1胶质瘤组织细胞系 21例人脑胶质瘤组织取自河北大学附属医院神经外科,以16例同期手术的脑膜瘤样本作为阴性对照。取材前患者均已签署知情同意书,并经河北大学附属医院伦理委员会批准。
1.2材料 DMEM高糖培养基、胎牛血清、TRIzol试剂盒、脂质体转染试剂LipofectamineTM2000 购自美国Invitrogen公司;逆转录和实时荧光定量逆转录聚合酶链反应(qRT-PCR)试剂盒购自Takara公司;双荧光素酶检测试剂盒购自美国Promega 公司;Transwell 小室购自美国Corning公司;基质胶购自美国BD公司;E盒结合锌指蛋白(ZEB)1抗体和GAPDH抗体购自Abcam公司;RIPA裂解液和BCA蛋白检测试剂盒购自上海碧云天生物技术有限公司。
1.3细胞培养和转染 胶质瘤细胞系U251细胞购自中国科学院上海生命科学研究院细胞库。U251细胞培养在含10%胎牛血清的DMEM高糖培养基中,放在37℃,5%CO2恒温培养箱中培养,当细胞处于对数生长期时用于实验。
LncRNA HEIH siRNA及对照siRNA、miR-194-5p模拟物(mimics)及无异序列阴性对照、pmirGLO-HEIH-Wt野生型载体、pmirGLO-HEIH-Mut突变型载体(上海吉玛制药技术有限公司)分别用脂质体介导瞬时转染至胶质瘤细胞U251细胞中,具体方法按照LipfectamineTM2000 转染试剂盒说明书进行操作。转染48 h后,qRT-PCR验证转染效率。
1.4qRT-PCR 采用Trizol试剂按其说明书提取细胞总RNA,按照TakaRa公司qRT-PCR反转录试剂盒说明书操作逆转录成cDNA。在ABI7500荧光PCR仪进行荧光定量PCR测定LncRNA HEIH、miR-194-5p的相对表达水平。LncRNA HEIH上游引物:5′-CCTCTTGTGCCCCTTTCT-3′,下游:5′-AGGTCTCATGGCTTCTCG-3′;miR-194-5p,上游引物:5′-ATGGACCTGGGGCCAGCGAAG-3′,下游:5′-TCTGGCCTGGGAGCGTCG-3′;ZEB1上游引物:5′-TTCGGAAAGAGCTGTTCGCT-3′,下游:5′-TGCAGCGATCAAGAACCTCT-3′;GAPDH上游引物:5′-CCTGACCTGCGTGTGGACT-3′,下游:5′-GCTGTGGATGGGGAGGTGTC-3;U6上游引物:5′-CTCGCTTCGGCAGCCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′。以U6或GAPDH为内参,用2-ΔΔCt法分别计算LncRNA HEIH、miR-194-5p和ZEB1的相对表达量。
1.5细胞侵袭实验 将20 μl基质胶均匀涂在Transwell小室内面,使基质胶凝固。向24孔板中加入600 μl含有10%血清的DMEM高糖培养液,孔内放置Transwell(8 μm)小室。向小室内加入转染si-LncRNA HEIH(si-HEIH组)或对照siRNA(si-Ctrl组)的U251胶质瘤细胞(2.5×104个),放入37℃,5%CO2恒温培养箱中培养。24 h后取出小室,用棉签将上室内面没有侵袭过去的细胞去掉,4%多聚甲醛固定30 min,晾干后用结晶紫染色液染色30 min。磷酸盐缓冲液(PBS)清洗3次,擦去上层细胞,在显微镜下拍照。每个孔随机选择5个视野拍照,计数每张相片细胞数,计算平均数进行比较。
1.6生物信息学分析 利用生物信息学数据库Starbase(http://starbase.sysu.edu.cn/),TargetScan(http://www.targetscan.org)预测LncRNA HEIH 和miR-194-5p的靶基因。
1.7双荧光素酶报告基因试验 胰酶消化收取处于对数生长期的U251细胞,接种于不含双抗的DMEM高糖培养液6孔板中。分组如下:pmir-GLO-HEIH-Wt+miR-194-5p mimics组、pmiR-GLO-HEIH-Wt+mimics组、pmiR-GLO-HEIH-Mut+miR-194-5p mimics组、pmiR-GLO-HEIH-Mut+mimics组,每组设3 个复孔,混合均匀后按照Lipofectamine 2000转染试剂盒说明书操作进行共转染,24 h后按照双荧光素酶检测试剂盒产品说明书操作检测荧光强度。
1.8Western印迹 按照每1.0×106个U251细胞加入100 μl RIPA蛋白裂解液,混匀后置冰上30 min,4℃ 14 000 r/min离心30 min。上清转入洁净EP管,采用BCA蛋白定量分析检测蛋白含量。将转有蛋白的聚偏氟乙烯(PVDF)膜置于5%脱脂奶粉-TBST室温中振荡封闭1 h,然后置于1∶2 000稀释的,兔抗人ZEB1抗体(ab203829,Abcam)中4℃孵育过夜;第2天室温用1×TBST洗涤PVDF膜,将膜置于适当稀释的含辣根过氧化物酶标记二抗的1×TBST中,室温孵育1 h;用1×TBST洗涤后,进行化学发光操作,伯乐公司Chemic Doc XRS系统曝光,显影。
1.9统计学处理 采用SPSS21.0软件进行t检验、方差分析。
2 结 果
2.1LncRNA HEIH在胶质瘤中高表达且影响U251细胞侵袭 与正常星形胶质细胞(1.00±0.08)比较,胶质瘤细胞 U-251中 LncRNA HEIH表达明显升高(2.53±0.36,P<0.01)。转染si-HEIH后U251细胞LncRNA HEIH表达显著降低 (1.00±0.11 vs 0.34±0.03,P<0.01)。与si-Ctrl组相比,si-HEIH组U251细胞侵袭能力显著降低〔(101.57±11.43) vs (53.56±5.35)个,P<0.01,n=9〕,见图1。

图1 沉默LncRNA HEIH抑制U251细胞侵袭 (结晶紫染色,×200)
2.2miR-194-5p是LncRNA HEIH靶基因 利用Starbase数据库预测LncRNA HEIH靶基因发现,miR-194-5p与LncRNA HEIH有结合位点(图2)。双荧光素酶报告基因试验结果显示,与miR-NC+HEIH-Wt组相比,miR-194-5p+HEIH-Wt组细胞荧 光 素 酶 相 对活性显著降低(1.00±0.07 vs 0.34±0.03,P<0.01),而miR-NC+HEIH-Mut组和miR-194-5p+HEIH-Mut组细胞荧光素酶相对活性无明显差异(0.99±0.06 vs 0.99±0.06,P>0. 05)。与si-Ctrl组相比,si-HEIH组miR-194-5p表达显著升高(1.00±0.09 vs 3.04±0.23,P<0. 01)。pcDNA-HEIH组U251细胞中miR-194-5p的表达水平显著低于 pcDNA组( 0.34±0.03 vs 1.00±0.05,P<0.05)。

图2 Starbase数据库预测LncHEIH与miR-194-5p结合位点
2.3miR-194-5p抑制U251细胞ZEB1表达和侵袭 Targetscan数据库预测发现miR-194-5p与ZEB1有靶向结合位点,见图3。与miR-NC组(1.00±0.05 )相比,miR-194-5p组U251细胞ZEB1的表达水平显著降低(0.25±0.03,P<0.01),见图4。细胞侵袭实验结果显示,与miR-NC组〔(99.52±9.27)个〕相比,miR-194-5p组U251细胞侵袭数量显著减少〔(45.61±6.05)个,P<0.01〕,见图5。

图3 Targetscan数据库预测mir-194-5p与ZEB1的结合位点;qRT-PCR

图4 Western印迹

图5 检测mir-194-5p对ZEB1表达的影响(结晶紫染色,×200)
2.4miR-194-5p部分逆转LncRNA HEIH对ZEB1表达和侵袭能力的影响 与pcDNA-HEIH+miR-NC组相比,pcDNA-HEIH+miR-194-5p组U251细胞ZEB1表达和侵袭数量显著降低(P<0.01),见图6、7,表1。

图6 各组U251细胞侵袭能力(结晶紫染色,×200)
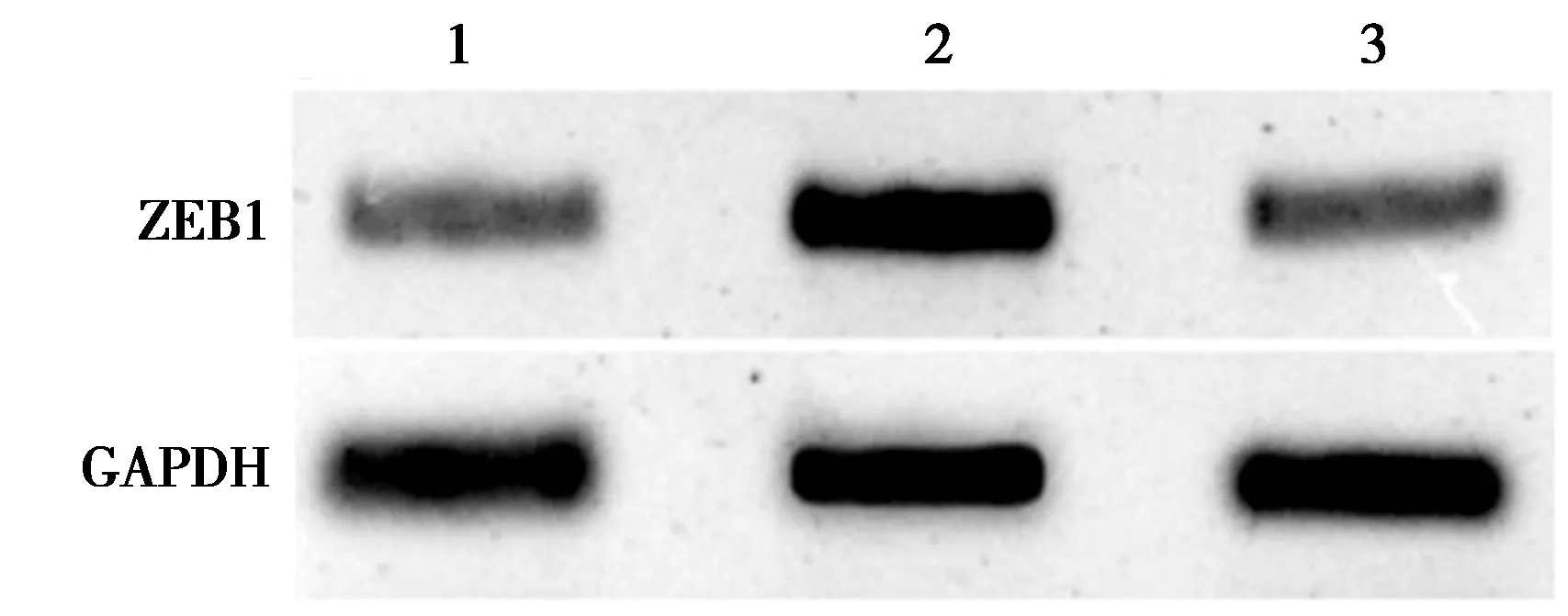
1~3:pcDNA+miR-NC组,pcDNA-HEIH+miR-NC组,pcDNA-HEIH+miR-194-5p组图7 miR-194-5p逆转LncHEIH对ZEB1表达
表1 过表达miR-194-5p逆转LncRNA HEIH对U251细胞ZEB1表达和侵袭能力的影响
2.5敲减ZEB1能逆转LncHEIH对U-251细胞侵袭的影响 细胞侵袭实验结果显示,pcDNA+si-Ctrl组细胞侵袭数量为(96.43±6.34)个。pcDNA-HEIH+si-ZEB1组〔(97.34±5.23 )个〕U251细胞侵袭能力显著低于pcDNA-HEIH+si-Ctrl组〔(159.78±12.34)个,P<0.01〕,见图8。

图8 si-ZEB1逆转LncHEIH对U251细胞侵袭能力的影响(结晶紫染色,×200)
3 讨 论
胶质瘤是常见的中枢神经系统肿瘤,目前对于胶质瘤的治疗方法包括手术治疗、化疗、放疗、生物治疗等。由于肿瘤转移和复发,胶质瘤患者生存期很短预后较差。LncRNA在胶质瘤的发生发展中发挥关键作用〔14〕。Dai等〔15〕研究发现LncRNA ANRIL通过MAPK信号通路促进胶质瘤发生。Liu等〔16〕报道LINC00909通过调控miR-194/MUC1-C轴促进胶质瘤进展。本研究表明LncRNA HEIH 在胶质瘤组织和细胞中高表达,进一步在体外实验中发现LncRNA HEIH增强胶质瘤细胞U251侵袭能力,从而证实LncRNA HEIH是一种促胶质瘤LncRNA。miRNA是一种短链非编码RNA分子,在多种肿瘤发生发展中发挥调控作用。有文献报道miR-194调控肿瘤发展,研究发现miR-194通过调控BMP1和 p27 kip1表达抑制非小细胞肺癌转移〔17〕。miR-194通过靶向抑制BMI1抑制胶质瘤细胞间质-上皮细胞转化〔18〕。近年来,有研究显示,LncRNA可通过竞争性内源RNA途径,与其他RNA 转录本竞争性结合相同的miRNA,从而调控miRNA靶基因的表达。研究表明miR-194在胶质瘤中低表达是LINC00909促进胶质瘤增殖侵袭作用的靶分子〔16〕。本研究结果提示在胶质瘤中,LncRNA HEIH可能通过分子海绵吸附miR-194-5p发挥促癌基因的作用。ZEB1可诱导细胞发生EMT,增强细胞的侵袭转移能。有研究表明LncRNA-MALAT1可争性结合miR-200a,上调EC-109细胞中ZEB1、ZEB2的表达,促进食管癌的侵袭和转移〔19〕。本研究用生物信息学方法预测发现miR-194-5p可能与ZEB1互相结合而调控ZEB1的表达,进一步促进胶质瘤细胞U251侵袭。
综上所述,LncRNA HEIH通过发挥ceRNA作用,竞争性结合miR-194-5p上调ZEB1表达而促进胶质瘤细胞侵袭。在本研究中,只是用Targetscan数据库预测ZEB1是miR-194-5p的靶分子,没有进一步用双荧光素酶报告基因实验验证miR-194-5p与ZEB1直接相互结合。本实验没有在动物实验中验证LncRNA HEIH对胶质瘤侵袭转移的影响,这是本研究的局限性。本研究进一步完善了LncRNA在肿瘤发生发展中生物学功能和调控机制,为胶质瘤诊断治疗提供新的理论依据。
