重症急性胰腺炎的临床特点及继发胰腺感染的危险因素
2022-09-24郭伟仪詹磊磊莫林耀郑锐年
郭伟仪,詹磊磊,莫林耀,郑锐年
急性胰腺炎是一种常见的外科急腹症,主要临床表现有:急性上腹痛、腹胀、恶心、呕吐[1]。重症急性胰腺炎(severe acute pancreatitis,SAP)属于急性胰腺炎当中一种特殊类型,主要是由于胆道疾病、大量饮酒和暴饮暴食等因素引起,患者起病迅速、病情发展快且复杂、并发症多、致死率高。临床上将SAP划分急性期和恢复期两个阶段,急性期的SAP患者常伴有全身炎症反应综合征,容易出现多器官功能衰竭;恢复期大约有30%的SAP患者伴随胰腺和胰周坏死组织引起的继发感染,继发感染又会导致患者多器官功能衰竭综合症[2]。据统计,SAP的临床死亡率大约占10%~20%,其中继发感染造成的死亡率占70%[3]。SAP患者急性期主要给予液体复苏治疗,维持心血管系统功能稳定,恢复器官灌注,降低器官功能障碍[4],因此如何减少急性期感染的发生,降低死亡率是临床诊疗的难点。研究表明,SAP继发胰腺感染以内源性感染为主,主要由于机体处于免疫炎症、胰腺组织坏死利于细菌生长。同时,医院感染等外源性因素也可能造成SAP患者继发胰腺感染[5]。目前关于急性期感染的诱因和危险因素尚不明确,因此本实验主要通过对141名SAP患者进行分析,采用多因素Logistic分析影响SAP患者继发胰腺感染的独立危险因素,并讨论防治措施,以期为临床诊疗提供理论依据。
1 对象与方法
1.1 研究对象
选取2020年6月至2021年6月在东莞市人民医院消化内科收治的141名SAP患者,根据141名SAP患者入院治疗两周内是否发生胰腺感染进行分组:感染组(60例)和未感染组(81例)。本研究经我院伦理委员会审核批准通过。
纳入标准:①患者符合SAP临床诊断标准[6];②发病24 h内入院;③发病前及入院时无感染情况;④神志清楚无精神疾病;⑤年龄>18岁。
排除标准:①临床资料不完善者;②患有免疫性疾病;③恶性肿瘤;④合并妊娠,合并心血管系统疾病和肾功能不全者。
1.2 方法
1.2.1 临床资料收集 通过电子病历收集所有入选患者的临床资料,包括性别、年龄、体质量指数(body mass index,BMI)、急性生理与慢性健康评估(acute physiology and chronic health evaluation Ⅱ,APACHE-Ⅱ)评分、促动力药、生长抑制素及类似物、低氧血症、机械通气、应用抗菌药物、禁食时间、外科手术、器官衰竭个数、糖尿病史、胃肠功能障碍、胰性脑病。
1.2.2 治疗方法 141名SAP患者入院后均禁水、禁食、行规范胃肠减压及酶抑制剂应用,给予肠内营养支持治疗,促进肠道蠕动,维持水盐平衡和内环境稳定。
1.3 感染诊断标准
SAP患者继发胰腺感染的诊断标准[7]:①出现腹痛、反跳痛、压痛、肌紧张、肠鸣音减弱或消失;②具有畏寒、持续性发热、血压下降等脓毒血症症状(排除其他部分感染);③CT显示胰腺坏死范围增大且胰腺内或病理区出现气泡征;④血小板下降,C反应蛋白上调,外周血白细胞计数显著升高或降低,或未成熟粒细胞>10%;⑤腹水或胰腺坏死组织细菌培养呈现阳性。当患者出现上述症状中的两条或以上即可判断为SAP继发胰腺感染。
1.4 观察指标
1.4.1 血液生化指标检测方法
两组患者在入院后次日清晨采集空腹状态下的静脉血5 mL,4 ℃条件下经12 000 r·min-1离心15 min,将分离出的血清置于-80 ℃超低温冰箱保存并采用全自动生化分析仪检测两组患者外周血白细胞计数、C反应蛋白,血清淀粉酶采用碘-淀粉酶比色法测定、血清脂肪酶使用美国强生自动干式生化分析仪、血红蛋白含量用美国库尔特JT血球计数器测定。C反应蛋白:正常值为0~8 mg/L,>8 mg/L即为升高;血清淀粉酶:正常为23~300 U/L,>300 U/L即为升高;外周血白细胞计数:正常值为(4-10)×109/L,>10×109/L即为升高,<4×109/L即为降低;血清脂肪酶:正常为30~110 U/L,>110 U/L即为升高;血红蛋白:正常值为110~160 g/L,>160 g/L即为升高。
1.4.2 评分标准
APACHE-Ⅱ评分[8]:包括急性生理学评分、年龄评分、慢性健康状况评分三部分,分值越高病情越严重。
Ranson评分标准[9]:年龄>55岁;血糖>11.1 mmol/L;外周白细胞计数>16×109/L;血钙<2 mmol/L;乳酸脱氢酶>350 IU/L;谷草转氨酶>50 U/L;红细胞压积减少10%以上;动脉氧分压<8 kPa;血尿素氮增加>1.79 mmol/L;体液丢失>6 L。每项指标出现即积1分。累计得分≥3分,为SAP。
Balthazar CT评分标准[10]:胸腺实质及周围炎症改变,胰周轻度渗出(2分,C级);胰周渗出显著,胰腺实质内或胰周单个液体积聚(3分,D级);广泛的胰腺内、外积液,包括胰腺和脂肪坏死,胰腺脓肿(4分,E级)。评分为D或E级为SAP。
1.5 统计学方法
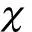
2 结果
2.1 SAP患者临床特点
141名SAP患者均出现腹痛、腹胀、恶心、呕吐、发热、黄疸、血尿淀粉酶升高等症状,并伴随肠鸣音减弱、移动性浊音、反跳痛、压痛、肌紧张等体征的出现。APACHE-Ⅱ评分均大于8分。CT、B超等影像学检查结果显示:141名患者均出现不同程度的胰腺肿大并伴有胰周渗出、胰腺坏死、腹腔积液和回声增强。发病早期便有51名患者出现器官功能衰竭,主要是呼吸功能和肾脏功能的衰竭。141名SAP患者中患胆源性SAP 50名(35.5%),患酒精性SAP 35名(24.8%),患高血脂性SAP 15名(10.6%),由暴饮暴食和手术创伤引起的SAP 28名(19.9%),其他因素13名(9.2%)。
2.2 两组SAP患者临床资料比较
根据治疗过程中是否产生继发性胰腺感染,将SAP患者划分为感染组和未感染组。两组的性别、BMI、促动力药、生长抑制素及类似物、胃肠功能障碍、外周血白细胞计数、C反应蛋白、血清淀粉酶、血清脂肪酶、血红蛋白、胰性脑病、Balthazar CT评分和Ranson评分无明显差异性(P均>0.05);感染组SAP患者年龄>60岁、APACHE-Ⅱ评分>12分、低氧血症、机械通气、禁食时间>21 d、外科手术、器官衰竭个数>4个、糖尿病史比例均高于未感染组,应用抗菌药物比例低于未感染组,差异有统计学意义(P均<0.05)。见表1。
2.3 多因素Logistic回归分析SAP患者治疗过程中继发胰腺感染的危险因素
将表1中两组间差异有统计学意义的因素纳入多因素Logistic回归分析中,结果显示,APACHE-Ⅱ评分>12分、低氧血症、机械通气、禁食时间>21 d、器官衰竭个数>4个、糖尿病史为SAP患者继发胰腺感染的独立危险因素(P<0.05),应用抗菌药物为SAP患者继发胰腺感染的保护因素(P<0.05),见表2。
2.4 预测SAP患者继发胰腺感染的列线图模型构建
将多因素回归分析中的独立危险因素和保护因素作为预测因子构建列线图模型,SAP患者APACHE-Ⅱ评分>12分、禁食时间>21 d、器官衰竭个数>4个、低氧血症、糖尿病史、机械通气、未应用过抗菌药物的评分分别为40分、25分、29分、31分、11分、43分和36分,总分数为215分,见图1。
2.5 列线图模型预测性分析
采用受试者工作特征曲线分析列线图模型预测SAP患者继发胰腺感染风险的区分度,列线图模型的AUC为0.905(95%CI:0.851~0.968,P<0.001),表明该列线图预测SAP患者继发胰腺感染风险的区分度较好。绘制列线图的校准曲线对列线图预测的准确度进行评估,A线的参考值=预测值,B线为拟合曲线,即事件发生概率,两边阴影代表95%CI,当事件发生率在0~18%时,模型高估风险,当事件发生率在18%~40%时,模型低估风险,当事件发生率在40%~75%时,模型高估风险,当事件发生率在75%~100%时,模型低估风险,而在18%、40%、75%时,模型预测和观察值完全一致,综合发现本模型的准确度较高。见图2。
表1 两组SAP患者胰腺感染指标单因素分析

表2 多因素logistic回归分析影响SAP患者继发胰腺感染危险因素分析

图1 SAP患者继发胰腺感染风险列线图
3 讨论
SAP继发胰腺感染是导致SAP患者病情加重的主要原因,占死亡患者中的比例高达50%~80%。研究表明,SAP患者中大约有30%在疾病后期会继发胰腺感染,但其病因和发病机制仍不清晰,这给临床防治带来了很大困扰。本研究收集了141名SAP患者,其中有60名(42.6%)发生胰腺感染,单因素分析结果显示,年龄>60岁、APACHE-Ⅱ评分>12分、低氧血症、机械通气、禁食时间>21d、外科手术、器官衰竭个数>4个、糖尿病史是SAP继发胰腺感染的危险因素,应用抗菌药物是SAP继发胰腺感染的保护因素,进一步通过多因素分析发现APACHE-Ⅱ评分>12分、低氧血症、机械通气、禁食时间>21 d、器官衰竭个数>4个、糖尿病史是SAP继发胰腺感染的独立危险因素,应用抗菌药物是SAP继发胰腺感染的保护因素,与陈东等[11]研究基本相同。年龄>60岁和外科手术作为独立危险因素的相关性较弱,可能与老年人体质较弱,手术过程的不确定性导致感染风险增加,也可能是因为样本量纳入不够,该差异还需要更多的临床数据进一部研究。SAP患者由于胰腺组织障碍,导致该组织供血不足出现坏死,而低氧血症可以加重这一过程,扩大炎症损伤程度[12];入院时的高APACHE-Ⅱ评分也说明SAP患者原发病情和胰腺组织坏死程度比较严重,而胰腺坏死程度越重,范围越大,细菌感染的风险也越高。SAP患者病发时体内血管通透性增加,炎性因子释放增多,促进中性粒细胞聚集,从而引起多个脏器受损[13],尤其是肺部,血氧饱和度下降,动脉血压分压低,呼吸系统发生感染的风险最大。随着患者器官不断衰竭,免疫功能持续下降,感染风险也在逐步增加。梁新文等[14]在对SAP患者继发感染的危险因素研究中发现,器官衰竭、低氧血症在感染组和未感染组之间有明显差异性(P<0.05),这与我们的研究结果一致。糖尿病患者高血糖水平和机体防御能力不足也会造成细菌感染[15]。机械通气属于一种有创操作,会增加SAP患者创口数,增大细菌感染的可能性,这与谢红、杨卫军等[16-17]研究结果一致。禁食时间越长,肠道黏膜萎缩越严重,导致肠道菌群紊乱或错位,增加胰腺感染的风险[18]。本研究发现应用抗菌药物是SAP患者继发胰腺感染的保护因素,这与李德辉等[19]研究结果一致。
针对上述危险因素,防治措施主要有:①早期提供肠内营养:加快胃肠黏膜恢复,改善微循环并预防肠道菌群紊乱和错位,进而减轻胰腺继发感染。Ji等[20]研究表明,SAP患者入院后的最佳肠内营养时间为24~48 h。一项最近的系统回归和荟萃分析表明SAP患者应于入院48 h内提供肠内营养[21]。近期也有研究表明[22]:入院24h进行早期肠内营养是安全有效的。国际指南方面,欧洲肠外肠内营养学会专家推荐24h内开展肠内营养,美国肠外肠内营养学会推荐24~48 h[23-24],因此如何定义早期,还需扩大样本量进一步分析。②增加组织供氧量:持续吸氧以提高血氧浓度,纠正酸中毒,减少因缺氧造成的胰腺组织坏死,必要时输注新鲜血液,但要避免使用有创机械通气措施。③预防性抗生素的使用:目前国际上对预防性抗生素的应用存在争议,可能与SAP患者的病情差异有很大关系,使SAP预防用药的临床结果不一。临床用药应谨慎考虑,谨防出现细菌耐药性和继发真菌感染。④掌握SAP手术适应症:避免因手术创伤造成的胰腺损伤和胰腺坏死组织暴露引起细菌繁殖进而引发胰腺感染的情况出现。⑤建立静脉通路:提高机体重要器官灌注量,改善胰腺损伤组织及促进全身微循环,减小感染的发生概率[25]。

图2 列线图模型预测性分析
综上所述,临床上应对APACHE-Ⅱ高评分、低氧血症、机械通气、是否应用抗菌药物、禁食时间>21 d、器官衰竭个数>4个、糖尿病史及时关注并采取有效的针对措施,降低SAP患者继发胰腺感染的风险。
