阴山北麓荒漠区6种植物群落的土壤细菌特征
2022-09-24蒋星驰李俊瑶李盛林温苏雅勒图王国林王少昆
蒋星驰, 李俊瑶, 陈 峰, 李盛林, 温苏雅勒图, 王国林, 王少昆
(1.中国科学院西北生态环境资源研究院,乌拉特荒漠草原研究站,甘肃兰州 730000;2.中国科学院大学,北京 100049;3.巴彦淖尔市乌拉特国家级自然保护区管理局,内蒙古 巴彦淖尔 015000;4.乌拉特梭梭林蒙古野驴国家级自然保护区乌拉特后旗管理站,内蒙古 巴彦淖尔 015543)
荒漠是我国北方重要的生态系统类型之一,干旱荒漠区气候条件恶劣,植物群落结构简单,以灌木、半灌木和小乔木为主要植被类型,其群落发育和分布对土壤微环境产生着重要的影响[1-2]。这些荒漠植物具有防风固沙和水土保持的功能,是构建我国北方绿色生态屏障和实施国家重大生态工程的重要基础资源,在维持荒漠区生物多样性和生态系统稳定性方面发挥着重要作用[3-4]。
土壤微生物在生态系统养分循环、有机质分解、土壤理化性质改善等方面发挥着重要功能[5],其多样性的下降和群落结构的简化会导致生态系统稳定性的降低[6];土壤微生物对环境变化非常敏感,因此用作衡量土壤质量的指标[7]。在荒漠生态系统中,土壤微生物通过分解作用和生化作用释放凋落物和土壤母质中的养分元素从而改善土壤[8];同时,由于高温、干旱等恶劣环境胁迫导致微生物死亡而释放胞内有机物[9],对荒漠生态系统土壤性质和植物生长产生影响。植物通过根系分泌物及其周转改变土壤微环境,从而影响土壤微生物群落结构和多样性组成[7,10]。地表植物是决定土壤微生物的关键因素[11-13],在相同的土壤环境条件下,种植不同植物显著改变了土壤细菌群落组成[14];大量研究结果表明,土壤pH 是影响土壤细菌群落组成最关键的影响因子之一[15-18];另外,土壤养分、土壤水分和土壤机械组成在不同程度上影响着细菌群落组成及其多样性[18-22]。国内有关荒漠植物对土壤微生物群落影响的研究已在塔里木荒漠区[23]、河西走廊荒漠区[2]、阿拉善荒漠区[24]等相继开展,但是在阴山北麓荒漠区的相关研究鲜见报道。
阴山北麓荒漠区位于内蒙古自治区巴彦淖尔市乌拉特后旗西北部,地处荒漠与草原过渡带,发育着红砂(Reaumuria songarica)、白刺(Nitraria tangutorum)、沙冬青(Ammopiptanthus mongolicus)、蒙古短舌菊(Brachanthemum mongolicum)、盐爪爪(Kalidium foliatum)、梭梭(Haloxylon ammodendron)等典型荒漠植物群落,这些荒漠植物在维持阴山北麓生态功能区生态系统的稳定性和服务功能方面发挥着重要的作用[25]。本研究以6种典型荒漠植物群落为研究对象,分析不同荒漠植物群落对土壤微生物多样性和群落组成的影响有何差异,确定造成这种差异的关键环境因子,阐明荒漠区植物-土壤-微生物之间的关系,为认识阴山北麓荒漠生态系统结构和功能提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于内蒙古巴彦淖尔市乌拉特后旗阴山北麓荒漠区,该区域属于温带大陆性干旱季风气候,春秋时间较短,夏季炎热干燥,冬季寒冷干旱;年均降水量为180 mm,其中7—8 月的降水量约占全年降水量的70%,蒸发量为降水量的10 倍左右;最低气温-34.4°C,最高气温37°C,年均气温5.3°C;地带性土壤类型为棕钙土和灰棕漠土[26-28]。主要植被类型以荒漠灌木、半灌木或小乔木为主,包括红砂、白刺、沙冬青、短舌菊、盐爪爪和梭梭等,伴生物种有沙生针茅(Stipa glareosa)、骆驼蓬(Peganum harmala)、蒙古韭(Allium mongolicum)、戈壁天门冬(Asparagus gobicus)等一年生或多年生草本植物。
1.2 研究方法
1.2.1 采样设计 分别选择以沙冬青(AM)、蒙古短舌菊(BM)、梭梭(HA)、盐爪爪(KF)、白刺(NT)和红砂(RS)为优势物种的典型荒漠植物群落为研究对象,荒漠植物群落基本信息如表1 所示。采用样线法在每种植物群落样地分别设置5条100 m长的平行样线,样线之间相距20 m,每条样线上相隔10 m设置1 个取样点,用直径为3 cm 的土钻钻取0~20 cm的土壤,将每条样线中6个取样点的土壤混匀作为1份样本,每类植物群落样地共计5份样本,每份样本过2 mm筛后分为3份。1份放置于无菌自封袋中低温保存,用以提取DNA 进行16S 高通量测序,分析其细菌群落组成;1 份装入铝盒用烘干法测定土壤含水率;1份风干后测定土壤的pH、电导率、机械组成、全碳和全氮含量。取样过程中所用设备使用75%酒精进行灭菌,以避免样品污染。
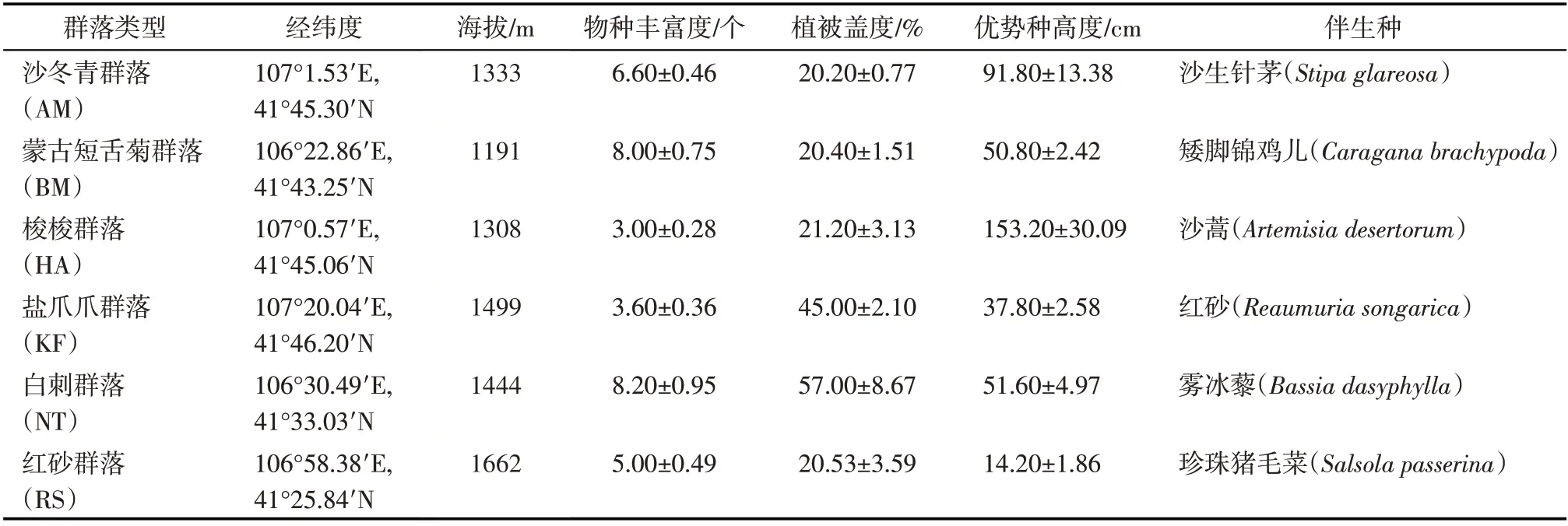
表1 不同荒漠植物群落基本信息Tab.1 Vegetation information of different desert plant communities
1.2.2 测定方法 土壤细菌群落组成采用高通量测序的方法测定。利用土壤DNA提取试剂盒,按照说明提取土壤总DNA,然后对土壤总DNA 进行PCR扩增,细菌(16S)扩增引物采用515F-907R[29],将PCR 产物纯化后对16S 中V3-V4 区域进行Miseq 扩增子测序。测序数据经过拼接、质控、去接头达到优化效果,按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列与OTU丰度表,其代表序列对应Silva数据库注释细菌不同水平的系统分类。
土壤pH(水土比为2.5:1)和电导率(EC)(水土比为5:1)分别采用SX800 的pH 探头和电导率探头测定,机械组成采用干筛法测定,土壤含水率(SWC)采用烘干法(105 ℃,12 h)测定,土壤全碳(TC)和全氮(TN)利用元素分析仪测定。
1.2.3 数据分析 土壤细菌的Alpha 多样性采用Chao1丰富度指数(式1)、Shannon多样性指数(式2)和PD 系统发育多样性指数(式3)衡量。研究采用基于物种多度的Bray-curtis 指数(式4)进行Beta 多样性计算,利用OTU 丰度数据计算Bray-curtis 距离矩阵,通过热图和主坐标分析(PCoA)进行可视化[30]。

式中:SChao1表示估计的OTU 数;Sobs表示实际检测到的OTU数;n1表示只含有1条序列的OTU数目;n2表示只含有2条序列的OTU数目;ni表示第i个OTU所含的序列数;N表示检测到的序列数总和;Li表示所有OTU构建的系统发育树中第i条分枝的长度;xij是物种i在群落j中的个体数;xik是物种i在群落k中的个体数。
差异性分析采用One-way ANOVA和LSD检验,相关性分析采用Pearson 相关,显著水平为P<0.05。可视化作图主要使用R包ggplot2[31],UpSet图使用R包UpSetR[32],PCoA 和RDA 的相关分析和绘制采用R包vegan[33]。
2 结果与分析
2.1 典型荒漠植物群落土壤理化性质
6种典型荒漠植物群落土壤的理化性质差异较大(表2)。HA 群落土壤粗砂(CS)含量显著高于其他植物群落,KF群落土壤粗砂含量显著低于其他植物群落,RS 和KF 群落的土壤黏粉粒(SC)含量显著高于其他植物群落;KF群落的土壤含水量(SWC)显著高于其他植物群落;6种植物群落土壤均呈碱性,其中,HA 群落土壤pH 最高,KF 群落土壤pH 最低;KF 群落的土壤电导率(EC)显著高于其他植物群落;KF和RS群落土壤全氮(TN)和全碳(TC)含量均显著高于其他4 个植物群落。总体来说,KF 和RS群落的土壤条件较好。
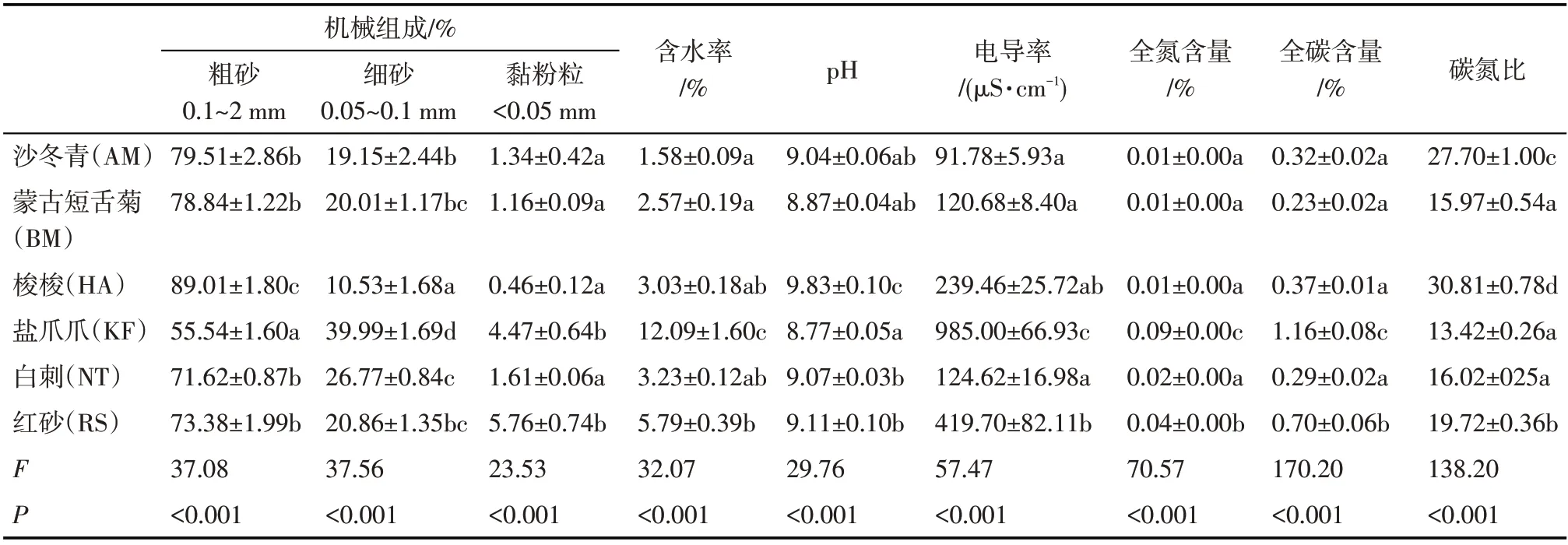
表2 不同荒漠植物群落土壤理化性质特征Tab.2 Characteristics of soil physicochemical properties in different desert plant community
2.2 土壤细菌群落组成
乌拉特荒漠草原6种典型荒漠植物群落土壤细菌群落组成存在一定差异。从OTU水平分析可知,6 中植物群落土壤细菌共有的OTU 种类数为1617种,不同植物群落土壤细菌OTU 总数表现出:HA>NT>BM>AM>RS>KF。KF 拥有最多的特有OTU 种类(255 种),其次分别为:HA(133 种)、RS(88 种)、BM(83种)、NT(51种)和AM(48种)(图1)。
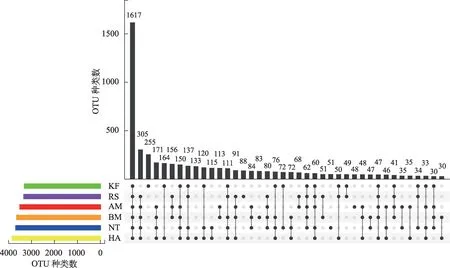
图1 基于OTU水平的UpSet图Fig.1 UpSet diagram based on OTU level
从细菌门水平群落组成分析可知,6 种荒漠植物对土壤细菌群落结构影响有一定差异(图2)。放线菌门(Actinobacteria)和变形菌门(Proteobacteria)为细菌优势菌门,分别占细菌总数的33.98%和26.48%,其中,放线菌门在AM、BM、HA、KF、NT、RS中分别占39.09%、32.49%、34.19%、25.69%、34.61%、37.36%,变形菌门在这6种植物群落土壤中分别占比为25.05%、31.90%、31.38%、24.02%、28.28%、18.27%。次优势菌门为绿弯菌门(Chloroflexi,8.23%)、酸杆菌门(Acidobacteria,6.35%)、拟杆菌门(Bacteroidetes,5.87%)、浮霉菌门(Planctomycetes,4.80%)、芽单胞菌门(Gemmatimonadetes,3.88%),厚壁菌门(Firmicutes,3.84%)和粘球菌门(Myxococcota,2.28%),优势菌门与次优势菌门占细菌总数的95%以上(图2a)。通过Kruskal-Wallis H 检验可知,放线菌门、变形菌门、绿弯菌门、拟杆菌门、浮霉菌门、芽单胞菌门和厚壁菌门所占比例在6 种植物群落之间差异显著(P<0.01)(图2b)。
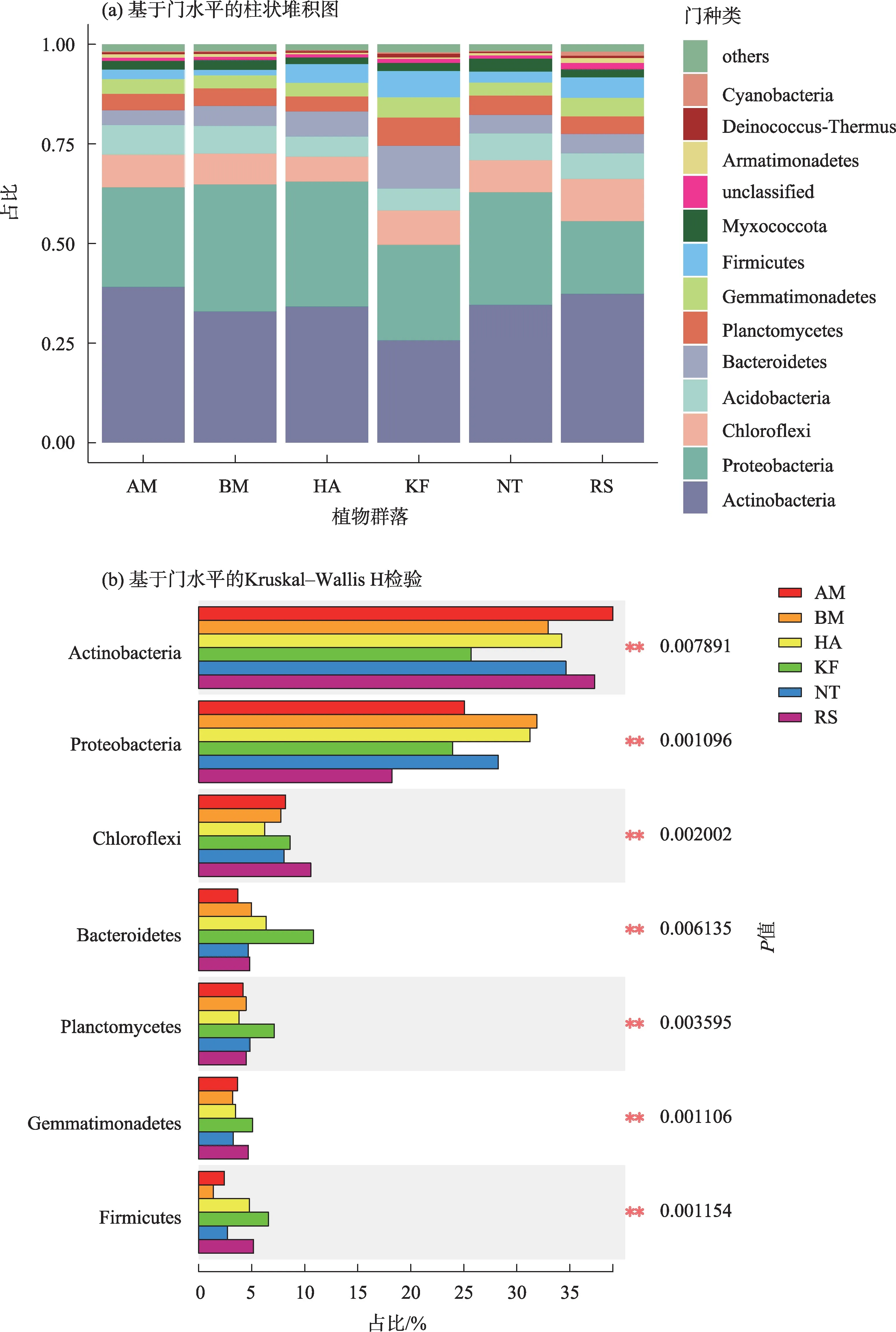
图2 基于门水平的细菌群落丰度Fig.2 Relative abundance of bacterial community at phylum level
2.3 土壤细菌多样性
不同植物群落土壤细菌Alpha多样性存在一定的差异(图3),RS 群落的土壤细菌丰富度Chao1 指数最低,且显著低于HA群落,其他群落之间无显著差异;土壤细菌Shannon 多样性表现为:KF>RS>BM>NT>HA>AM,其中,KF 群落的土壤细菌Shannon 指数显著高于AM、BM、HA 和NT 群落,RS 群落土壤细菌Shannon 指数显著高于BM、HA 和NT 群落;土壤细菌系统发育多样性PD 指数与丰富度Chao1 指数相似,RS 群落的土壤细菌PD 指数最低,且显著低于HA和NT群落。综上所述,RS群落土壤细菌多样性指数与其他植物群落差异较大。
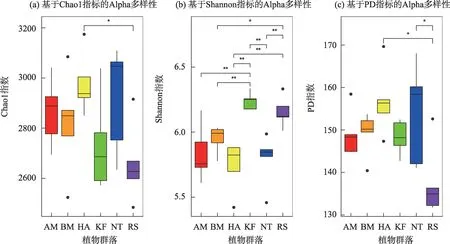
图3 不同植物群落土壤细菌Alpha多样性Fig.3 Soil bacterial alpha diversity in each community
利用Bray-curtis 指数计算Beta 多样性,通过热图可视化发现,AM 与BM、NT 与HA 的Beta 多样性接近,而KF 与RS、AM 和BM 群落的Beta 多样性差异较大(图4a)。进一步采用主坐标分析研究不同植物群落土壤细菌组成的Beta 多样性(图4b),从PCoA二维图可以看出,不同植物群落的土壤细菌群落能很好地聚在一起,其中RS和KF与其他群落分离明显,AM、BM、HA和NT群落聚在一起,且有部分重叠,说明RS 和KF 群落土壤微生物组成与其他4种植物群落有较大差异。PC1轴和PC2轴分别解释了细菌群落总变异的32.99%和24.11%,ANOSIM(P=0.001)分析结果表明,不同植物群落的土壤细菌Beta多样性差异显著。
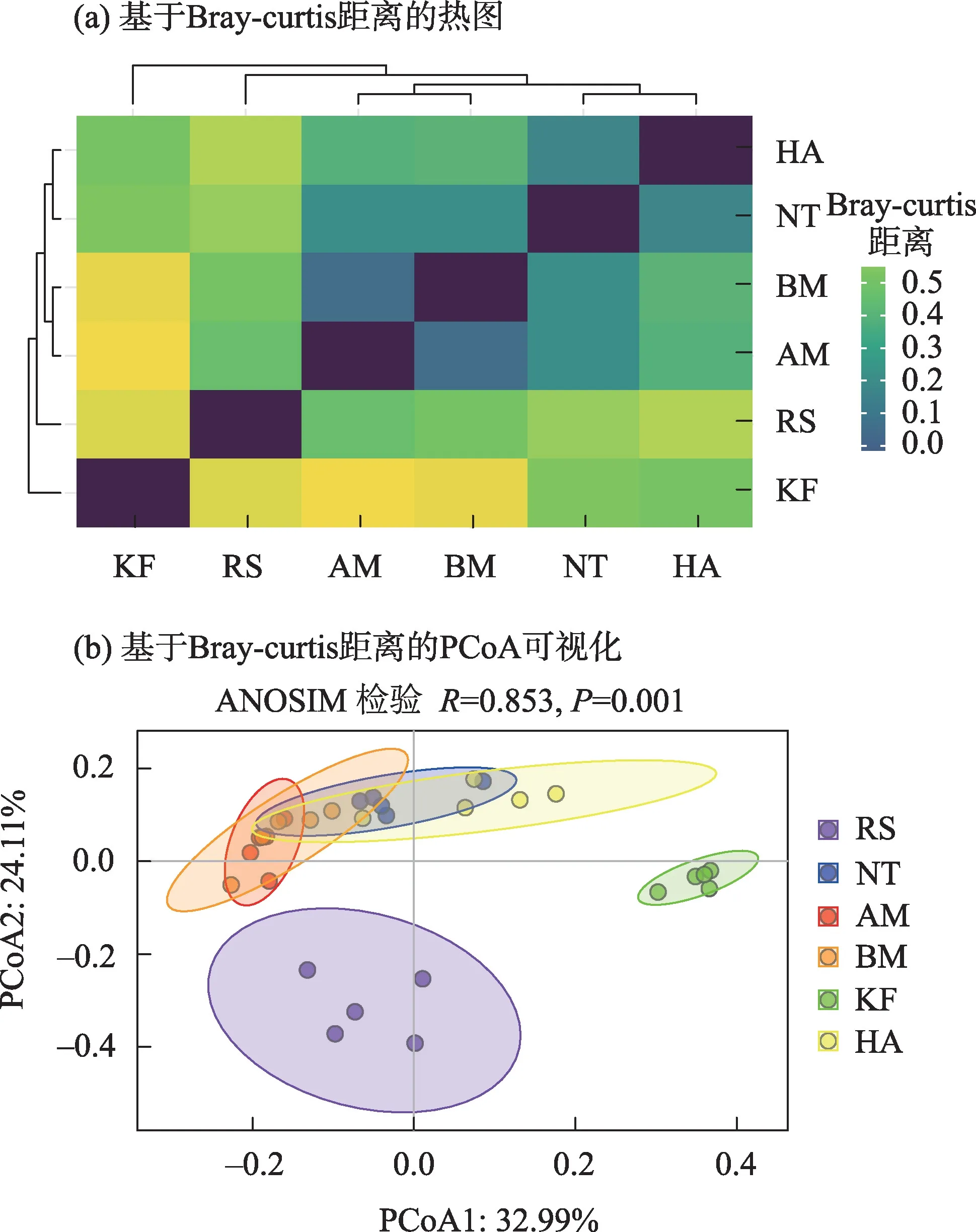
图4 不同群落土壤细菌Beta多样性Fig.4 Soil bacterial beta diversity in each community
2.4 土壤细菌群落与环境因子的关系
对门水平具有显著性关联(P<0.05)的环境因子(图5a),按照其关联的门水平数目,从大到小分别为:粗砂(CS,17 个)=全碳含量(TC,17 个)>细砂(FS,15个)=含水率(SWC,15个)=电导率(EC,15个)=全氮含量(TN,15 个)>黏粉粒(SC,12 个)>物种丰富度(SPE,11 个)>植被盖度(COV,10 个)>碳氮比(C:N,5 个)>优势种高度(HEI,3 个)>pH 值(pH,2个)。
土壤细菌群落与环境因子的Pearson 相关分析结果表明(图5b),细菌群落的PD 指数与优势种高度(HEI)显著正相关,与黏粉粒含量(SC)和物种丰富度(SPE)显著负相关;Chao1 指数与优势种高度(HEI)和粗砂(CS)显著正相关,与黏粉粒(SC)、电导率(EC)、全氮含量(TN)和碳含量(TC)显著负相关;Shannon 指数与黏粉粒(SC)、含水率(SWC)、细砂(FS)、电导率(EC)、全氮含量(TN)和全碳含量(TC)显著正相关,与优势种高度(HEI)、粗砂(CS)、pH值(pH)和碳氮比(C:N)显著负相关。
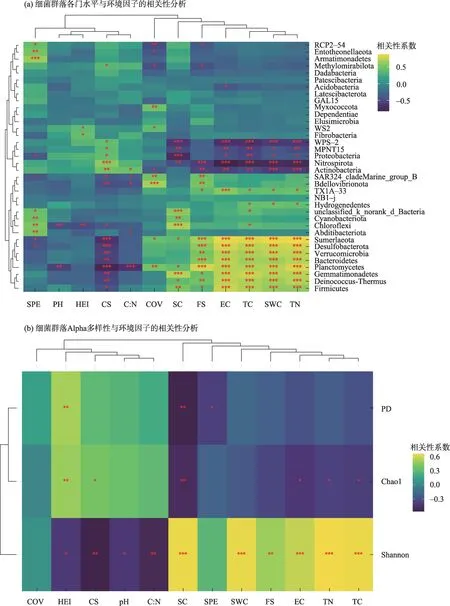
图5 环境因子与细菌群落的相关性分析Fig.5 Correlation analysis between environmental factors and bacterial community
为了进一步探究影响土壤细菌群落结构的环境因子,研究使用决策曲线分析(DCA)方法分析了细菌的OTU 数据,得到梯度长度(Lengths of Gradient)的第一轴长度为1.7455(<3),因此排序分析模型使用冗余分析(RDA)。以环境因子数据为解释变量,以土壤细菌OTU数据为响应变量构建的RDA分析结果表明(图6),解释变量与响应变量之间的相互关系50.01%可以被RDA 前两轴所解释,其中第一轴解释了30.17%细菌群落结构驱动信息,第二轴解释了19.84%细菌群落结构驱动信息。置换检验(置换次数为999 次)结果表明:RDA 全模型、RDA1轴和RDA2轴满足极显著相关(P<0.01),说明环境因子对土壤细菌群落结构有明显的驱动作用。对解释变量进行检验发现(表3),含水率(SWC)、粗砂(CS)、黏粉粒(SC)、pH 值(pH)和电导率(EC)是影响6 类土壤细菌群落结构的关键环境因子(P<0.05)。
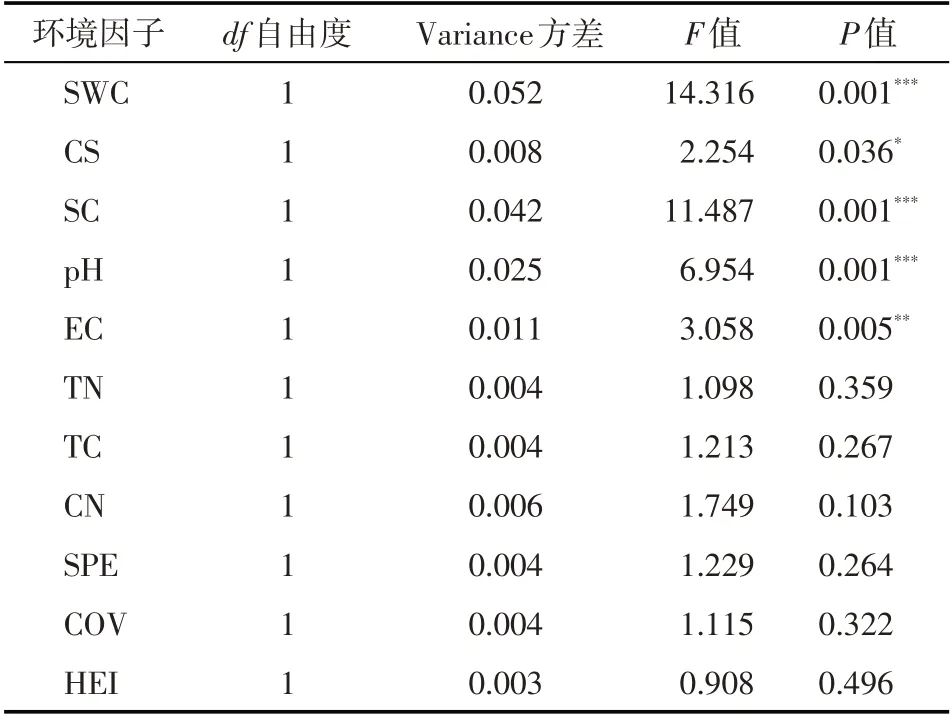
表3 基于RDA模型的环境因子置换检验Tab.3 Permutation test for RDA
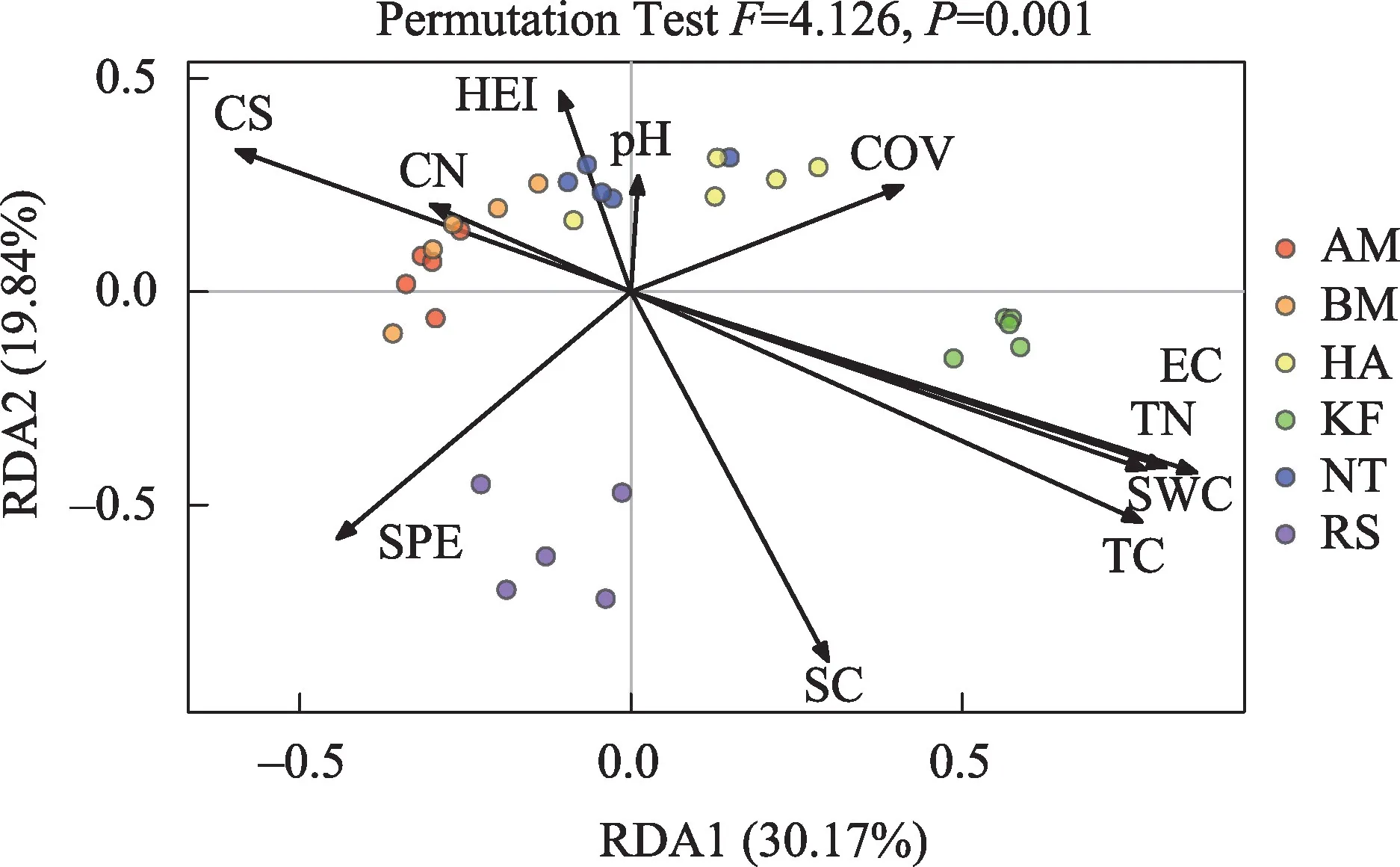
图6 基于OTU水平的细菌与环境因子的RDA分析Fig.6 RDA analysis of bacterial community at OTU level and environmental factors
3 讨论
3.1 阴山北麓荒漠区土壤细菌群落组成特征
研究中不同植被类型区域中存在特定的OTU种类,其中盐爪爪群落土壤细菌的特定OTU种类最多。这可能是因为盐爪爪在生长过程对Na+和Cl-有较高富集效果,在不同NaCl浓度下微生物的碳源代谢活性会发生变化,因此,该区域细菌群落的演变要适应高盐环境[34]。不同区域植被通过凋落物和根系分泌物驱动生境变化,环境过滤作用使部分细菌只能适应特定生境而在其他区域灭绝,最终形成区域特有的种类[14]。
本研究表明,不同植物群落中土壤细菌在门水平上均以放线菌门和变形菌门为优势菌,与相关研究保持一致[35-36]。这可能是因为放线菌门和变形菌门的胁迫环境功能适应能力强,有研究指出,放线菌具有的丝状结构和孢子形成机制,使它们在干旱环境中保持竞争优势,而变形菌门作为细菌中最大的一门,保持较高的物种丰富度与功能多样性[37-39]。在次优势菌门中,绿弯菌门可能因为在高温下生长良好并且有进行光合作用的能力[40],适应了阴山北麓荒漠区夏季白天高温、地表较裸露和光照时间长的条件占据了优势生态位;浮霉菌门与其他细菌门类存在关联,其中包括了芽单胞菌门,因为浮霉菌门的生长通常由群落中其他细菌提供的必需营养物质支持[41],在数据上也观察到浮霉菌门(平均丰度4.80%)和芽单胞菌门(平均丰度3.88%)的丰度接近。
3.2 土壤因子对土壤微生物的影响
不同的植被类型在调节生境小气候与输入植物源养分存在差异,进而影响到土壤理化性质与微生物群落的演替[42],笔者的研究也表明,不同区域的土壤理化性质存在差异,细菌门类群丰度不同,并且部分门类细菌与不同的环境因子显著相关,这可能是因为环境因子的组合驱动使不同微生物的生态位宽度变化。Shannon 多样性由于强调群落物种的均一性,在信息增益的机制下导致该指标对于群落变化更加敏感,环境因子的变化导致OTU丰度变化,Shannon指标就会变化;而Chao1指标与PD指标更多强调物种是否存在,所以对于环境因子的变动带来的物种丰度变化并不敏感;通过相关性分析发现,Shannon 指数与黏粉粒、含水率、细砂、电导率、全氮含量和全碳含量显著正相关,而这些指标与土壤营养状况相关,因此细菌群落的Shannon 指数一定程度上反映了土壤养分条件。
通过构建RDA分析,认为土壤含水率、粗砂、黏粉粒、pH和电导率是影响该区域土壤细菌组成的关键因子。有研究表明,土壤含水率通过改变微生物的生活条件,导致微生物结构多样性和活性的变化,潮湿环境下土壤微生物生长速度更快、有机物分解能力更强[43]。粗砂、黏粉粒的含量与土壤的机械组成相关,土壤粒径的组成会影响土壤内部空气与水分[44],而土壤颗粒越细,对碳、氮等营养物质的吸附能力越强[45],最终决定微生物的生长条件。以往的研究发现,pH对土壤微生物群落有重要影响[46-47],但pH 对不同生态系统中土壤微生物的影响机制尚不明确,因为pH 可能是金属离子浓度、水分、盐度等多类土壤特性的混合体[48],反映微生物复杂的生活环境。土壤电导率作为电化学特征,反映土壤盐分含量、养分状况和土壤含水率等理化信息,一定程度上反映土壤的养分状态[49],也是微生物可利用资源的体现。在干旱半干旱地区存在灌丛肥岛效应[50],植被的冠幅形状会影响风沙沉积与局部遮阴,凋谢物和分泌物影响了土壤有机物输入状况,这些都直接或间接影响了局部生境,因此,不同的植被类型对土壤细菌群落结构施加的影响存在差异。本研究区域阴山北麓荒漠区植被稀疏,土壤干燥贫瘠,有限的土壤水分与营养资源对微生物群落显得尤为重要,最终表现为土壤含水率、机械组成、pH和电导率对细菌群落有显著驱动作用。
4 结论
阴山北麓荒漠区6种典型荒漠植物群落土壤细菌的优势类群均为放线菌门(Actinobacteria)和变形菌门(Proteobacteria),两者占细菌总数的60%以上,盐爪爪与红砂群落的土壤细菌Shannon多样性指数显著高于其他植物群落。研究表明,荒漠植物群落的土壤细菌Shannon多样性对环境变化的响应更敏感,且土壤水分和养分越好,细菌Shannon 指数越高;土壤含水率、机械组成、pH和电导率共同驱动了土壤细菌群落结构组成,这4 类土壤因子对于荒漠土壤健康至关重要。
