感染微小隐孢子虫绵羊的血常规及血清抗体动态变化
2022-09-23张世杰米荣升张晓丽王进香韩先干龚海燕陈兆国
张世杰,米荣升,张晓丽,王进香,孙 滔,黄 燕,韩先干,龚海燕,赵 权,陈兆国
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所 农业农村部动物产品质量安全生物性危害因子风险评估实验室(上海)农业农村部动物寄生虫学重点实验室,上海 200241;3.宁夏回族自治区动物疾病预防控制中心,银川 750011)
隐孢子虫(Cryptosporidiumspp.)是人兽共患肠道寄生性原虫,能够引起隐孢子虫病(cryptosporidiosis),以腹泻为主要临床症状。该病属于自限性疾病,正常个体感染后一般腹泻7~14 d即可自愈,然而对免疫低下或免疫缺陷的个体可致急性腹泻,甚至死亡,或转为慢性持续感染。该病在世界性范围内均有报道,危害极大,严重威胁人和动物的健康[1]。但是,目前尚没有有效的疫苗或药物可有效预防和治疗该病[2]。
微小隐孢子虫(Cryptosporidium parvum)是重要的人兽共患的隐孢子虫虫种[3],该虫种最早是1912年Tyzzer在小鼠体内发现的[4]。研究报道,C.parvum具有广泛的宿主,可以感染包括人在内的多种动物,例如牛、羊、马、羊驼、犬、大鼠、小鼠、松鼠、浣熊、兔等[5-7]。由于C.parvum是感染人的主要虫种之一,因此当前关于隐孢子虫致病机理、药物筛选、疫苗研发等方面的研究,绝大多数以C.parvum为研究对象[8]。然而,C.parvum目前并没有合适的细胞体外培养体系,当前的培养体系仅能够完成隐孢子虫一个生活史阶段,并不能持续进行传代[1]。因此,隐孢子虫的传代保种还是以动物体内繁殖为主。目前报道的C.parvum感染动物模型主要有牛、羊、猪、大鼠、小鼠等[9-16],但并不是所有动物模型均适合C.parvum的繁殖,一些动物需要进行免疫抑制或免疫缺陷才能够产生少量的C.parvum卵囊。现有的研究发现,犊牛是C.parvum的最适宿主,感染后能排出大量的卵囊[9],然而利用犊牛做动物模型,对试验场地要求比较高,而且价格昂贵。为寻找合适的、价格低廉的C.parvum动物感染模型,本实验室前期进行了C.parvum感染ICR小鼠和绵羊的实验,发现小鼠免疫抑制后仅能产生少量的卵囊,不适合C.parvum的传代保种(未发表);而绵羊接种1×106个C.parvum卵囊就能致病,并排出大量的卵囊,适合作为C.parvum的感染模型[17]。
血常规检查是临床上最常用的化验方法之一,在人医的临床检查中普遍应用,而兽医临床上的则应用的较少,检查结果能够为疾病的诊断提供科学依据,对临床和科研都具有重要意义[18]。本研究利用实验室前期建立的C.parvum绵羊感染模型,对新生羔羊进行C.parvum接种,观察绵羊感染隐孢子虫后的临床症状、血液生理指标和血清抗体变化情况,为今后进行羊感染隐孢子虫的临床诊断和抗体诊断提供数据参考。
1 材料与方法
1.1 试验材料C.parvum卵囊、贝氏隐孢子虫(C.baileyi)DNA和C.parvum全抗原免疫兔阳性血清由中国农业科学院上海兽医研究所动物源性病原生物学及食品安全创新团队保存;2日龄绵羊购自上海永辉羊业有限公司;羔羊代乳粉购自杭州思我特农业科技有限公司;BCA蛋白定量试剂盒、兔抗羊IgG H&L(HRP)购自美国Abcam公司;脱脂奶粉(Difco Skim Milk)购自美国BD公司;TMB显色液购自天根生化科技(北京)有限公司;DNA提取试剂盒(Fast DNA SPIN Kit for Soil)购自美国MP公司;AxyPrep DNA凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;pMD18-T载体、PremixEx TaqTM酶、100 bp DNA marker购自宝日医生物(北京)有限公司;Trans1 T1感受态细胞购自北京全式金生物技术有限公司;其他试剂均为市售、国产分析纯或更高级别试剂。
1.2 羔羊接种 选取4只体重接近的2日龄羔羊,分笼饲养,连续3 d收集羔羊粪便,用饱和蔗糖漂浮法进行镜检[19],隐孢子虫为阴性的羔羊用于后续试验。实验分为感染组和对照组,每组2只。感染组将新繁殖的C.parvum卵囊与少量羊奶混合,经口饲喂羔羊,每只羊接种1×106个卵囊;对照组以等量羊奶饲喂。
1.3 羔羊临床症状观察及样品采集 每天记录羔羊的采食量,并观察羔羊的临床症状。每3 d测量羔羊的体温和体重,用无菌棉拭子直接从肛门采集粪便样品,放入10 mL离心管中,-20℃冻存,用于排卵囊数检测。每3 d颈静脉采血,一部分加入含乙二胺四乙酸二钾(EDTA-K2)抗凝剂的离心管中混匀,1 h内进行血常规检测;另一部分转入无菌1.5 mL离心管中,37℃静置2 h,5000 ×g离心5 min,分离血清,-20℃保存,用于抗体效价检测。
1.4 羔羊临床症状计分 根据羔羊的精神状态、食欲和排便情况进行计分,计分方法如下[20]:1)精神状态的评分标准:反应正常,计1分;反应迟缓、能够站立,计2分;反应迟缓、人工帮助可以站立,计3分;反应迟缓、无法站立,计4分。2)羔羊的食欲评分标准:食欲正常,计1分;食欲减退、可以自己吸允,计2分;食欲明显减退、需要人工灌喂,计3分;食欲废绝、人工灌喂难以进食,计4分。3)羔羊排便情况计分标准:固体、成型,计1分、粪便松散、不成型,计2分、轻度腹泻,计3分、水样便,计4分。
1.5 羔羊感染隐孢子虫的鉴定 收集腹泻阶段的羔羊粪便,用饱和蔗糖漂浮法进行富集[21],镜检(400×)是否含有隐孢子虫。同时,提取粪便样品DNA,用隐孢子虫小亚基核糖体DNA(SSU rDNA)基因的套式PCR进行扩增[22],胶回收目的片段,送赛默飞世尔科技(中国)有限公司进行测序,鉴定绵羊感染的隐孢子虫是否为C.parvum。
1.6 羔羊血常规检测 用全自动动物血液细胞分析仪(深圳迈瑞生物医疗电子有限公司,型号BC-5300Vet)进行血液指标分析,主要包括白细胞、红细胞和血小板三大类。其中白细胞检测指标包括白细胞(white blood cell, WBC)总数,中性粒细胞(neutrophil, Neu)、淋巴细胞(lymphocy,Lym)、单核细胞(monocytes, Mon)、嗜酸性粒细胞(eosinophils, Eos)、嗜碱性粒细胞(Bas)数目,中性粒细胞(Neu)、淋巴细胞(Lym)、单核细胞(Mon)、嗜酸性粒细胞(Eos)和嗜碱性粒细胞(Bas)百分比等11项;红细胞检测指标包括红细胞数目(red blood cell, RBC)、血红蛋白浓度(hemoglobin, HGB)、红细胞压积(Hematocri,HCT)、平均红细胞体积(mean corpuscular volume, MCV)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin, MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、红细胞分布宽度变异系数(RDWCV%)和红细胞分布宽度标准差(RDW-SD)等8项;血小板检测指标包括血小板数目(blood platelet patients, PLT)、平均血小板体积(mean platelet volume, MPV)、血小板分布宽度(Platelet distribution width, PDW)和血小板压积(PCT%)等4项。检测方法如下:移液器吸取含EDTA-K2抗凝剂的绵羊血液样品20 μL,置于仪器吸样针垂直下方(注意吸样针不能接触离心管底部,样品不能有凝血块),启动仪器,吸取样品,进行数据读取,每个样品重复测3次。
1.7 羔羊特异性血清IgG检测
1.7.1 微小隐孢子虫卵囊可溶性抗原的制备 取保存在2.5%重铬酸钾溶液中的C.parvum卵囊,进行Sheather's蔗糖密度梯度离心纯化[21],用白细胞计数板进行计数。取纯化后的卵囊1×108个,液氮反复冻融5次,超声破碎30 min,24 000 ×g离心30 min,收集上清液[23]。BCA试剂盒测定全抗原浓度,分装,保存于-80℃,备用。
1.7.2 羔羊特异性IgG抗体检测 用ELISA方法进行羔羊特异性IgG抗体水平检测[24],其中全抗原的包被浓度为2 μg/mL,羔羊血清用5%脱脂奶粉按1∶100稀释,兔抗羊二抗进行1∶5000稀释,用酶标仪检测OD450数值。每孔重复3次,同时设阳性对照(C.parvum全抗原免疫兔阳性血清)、阴性对照(实验室保存隐孢子虫阴性健康绵羊血清)和空白对照(以PBST代替血清做一抗孵育)。当阳性孔OD450≥0.5,且阴性孔<0.5视为有效,待测样品孔OD450值/阴性孔OD450值≥2.1,判断为阳性。
1.8 粪便样品排卵囊情况检测
1.8.1 标准品的制备 取1×108个C.parvum卵囊,提取DNA;扩增SSU rDNA基因全长,连接到pMD18-T载体,制备pMD-CpSSUrDNA重组质粒[25];用NanoDrop测定重组质粒的浓度,计算拷贝数;将重组质粒进行10倍倍比稀释(102~108copies/μL),作为标准品[25]。
1.8.2 样品检测 采集羔羊感染前和感染后粪便样品,其中感染后样品从第3 d开始采集,每3 d采集一次,直至实验结束的第30 d。提取所有粪便样品DNA,应用基于TaqMan探针的荧光定量PCR方法,扩增标准本和待检样品,计算排卵囊数量[25]。每个样品重复3次。
1.9 数据分析 血常规数据采用平均值±标准差(||±s)表示,通过SPSS 21.0软件,对获得的数据进行单因素方差分析(one-way ANOVA),采用最小显著差异法(least significant difference, LSD)比较同一时期的感染组和对照组各个血常规数值是否存在显著性差异[26]。当P>0.05时,判定为差异不显著,不具有统计学意义;当P≤0.05时,判定为差异显著,具有统计学意义;当P<0.01时,判定为差异极显著,具有统计学意义,。
2 结果
2.1 临床症状观察 对羔羊进行的体温检测结果表明,感染组和对照组羔羊体温变化不明显,均在绵羊正常的体温变化范围内(38.3℃~39.9℃)波动,其中感染组羔羊体温在38.6℃~38.9℃之间波动,对照组在38.5~38.9℃之间波动(图1A)。感染组羔羊在隐孢子虫感染初期(3~12 d)体重增加缓慢,后期逐渐增加,实验结束后感染组羔羊的体重(5.44±0.05 kg)显著低于对照组(5.96±0.18 kg)(P<0.05)(图1B)。羔羊每日的摄奶量呈逐渐增多趋势,两组羔羊初期的摄奶量均在5.5 L/d左右,但是感染组羔羊在感染后的第3~5 d明显下降,最低只有1.9 L/d,随后逐渐上升,中间会出现小幅度的下降,而对照组羔羊摄奶量则每日稳步升高,期间个别天出现少量的下降(图1C);食欲评分结果与摄奶量结果相似,感染组3~12 d出现不同程度的厌食情况,4~5 d食欲明显降低,而对照组食欲正常(图1D)。粪便评分结果显示,整个实验过程中感染组羔羊粪便以松散、不成型状态为主,其中6~9 d出现腹泻现象,但是未见明显的水样便,而对照组羔羊粪便多数时间正常,但个别时间出现松散不成型现象(图1E)。感染组羔羊在第3~12 d出现反应迟缓现象,其余时间状态正常,未出现羔羊无法站立现象;而对照组羔羊在绝大多数时间内精神状态均正常,但是在3~7 d出现轻微的反应迟缓现象(图1F)。

图1 绵羊感染隐孢子虫的临床症状Fig.1 Clinical symptoms of Cryptosporidium infection in sheep
2.2 羔羊感染隐孢子虫的镜检及分子鉴定 在感染组羔羊腹泻严重期,同时收集感染组和对照组粪便,用Sheather's蔗糖漂浮法进行镜检。结果发现感染组羔羊样品在显微镜下观察到隐孢子虫卵囊(图2),而对照组未发现隐孢子虫卵囊。提取两组样品的DNA,用套式PCR进行扩增,并且对产物进行电泳鉴定。结果发现感染组的两只羔羊样品均能够扩增出阳性条带,与目的片段的大小一致(830 bp),而对照组两只羔羊样品扩增结果为阴性(图3)。对阳性样品的PCR产物进行切胶回收,进行测序,获得的序列经BLAST比对为C.parvum。

图2 隐孢子虫显微镜检结果Fig.2 The results of microscopic examination of Cryptosporidium

图3 隐孢子虫分子鉴定结果Fig.3 The results of molecular identification of Cryptosporidium oocysts
2.3 羔羊感染隐孢子虫的血常规分析
2.3.1 白细胞变化情况 本研究对11项白细胞指标进行了检测,结果发现感染组WBC#显著高于对照组(P<0.05),WBC的平均数量在5×1010/L左右,而对照组在2.5×1010/L左右(图4A)。感染组WBC和Neu的数量均是在感染后的第3 d开始升高,第9 d达到最高,随后开始下降,其中WBC在第21 d降至最低,随后继续升高(图4A),而Neu在感染后的第24 d降至最低,随后继续升高(图4B)。Neu%变化趋势和Neu变化趋势相同,均是第9 d达到峰值,随后开始下降,第24 d降至最低,随后再升高,但是对照组Neu%也出现相同的变化趋势(图4C)。感染组和对照组Lym的数量呈交替变化趋势(图4D),但是Lym%则是对照组高于感染组,并且呈现逐渐下降的趋势(图4E)。感染组和对照组中Mon、Mon%、Eos和Eos%均相似,均是前期变化很小,但是21 d以后出现不同程度的升高(图4F~I)。与之相反,感染组和对照组中Bas,除第21 d降低之外,总体呈上升趋势(图4J),但是两组中的Bas%相似,均在0.1%左右(图4K)。

图4 绵羊白细胞动态变化情况Fig.4 Dynamic changes of white blood cells in sheep
2.3.2 红细胞变化情况 对红细胞相关指标的分析,发现RBC的数量、HGB和HCT变化均是感染组低于对照组,在感染后的第6~9 d达到峰值,随后开始下降,感染后期又呈现上升趋势(图5A-C)。而MCV、MCH、RDW-CV和RDW-SD均是感染组高于对照组(图5D、5E、5G、5H);其中MCV和RDW-SD呈逐渐下降的趋势(图5D、5H),在第21 d稍微升高;MCH则是缓慢下降(图5E);而RDW-CV开始变化不明显,在第21 d急剧下降(图5G)。感染组MCHC在感染初期浓度逐渐上升,12 d达到峰值,随后开始逐渐下降,而对照组MCHC呈缓慢上升趋势(图5F)。

图5 绵羊红细胞动态变化情况Fig.5 Dynamic changes of red blood cells in sheep
2.3.3 血小板变化情况 本研究对4个血小板指标进行了检测,结果发现感染组PLT和PCT均高于对照组,其中感染组PLT在第9 d和第18 d出现两个高峰,PCT在第9 d和第24 d出现两个高峰,而对照组中PLT和PCT均在第6 d出现一次高峰,随后开始下降,至第12 d降至最低,随后开始逐渐升高(图6A、6D)。对照组的MPV和PDW均高于感染组,并且两组数值在整个实验过程中基本保持恒定,只有个别时间出现变化,其中感染组和对照组MPV均在第24 d升高,而对照组PDW在第3 d和第27 d均下降(图6B、6C)。

图6 绵羊血小板动态变化情况Fig.6 Dynamic changes of platelet in sheep
2.4 血清中特异性IgG抗体动态变化 利用间接ELISA法检测血清抗体效价,阳性孔OD450平均值为0.78,阴性孔平均值为0.16,空白孔平均值为0.13,阳性孔/阴性孔(P/N)=4.90,大于2.1,表明实验数据有效。对感染组和对照组血清IgG的检测发现,感染组于感染后第3 d即呈阳性,随后开始下降,一直持续到实验结束,而对照组血清抗体P/N比值均小于2.1,均为阴性。感染组血清抗体水平除第18 d出现小的上升以外,整体呈下降趋势,其中第3 d的抗体水平最高。统计学分析表明,第3 d和第6 d抗体效价差异不显著(P>0.05),9~30 d抗体效价与第3 d差异极显著(P<0.01)(图7)。
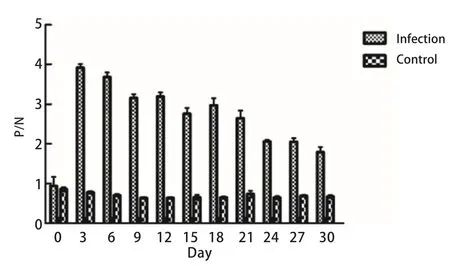
图7 绵羊血清抗体变化情况Fig.7 The variety of serum antibody (IgG) in sheep
2.5 羔羊排卵囊情况 为检测羔羊排卵囊情况,取1×108个C.parvum卵囊,制备基于C.parvumSSU rDNA基因全长的重组质粒(pMD-CpSSUrDNA),以不同稀释度的pMD-CpSSUrDNA为模板,用荧光定量PCR方法扩增标准样品,获得的标准曲线R2值为0.9982,可以用于未知样品的检测(图8A)。提取感染组两只羔羊粪便样品DNA,进行荧光定量PCR检测,结果表明1号羔羊第6 d为排卵囊高峰,2号羔羊第9 d为排卵囊高峰期,后面均出现一个小的排卵囊高峰(图8B)。
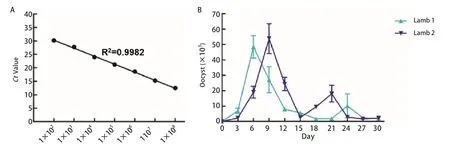
图8 实时荧光定量PCR标准曲线及绵羊排卵囊情况Fig.8 Standard curve of quantitative real-time PCR method and the number of oocysts excretion in sheep
3 讨论
隐孢子虫是重要的人兽共患寄生虫,能够感染包括人在内的多种动物,全世界范围内均有畜禽感染隐孢子虫的报道,给养殖业带来了巨大的经济损失[27]。目前隐孢子虫并没有有效的疫苗和药物进行预防和治疗,对该病的及早诊断具有重要意义。虽然已经有很多关于绵羊感染C.parvum的报道,甚至一些地区C.parvum是绵羊感染的优势种[28],但是自然感染的绵羊,多数体内隐孢子虫的数量较少,绵羊的症状并不明显,所以目前尚不清楚绵羊感染隐孢子虫的临床症状。因此,本实验对绵羊进行人工感染C.parvum,观察绵羊感染后的摄奶量、体温、精神状态、排便情况等临床指标的变化。研究结果发现,羔羊感染1×106个卵囊,体温变化不明显,但能够延缓羔羊增重,感染高峰期会影响羔羊的摄奶量。但是,羔羊并未出现非常严重的水样腹泻,食欲废绝等症状,这可能与接种剂量有关。实验室之前的研究发现,羔羊接种1×107个卵囊,能够显著致病,羔羊发生严重的水样腹泻,并在第10 d左右发生死亡;而接种1×106个卵囊,仅在第一次排卵囊高峰期症状比较明显,后期羔羊会逐渐恢复正常[17]。与绵羊的研究相反,对1日龄山羊进行的研究发现,经口接种1×106个卵囊,羔羊出现严重的腹泻,并且第14 d发生死亡[14],而对两只4日龄山羊接种1×105个卵囊的研究发现山羊的临床症状并不明显[10]。这些差异可能与羊的品种有关,不同种类的羊,C.parvum的致病性不同。
血常规检查是疾病诊断和监测的重要参考指标,其中白细胞主要功能是杀灭细菌、病毒、寄生虫等异物,参与体内免疫发生过程;红细胞主要是携带和运输氧气,以满足机体生理活动和运动的需要;血小板在止血、伤口愈合、炎症反应、血栓形成及器官移植排斥等生理和病理过程中有重要作用[18,26,29-30]。本研究对绵羊感染C.parvum后的血常规分析表明,WBC和PLT数量增多,而RBC数量减少。WBC在第一次排卵囊高峰期(6~9 d)出现明显的升高,说明羔羊发生了严重的炎症反应;而RBC降低,推测绵羊感染C.parvum后可能出现了贫血现象;PLT增多说明血小板生成能力增强,参与宿主对炎症反应的抵抗。当前,关于绵羊感染隐孢子虫后的血常规变化未见报道,但是其他动物感染隐孢子虫后的血常规分析有少量报道。有研究表明,C.parvum感染大鼠后,对WBC、RBC和HGB进行的检测,发现大鼠的RBC和HGB下降,WBC增多[15],这与本研究在绵羊上获得的结果一致。但是,用仔猪接种人隐孢子虫(C.hominis),在实验结束的第13 d进行血常规分析,发现WBC增多、RBC减少,然而与对照组相比差异不显著(P> 0.05)[31],由于该研究仅在实验结束后进行了检测,并未在隐孢子虫感染的高峰期进行检测,这可能是本研究与该报道存在不同的原因。此外,对于其他寄生虫血常规的检测,也存在差异。例如,用日本血吸虫(Schistosoma japonicum)感染东方田鼠和BALB/c小鼠,发现东方田鼠WBC在感染后的第1~16 d均显著高于感染前(0 d),而BALB/c小鼠只在第5 d和第16 d高于感染前[32];用斯氏艾美耳球虫(Eimeria stiedai)感染新西兰兔,发现WBC显著升高,但是PLT显著减少[33];用人芽囊原虫(Blastocystishominis)感染SD大鼠,发现WBC和PLT均增多,但是WBC#与对照组差异不显著[34]。这些结果说明,不同种属寄生虫感染宿主以后,宿主血常规的变化存在差异,但是普遍WBC数量增多。
白细胞包括单核细胞(Mon)、淋巴细胞(Lym)、中性粒细胞(Neu)、嗜酸性粒细胞(Eos)和嗜碱性粒细胞(Bas)等5种,不同细胞,功能存在差异。Neu具有活跃的变形运动和吞噬功能,当病原微生物入侵机体时,Neu通过变形运动从血管内皮细胞间游出,趋向炎症区,并通过细胞内溶酶体释放的蛋白水解酶将其消化,防止病原微生物在体内的扩散;Mon主要功能是激活淋巴细胞,还具有吞噬杀灭病原体等作用;Lym是重要的免疫活性细胞,参与动物机体的细胞免疫,具有先天性的抗病能力;Eos能够吞噬外源病原体,Bas主要是参与超敏反应[26,29,30,35]。本研究发现绵羊感染C.parvum后,Neu和Neu%均显著升高,这与之前用C.hominis感染仔猪后的研究结果相似,该研究也发现Neu%显著升高[31]。对于其他寄生虫感染宿主的报道也存在相似的结果:例如,用东方田鼠感染S.japonicum后,Neu显著升高,但是感染BALB/c小鼠后Neu差异不显著[32];用芽囊原虫感染SD大鼠后,Neu显著高于对照组[35]。这些结果提示我们,Neu可能在抗寄生虫感染的过程中发挥重要作用。此外,本研究发现感染组Mon和Bas增多,提示隐孢子虫感染后发生了严重的炎症反应。然而,Lym基本上没有变化,而Eos后期呈上升的趋势,但是低于对照组。之前的研究结果显示,人感染恰氏利什曼原虫(Leishmania chagasi)后,Eos显著升高[36];新西兰兔感染E.stiedai,Eos显著升高[33];BALB/c小鼠感染S.japonicum后,Eos和Lym显著升高;而东方田鼠感染S.japonicum后,Mon、Bas、Eos和Lym均显著升高[32]。这些研究结果表明,不同种寄生虫感染宿主后,不同类型白细胞的变化存在很大差异。
应用ELISA检测方法,本研究对绵羊感染隐孢子虫后的血清IgG水平进行了检测,发现绵羊感染的第3 d抗体即达到最高值,随后开始下降,直到实验结束抗体仍然维持在较高水平。该结果与之前对自然感染和人工感染的羔羊的抗体检测结果相一致,该实验也发现绵羊感染C.parvum后,第3 d天就能够检出抗体,直到实验结束的第30 d抗体依然存在[12]。此外,以NMRI(Naval Medical Research Institute)小鼠为实验模型,接种5×105个C.parvum卵囊,从第6 d开始检测,发现第6 d即为抗体效价的最高峰,直到实验结束(18 d),抗体效价一直很高[37]。这些研究表明,隐孢子虫感染宿主后,宿主抗体效价会很快上升,而且能够持续很长时间,但具体持续时间还有待进一步的实验进行验证。
本研究应用实时荧光定量PCR方法,对绵羊感染隐孢子虫后的排卵囊情况进行了检测。该方法为本实验室前期建立,用基于隐孢子虫SSU rDNA基因的TaqMan探针进行检测,最低能检出0.1个卵囊,具有很好敏感性和特异性,适合多种隐孢子虫感染的定量检测[25]。应用该方法,本研究发现绵羊存在两个排卵囊高峰期,第1个高峰期为急性感染期(第6~9 d),绵羊排出大量的卵囊,第2个高峰期(第21~24 d)仅排出少量卵囊,这主要是由于隐孢子虫感染宿主以后,在排出体外之前,形成薄壁卵囊和厚壁卵囊,少量薄壁卵囊能够再次感染宿主[1]。然而,该结果与之前本实验室对绵羊感染C.parvum的排卵囊曲线略有不同,之前发现C.parvum感染后存在3个排卵囊高峰期[17],这可能与本实验是每3 d检测一次有关,漏掉了中间可能出现的排卵囊高峰,而之前的研究是每天检测一次。
综上所述,本实验以绵羊为动物模型,对绵羊接种C.parvum以后的临床症状、血常规变化、抗体效价以及排卵囊情况进行了评价。研究发现绵羊接种1×106个卵囊后,能够影响羔羊的摄奶量和增重,而羔羊的食欲、精神状态和排便情况在感染高峰期比较明显,其他时间症状不明显。对绵羊感染C.parvum后的血常规检测发现,WBC和PLT数量增多,RBC数量下降,白细胞中Neu和Bas升高,提示羔羊感染隐孢子虫发生严重的炎症反应。此外,羔羊感染隐孢子虫后第3 d就可以产生抗体,而且持续存在。本研究首次对绵羊感染隐孢子虫后的血液学变化进行了分析,研究结果能够为隐孢子虫的临床诊断提供辅助参考。
