辣椒果实螺旋性状的组织学与转录组学分析
2022-09-23曹晓萌王怡心李子雄沈火林
曹晓萌 王怡心 李子雄 沈火林 孙 亮
(中国农业大学 园艺学院/设施蔬菜生长发育调控北京市重点实验室,北京 100193)
辣椒(Capsicum
annuum
L.)原产于南美洲,是一种重要的世界性蔬菜。我国是辣椒生产与消费大国,2019年辣椒播种面积达226万hm,占全国蔬菜总播种面积的8%~10%,年产值约2 500亿元。与许多园艺作物类似,辣椒果实的相关性状,尤其是果形的变异十分丰富。不同地区消费者对不同果形的辣椒喜爱程度不同,例如,东北与华北地区消费者偏爱果形顺直的牛角与羊角椒,华中、云、贵和川等地区的消费者更喜爱指形的朝天椒与细长形的线椒,而西北地区及越来越多的东部地区消费者则对螺丝椒青睐有加。螺丝椒因形似“螺丝”而得名,其果实呈长羊角形,基部有褶皱,整体呈右螺旋生长。与一般长羊角椒相比,螺丝椒的辣味更浓,皮更薄且肉更脆,因此深受消费者喜爱。螺丝椒起初在甘肃、青海、新疆和陕西等西北地区大规模种植,其在新疆鲜食辣椒种植面积中占比超85%;而后螺丝椒在我国东南部地区也逐渐发展起来,近年来在全国各地内均有大面积种植。虽然螺丝椒在辣椒产业中的地位逐年提高,然而有关其形成机理的研究却相对较少。在自然界中,螺旋状生长是一种常见发育模式,多见于植物的根、茎、缠绕的卷须、叶片以及呈螺旋状排列的花瓣中。植物器官的螺旋生长对增强植物卷须的攀援能力、根系的侵彻力、种子的散播能力以及植物器官的机械强度等均有重要作用。在机理方面,有学者用植物力学模型与线性弹性理论来解释多细胞器官径向的扭曲,并认为这种螺旋生长主要源于几何学与力学的约束。然而更多的研究发现,植物的螺旋生长与生理、亚细胞、细胞和分子层面的改变有关。在生理学方面,有研究发现植物器官不同的旋转方向(左旋或右旋)是由南北半球的引力、磁场与植物激素共同作用的结果,北半球的植物左侧生长素分布较多,生长较快,右侧生长素分布较少,生长较慢,使植物向左弯曲;而南半球的情况恰好相反。在亚细胞与细胞层面,植物器官的螺旋生长被认为与细胞壁中的纤维素微纤丝以及细胞骨架的排布有直接关系,细胞的伸长和扩张受到细胞壁中纤维素微纤丝沉积方向的调控,通常来说纤维素微纤丝的排列方向与细胞伸长的方向垂直。然而,在螺旋生长的植物中,微纤丝往往呈斜螺旋状排列,并且有研究表明细胞的纵向扩张与螺旋节距的增加有关。因此,在不增加纤维素微纤丝长度或减少细胞直径的情况下,为了适应细胞长度的增加,细胞必然会扭曲。在植物细胞中,纤维素微纤丝的排列受细胞骨架尤其是微管排布的调控。纤维素微纤丝由纤维素合成酶A六聚体复合物(Hexameric CesA rosette)合成,而这一结构在纤维素合成互作蛋白(CELLULOSE SYNTHASE INTERACTING,CSI)与纤维素合成伴侣蛋白(COMPANION OF CELLULOSE SYNTHASE,CC)的辅助下沿微管移动。很多研究表明,微管排列方向的改变会直接影响纤维素微纤丝的排布方向。
很多植物的螺旋生长突变体也都与细胞骨架相关蛋白的突变有关。水稻中tid
1-1突变体的叶片和茎呈现右螺旋生长,TID
基因编码α
-微管蛋白,tid1-1
突变是α
-微管蛋白第56个氨基酸由苏氨酸突变为异亮氨酸所导致。拟南芥中与TID
高度同源的LEFTY
基因突变也会导致根系的螺旋生长,但其旋转方向与水稻tid1-1
突变体相反,为左旋生长。lefty1
和lefty2
突变分别由微管蛋白α-tubulin 6和α-tubulin 4显性突变所导致。同时,拟南芥右螺旋生长突变体tortifolia2
也是由α
-微管蛋白突变所导致的。除微管结构蛋白的突变外,一些微管相关蛋白(MAP)的突变也会导致植物的螺旋生长,例如拟南芥中CSI1、SPIRAL1、SPIRAL2和WAVE-DAMPENED蛋白的突变均会导致器官的右旋生长。其中,SPIRAL1是定位于微管的蛋白,过表达其编码基因会增强微管对微管解聚药物的抗性并促进下胚轴的伸长;SPIRAL2主要参与微管负端的稳定;WAVE-DAMPENED属于TPX2-like家族,该家族成员均可与微管结合并参与细胞分裂、下胚轴伸长和维管束发育等过程。此外,番茄果形位点sun
也会导致器官的旋转。sun
基因编码IQ67家族蛋白-IQD12,在番茄中的过表达不但会引起果实的过度伸长,而且还会导致子叶与茎等器官的旋转。拟南芥中研究发现很多IQ67家族成员均定位于微管并且与微管相关蛋白ROP以及KINESIN LIGHT CHAIN-RELATED互作。除上述MAP外,植物激素与重力等因素也会影响植物的螺旋生长。有研究表明激素可以通过改变周质微管的排列,促进或抑制微管的解聚,控制纤维素微纤丝在细胞壁上的排列方向和调控细胞的生长方式,引起植物的螺旋生长。在一些生长素相关基因的突变体中也发现了螺旋生长现象,例如aux1
突变体的根呈左螺旋生长,而rcn1
突变体的根则呈右螺旋卷曲。乙烯也被发现可以通过影响纤维素的定向沉积来改变微管的排列,并引起植物器官的螺旋生长。超重力也会造成植物的周质微管从横向排列转变为纵向排列并最终导致器官的旋转生长。辣椒是为数不多的能在果实上观察到螺旋生长的园艺作物,这种性状与辣椒的经济价值相关,然而目前人们对辣椒这一性状形成机理的了解却不够深入。本研究以螺丝椒与牛角椒自交系为试材,利用徒手切片、石蜡切片和转录组测序等技术,旨在初步揭示辣椒螺旋果形的形成机理,为全面揭示植物器官形态建成理论奠定基础。
1 材料与方法
1.1 试验材料
试验以本课题组选育的螺丝椒自交系19C705与牛角椒自交系19C961为试材。所有试材均于2021年春茬种植在中国农业大学上庄试验站塑料大棚。
1.2 果实发育调查
于花后0、3、5、8和12 d观察果实的旋转情况,于破色期(花后38 d)用直尺测量果实的最大纵横径。以果实果肩至远轴端最大垂直距离作为果实纵径,以平行于果肩的果实最宽处作为果实横径。果形指数为果实纵径除以横径所得值。每个试材选取至少5个植株,每个植株至少调查3个果实。
1.3 花期子房和破色期果实徒手切片制作与组织学调查
分别从19C705和19C961植株上选择发育良好的破色期果实,切取果实中段1/3部分,分别做横切、纵切与剖切,每个试验材料至少调查5个果实,每个果实每个方向至少制作3个切片。取19C705和19C961的花期子房,去除萼片后分别制作横切和纵切石蜡切片,每个试验材料至少取8个子房,每个方向至少制作4张石蜡切片;组织薄片用甲苯胺蓝染色后置于OLYMPUS DP72体式显微镜下观察并拍照。使用Image J软件测量横向、纵向细胞的平均大小、细胞数目以及纵剖面细胞排列方向上的细胞形状指数、细胞排列方向与果实纵轴的夹角。
1.4 统计学分析
上述试验数据使用Microsoft Excel 2019与R软件进行统计学分析。
1.5 转录组测序与分析
在19C705和19C961开花当天剥取子房并用液氮速冻,而后利用Invitrogen TRIzol试剂盒(Invitrogen,美国)提取子房RNA。转录组测序文库构建与测序均在百迈客公司(青岛)完成。转录组数据分析由百迈客云平台(www.biocloud.net)完成,其中差异显著基因利用DEseq2软件包分析,错误率设置为FDR=0.05,差异倍数阈值设定为FC=2,平均表达量≥2 FPKM。差异基因富集分析(包括GO、COG、KEGG和KOG富集)和注释分析(包括Pfam、Swiss prot、NR与eggNOG注释)均在百迈客云平台完成。筛选出重点基因的表达量使用R语言中Z
-score方法进行标准化,热图使用MeV4.9.0软件进行绘制。1.6 实时定量荧光PCR
使用Prime Script RT Reagent Kit(宝生物工程(大连)有限公司)进行mRNA反转录,而后利用TB GreenPremix ExTaq
II(宝生物工程(大连)有限公司)试剂盒进行实时定量PCR反应,PCR仪为ABI PRISM 7500 Real-Time PCR System(Applied Biosystems,美国)。使用Primer 5软件设计引物,详细信息参见表1。选择UBI-3
(Capana06
g002873
)基因作为内参基因,使用2计算相对表达量。2 结果与分析
2.1 破色期果实表型及组织学调查
19C705与19C961 2种试材果实大小与形状差异见图1(a)。19C705为典型的螺丝椒类型,果实较长、表面褶皱且整体呈右手螺旋;19C961为长牛角形,果面光滑。通过破色期果实徒手切片发现,在纵剖面方向上19C705的细胞呈倾斜排列且细胞形状细长,而19C961的细胞整体呈垂直排列且细胞形状较圆(图1(c)和(d))。在横切面方向上,2种材料的细胞均呈圆形且排列均垂直于表皮方向(图1(e)和(f))。在纵切面方向上,19C705的细胞呈波浪状排列,细胞大且细胞较多;而19C961细胞整体上呈纵向排列(图1(g)和(h))。
2种试材花期子房的横切与纵切切片见图2。对2种材料花期子房进行测量与组织学分析发现,19C705的花期子房长度和宽度均显著大于19C961,但二者子房的形状指数差异不显著(图2和图3(a));2种材料果肉纵、横向细胞数目差异不显著(图3(b)),但19C705纵向细胞面积显著大于19C961(图3(c))。对2种材料破色期果实而言,19C705的果实长度显著大于19C961,但果实宽度却显著小于后者,这也最终导致了19C705的果形指数显著大于19C961(图4(a));在细胞数目方面,19C705的纵向与横向细胞数目均显著多于19C961(图4(b));在细胞大小方面,19C705的纵向与横向切面细胞面积均显著小于19C961,但是前者的纵剖面细胞面积却显著大于后者(图4(c))。为更加准确地衡量果实纵剖面细胞的排列方式,本研究测量了纵剖面细胞排列方向与纵轴的夹角,结果发现19C705的夹角显著大于19C961(图4(d))。在纵剖面上,19C705的细胞形状指数(细胞长度/宽度)也明显高于19C961(图4(d))。
表1 实时定量引物
Table 1 Primers for real-time qPCR
基因IDGene ID引物序列(5'-3')Primer sequence (5'-3')产物长度/bpProduct length退火温度/℃TmCapana09 g000310_OFP8AGAGAATTGCAACTTCAACACCATGACCCCGAGAGAAGAATATTCCGATGAATC22064.865.1Capana01 g002642_KIN12ATCACCATCTCAGCTATCTCATCTGCTCCAGAGATTTATTTGATGCAGAATGGCAG18065.466.8Capana11 g001424_CycB1CATCATCTTCCCAACCAACAAGTATCTCAGGTAGCGGTCAATAATGTTGATTCG17965.765.1Capana03 g000798_ExpA1CGAGTTTCAAATGTTGTTGTCTTGGCTGACATAGGCATCCAGCCACTTCTAG19966.366.0Capana08 g000965_PGAGTAGCTGAGAACGTGTCAATGGCCCAGCTAGCAACTTGCAAGGTGAAGG18565.966.7Capana03 g002435_GA20ox1TGCATAGAGCAGTGGTAAACAACAAGACCTGAGTGAATTCATGGAGGGTAGGC16465.465.3Capana03 g003744_ZOG1AGCTGGTCGAGATCCGATTCTAATGACCGTGGAAGATAAACGACATGACG17865.266.4Capana12 g000825_ARF3CCCTTTGACAGAAGAAGAATGATCGAGCTACCAGCTCTTGTGAAGGCCTCTG24066.165.8
2.2 19C705果实发育调查
为明确19C705果实自何时开始发生旋转,本研究对发育前期果实的旋转情况进行了调查,结果发现花后8 d的果实已经有非常明显的旋转,并且在花后3和5 d都可以发现子房的不对称生长(图5(a)~(e)),说明旋转出现的时期早于花后3 d。
2.3 转录组分析
对2种材料6个样品进行测序共产生39.16 Gb的高质量数据,各样品Q30均≥94.74%。在19C705与19C961间共鉴定出1 205个表达差异显著基因,其中713个基因在19C705中被下调,492个基因被上调(图6(a))。KOG分析发现上述差异显著基因富集在从RNA处理与编辑(RNA processing and modification)到细胞周期调控-细胞分裂-染色体分割(Cell cycle control, cell division, chromosome partitioning)再到细胞壁-膜-包膜形成(Cell wall/membrane/envelope biogenesis)最后到细胞骨架(Cytoskeleton)的19个分类中(图6(b))。另外,通过以往有关螺旋生长的研究,本研究在表达差异显著基因中根据GO、COG、KOG、Pfam、Swiss prot、eggNOG和NR注释,筛选出与细胞骨架、细胞周期与分类、细胞壁和激素相关的基因共45个(图6(c)和(d))。其中,与细胞骨架相关基因中有3个驱动蛋白(Kinesin)基因(KIN
-UA
、KIN-14G
和KIN12A
)在19C705中被上调,1个Kinesin相关基因(KIN-14G
)被下调;1个驱动蛋白轻链相关蛋白(KLCR3
)基因在19C705中被下调;2个TPX2-like
基因被上调;1个成束阿拉伯半乳糖蛋白基因(FLA12
)与1个NPH3
基因被上调;另外,Flotillin-like3
(编码筏蛋白)、Myosin-2-like
(编码肌球蛋白)、OFP
8(编码OVATE家族蛋白)与CML19
(编码钙调素相似蛋白)基因均在19C705中被下调,而ICR4
(编码ROP持续激活抑制子)基因则被上调(图6(c))。在与细胞周期和细胞分裂相关的基因中,仅有染色体结构维持蛋白基因(SMC1
)与Myb
基因在19C705中被上调,其他基因包括细胞周期蛋白基因CycA2
与2
个CycB1
、MEI2-like2
、细胞周期依赖激酶基因(CDK12/13
)、Myb113
基因、细胞分裂控制蛋白基因(CDC48C
)、丝氨酸/苏氨酸激酶TOR
基因(mTOR
)和PIF
解旋酶基因(PIF1-like
helicase
),均在19C705中被下调(图6(c))。在与细胞壁相关的基因中,植物细胞壁GP蛋白基因(GP1
)、WALL ARE THIN1(WAT1
)、扩展蛋白A1(ExpA1
)和β葡萄糖苷酶(BGLU42
)均在19C705中被上调,而果胶酯酶基因(PME53
)、多聚半乳糖醛酸酶基因(PG
)和另一个β
葡萄糖苷酶(BGLU42
)均在19C705中被下调(图6(d))。在与植物激素相关的基因中生长素响应因子基因ARF3
、生长素受体基因TIR1
、吲哚-3-乙醛酸氧化酶基因AAO
、生长素响应蛋白SAUR32以及生长素极性运输蛋白LAX3均在19C705中被下调,而生长素响应因子ARF18
和另一个生长素响应蛋白SAUR则在19C705中被上调;除生长素相关基因外,2个细胞分裂相关基因ZOG1
(玉米素-O-糖基转移酶基因)均在19C705中被下调;赤霉素相关基因GA3ox2
、GA20ox1
与GA2ox8
的表达均在19C705中被上调,而赤霉素调节蛋白基因GASA6
则在19C705中被下调(图6(d))。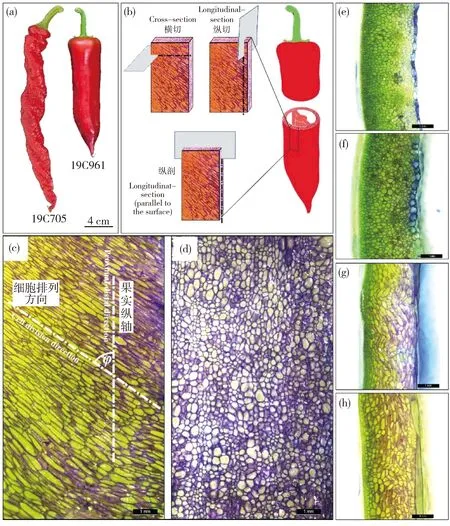
19C705和19C961分别代表试验所用的螺丝椒与牛角椒。下同。(a)19C705与19C961成熟果实表型;(b)横切、纵切与纵剖切示意图;(c)和(d)分别为19C705和19C961纵剖切片图;(e)和(f)分别为19C705和19C961横切切片图;(g)和(h)分别为19C705和19C961纵切切片图。细胞排列方向与果实纵轴夹角为φ。图(c)~(h)比例尺为1 mm。 19C705 and 19C961 respectively represent helical-shaped pepper and horn-shaped pepper used in the test. The same below. (a) 19C705 and 19C961 mature fruit phenotype; (b) Schematic diagram of cross cutting, longitudinal cutting and longitudinal cutting that parallel to the surface; (c) and (d) respectively represent 19C705 and 19C961 longitudinal cut slicediagram that parallel to the surface; (e) and (f) respectively represent 19C705 and 19C961 cross cut slice diagram; (g) and (h) respectively represent 19C705 and 19C961 longitudinal cut slice diagram. The angle between the cell arrangement direction and the longitudinal axis of the fruit is φ. The scale in Figs (c)-(h) is 1 mm.图1 2种试材表型及徒手切片Fig.1 Phenotype and freehand section of two samples
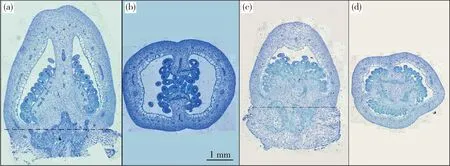
(a)19C705纵切石蜡切片图;(b)19C705横切石蜡切片图;(c)19C961纵切石蜡切片图;(d)19C961横切石蜡切片图。图(a)和(c)中的虚线表示子房底端。
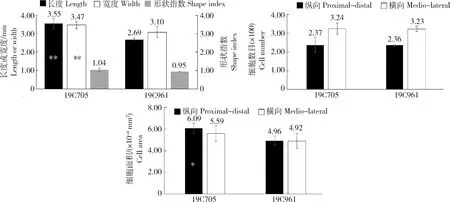
(a)花期子房长度、宽度与形状指数;(b)花期子房纵切和横切细胞总数;(c)花期子房纵切和横切细胞面积。*表示0.05水平差异显著;**表示0.01水平差异显著。下同。
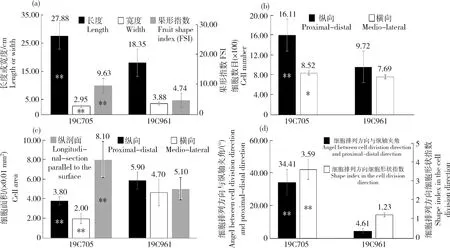
(a)果实长度、宽度与果形指数;(b)果实纵切与横切面细胞数;(c)果实纵切、横切与纵剖面细胞面积;(d)果实纵剖面细胞排列方向与纵轴夹角以及细胞在排列方向的细胞形状指数。
2.4 基因表达的实时定量荧光PCR检测
为了验证转录组测序结果,本试验挑选了8个基因进行了实时定量荧光PCR检测(表2)。结果发现基因的表达模式与转录测序结果一致,其中OFP8
、CycB1
、PG
、ZOG1
和ARF3
分别在19C961花期子房中被上调了2.47、19.66、3.92、187.12和69.03倍;而ExpA1
和GA20ox1
分别在19C961被下调为19C705的0.38和0.51倍;对于KIN12A
基因而言,其在35个循环内没有发生指数扩增,说明其表达量低于检测范围。3 讨论与结论
3.1 2种试材果实形状差异的组织学基础

(a)~(e)为19C705试材花后0、3、5、8和12 d果实生长表型。
2种试材破色期果实在长度、果形、螺旋程度和表面平整度上均存在明显差异。19C705的果实长度显著大于19C961,而宽度显著小于后者,这导致了其果形指数显著高于19C961。在组织学层面,由于19C705的果实纵切面细胞大小显著小于19C961,因此前者的果实长度主要受细胞数目的影响。而在果实宽度或周长方面,虽然19C705的横向细胞数目显著高于19C961,但增幅仅有9.74%,19C705果实的横向细胞面积显著小于19C961并且降幅高达57.45%。这种细胞数目与大小的相反变化趋势最终导致了19C705果实宽度显著小于19C961,同时也说明了横向细胞面积是决定二者宽度的1个主要调控因子。综合果实纵切、横切、纵剖面细胞面积以及细胞形状指数发现19C705的细胞较19C961更加细长。结合细胞排列方向与纵轴夹角φ
,可以通过S=S剖×(S纵×sinφ
)×1/2或S=S剖×(S横×cosφ
)×1/2来粗略估算19C705的平均细胞大小,也可以通过S=(S剖×S横×S纵)×1/2来粗略估算19C961的细胞平均大小。结果发现,19C705细胞的平均大小介于(10.41×10~11.83×10) mm之间,19C961细胞的平均大小约为11.88×10mm。这说明2种材料的整体果形与果实大小主要由细胞数目与细胞形状共同决定。与上述情况不同的是,2种材料的花期子房在形状指数上没有明显差异,说明二者果形指数的差异主要由果实发育阶段差异决定。二者在子房大小与子房壁细胞大小上存在差异,可能暗示了开花前的发育过程影响了子房细胞的一些基本生长发育模式。在果实的螺旋生长方面,本试验发现2种材料果实的差异主要体现在纵剖面细胞排列方向上,其中19C705的细胞基本呈直线排列,但排列方向与果实纵轴有明显的夹角并呈右螺旋方向(果梗端到果顶端方向),而19C961细胞排列方向基本与果实纵轴平行。19C705这种细胞的排列方式与spr1
、spr2
、trn2
以及tor2
相似而与sun
和eb1b1
相反。由于19C705果实的螺旋并非由后期细胞分裂模式改变所导致,因此可以推测其果实螺旋生长的起始可能发生在子房发育较早阶段。这种推测通过观察果实连续发育结果得到了支持,因为在花后3 d即可观察到果实的不对称生长。另一方面,19C705果面的褶皱主要是由细胞在分裂方向上波浪状排列所导致,然而在2种材料的花期子房切片中并没有观察到明显的细胞排列变化,这种现象可能是由于子房细胞较小导致其排列变化幅度较小所导致,也可能是由螺旋生长的亚细胞基础导致。前人发现,植物器官螺旋生长的原因之一是细胞壁纤维素微纤丝的倾斜螺旋排列,在这种情况下,植物细胞在膨大时会受到纤维素微纤丝长度与排布方式的约束,进而产生螺旋与细长化,并最终导致细胞形状与分裂方向的改变使植物器官呈现螺旋生长。虽然这种纤维素微纤丝排布模式的改变可能发生在植物器官形成的早期,但是其组织学与形态学的明显变化却依赖于细胞的膨大,因此有可能在器官发育的早期阶段观察不到细胞形状与排列方式的改变。3.2 2种试材果形差异的转录基础
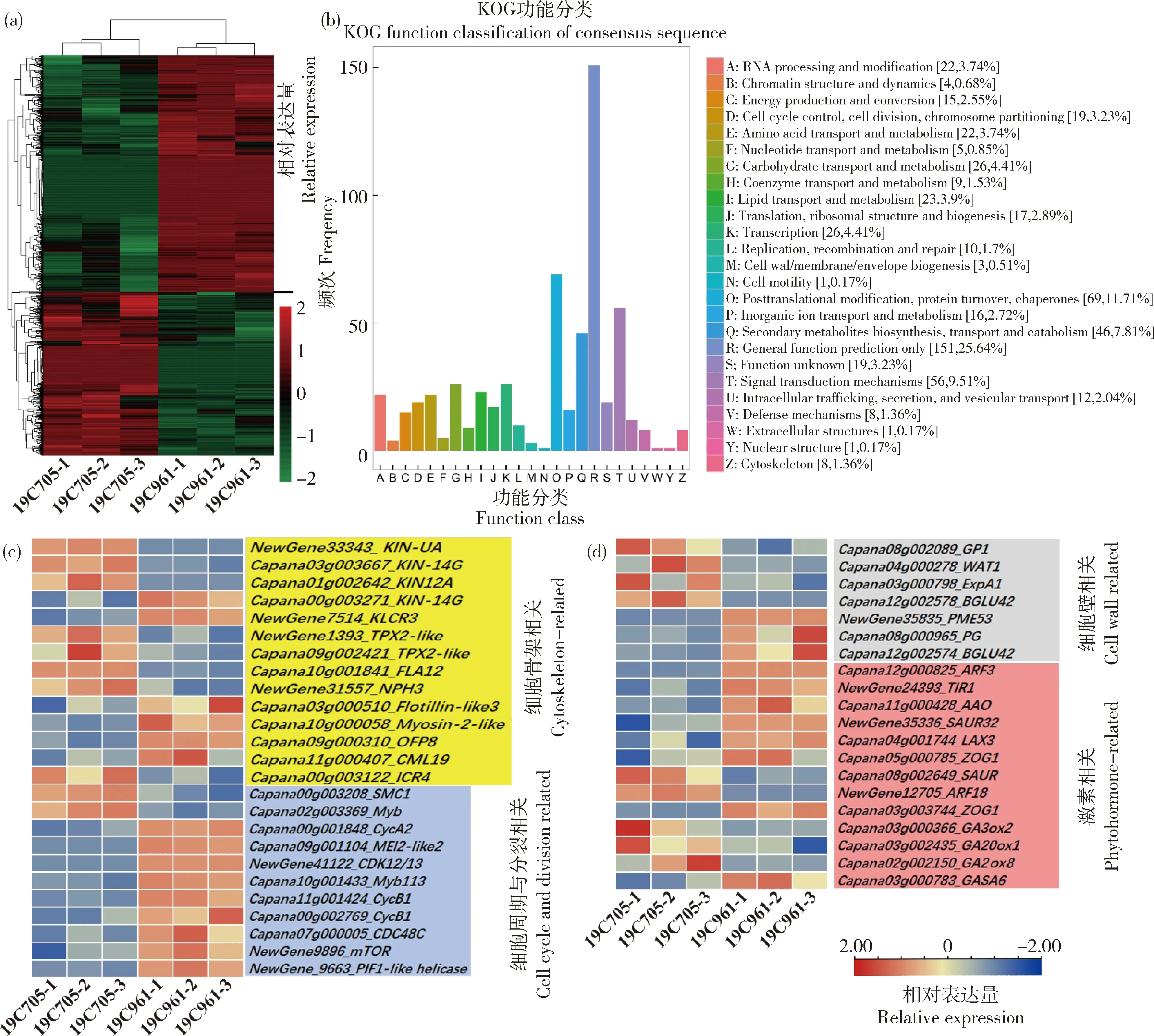
(a)所有差异表达基因热图;(b)差异表达基因的KOG富集;(c)细胞骨架、细胞周期以及与细胞分裂相关基因表达热图;(d)细胞壁与激素相关基因表达热图.(b)中方括号中的数字代表富集在对应功能的基因数目,百分数代表占比。
以往研究表明,植物器官的螺旋生长主要由细胞壁中纤维素微纤丝的排列模式调控,而纤维素微纤丝的排布模式又受到细胞中微管排布模式的调控。本研究在19C705和19C961花期子房转录组差异表达基因中筛选出与细胞骨架相关的14个基因,包括了驱动蛋白基因KIN
、驱动蛋白轻链相关蛋白基因KLCR3
基因、TPX2-like
家族基因、阿拉伯半乳糖蛋白基因FLA12
、NPH3
家族基因、筏蛋白基因Flotillin-like3
、肌球蛋白Myosin-2-like
、OVATE
家族蛋白基因OFP8
、钙调素相似蛋白CML19与ROP持续激活抑制子基因ICR4
。其中KIN
、KLCR
、NPH3
和CML
基因家族成员的突变均被证明可以导致植物器官的螺旋生长。除上述基因外,ICR
4基因也被发现在2种材料子房中差异表达,该基因编码1个ROP持续激活抑制子,而该抑制子被证明编码植物特异Rho GTP酶并可以与IQ67蛋白结合。IQ67家族蛋白成员IQD12已被证明在高表达状态下可以通过增加纵向细胞数和减少横向细胞数使番茄果形伸长同时引起营养器官的螺旋生长。而IQ67蛋白也被证明可与KLCR
、CaM
以及CML
互作形成复合物并通过与微管的结合调控纤维素微纤丝的积累方向。因此,IQ67
相关通路可能在19C705中被激活并参与调控果实的螺旋生长与伸长。有趣的是,除IQ67
相关通路基因外,本研究还发现1个OFP家族成员基因OFP8
在19C705中被显著下调。OFP蛋白家族成员已被证明在多种作物中调控器官的形态,例如在番茄中OVATE
基因的无义突变会通过改变果实基部细胞数目和伸长细胞形状来使果实伸长并呈倒卵形。因此,19C705子房中OFP8
的表达下调可能也是导致该材料果实及果实中细胞伸长的原因之一。除细胞骨架相关基因外,一些与细胞壁相关的基因如GP1
、WAT1
和扩展蛋白ExpA1
均在19C705中被上调,而与细胞壁降解相关的果胶酯酶基因PME53
与多聚半乳糖醛酸酶基因PG
均在19C705中被下调,这也与子房细胞的分裂状态相对应。除上述基因外,由于2种材料果实在细胞数目与形状间也存在显著差异,本研究也在差异表达基因中筛选出与细胞分裂及激素合成相关的基因。与细胞分裂相关的基因中除SMC1
与MYB
外,其余基因包括CYCLIN
、CDK
和CDC
等均在19C705中下调。这种情况与19C705细胞数目多于19C961的现象相反。出现这种现象的原因可能是19C705的细胞分裂高峰晚于19C961。植物激素尤其是生长素与赤霉素也被证明参与细胞数目与大小的调控。例如在番茄中改变ARF7
、ARF20
与miR160
的表达以及外施生长素均会导致果形的改变。然而在本试验中除生长素响应基因SAUR
与ARF18
外,其他筛选出的基因包括与生长素合成、信号转导与极性运输相关基因均在19C705的子房中被下调。一方面说明SAUR
与ARF18
可能在19C705细胞分裂与伸长中发挥了重要作用,另一方面推测生长素在19C705与19C961果形的差异中并非发挥了最重要的作用。与之相反的是,2个细胞分裂素降解相关基因ZOG
均在19C705中被显著下调,说明19C705子房中细胞分裂素的积累可能高于19C961,这可能是导致前者细胞数目多于后者的原因之一。同时,19C705子房中赤霉素合成相关基因GA20ox1
与赤霉素降解相关基因GA2ox8
与GA3ox2
的表达均被上调,说明19C705子房中赤霉素合成通路被激活。这种现象也可归因于子房中细胞分裂素含量的提高,前人研究发现较高浓度的细胞分裂素可以诱导赤霉素的合成,植物体为了平衡体内提高的赤霉素含量又激活了赤霉素降解通路基因。表2 实时定量荧光PCR相对表达检测结果
Table 2 Relative expression values of the interested genes in the real-time qPCR
基因IDGene ID19C705相对表达量19C705 relative expression level19C961相对表达量19C961 relative expression levelCapana09 g000310_OFP81.00±0.102.47±0.05Capana01 g002642_KIN12A1.00±0.03N.D.Capana11 g001424_CycB11.00±0.0819.66±3.04Capana03 g000798_ExpA11.00±0.040.38±0.08Capana08 g000965_PG1.00±0.063.92±0.07Capana03 g002435_GA20ox11.00±0.020.51±0.01Capana03 g003744_ZOG11.00±0.01187.12±40.11Capana12 g000825_ARF31.00±0.0569.03±1.43
注:N.D.表示在35个循环内没有检测到指数扩增。19C705和19C961分别代表试验中所用的螺丝椒与牛角椒试材。
Note: N.D. indicates that exponential amplification is not detected within 35 cycles. 19C705 and 19C961 respectively represent helical-shaped pepper and horn-shaped pepper used in the test.
综上所述,19C705果实可能通过改变KIN
、NPH3
以及IQ67
通路相关基因KLCR3
、CML
与ICR4
的表达来调控子房中细胞的初始分裂方向使果实呈现螺旋生长的表型,同时可能通过调控IQ67
通路相关基因、OFP8
以及细胞分裂相关基因的表达来增加纵向与横向细胞数目并影响细胞形状,最终使果实伸长。