基于多酶辅助信号放大的脱氧雪腐镰刀菌烯醇高灵敏免疫检测方法的建立
2022-09-23吴琴燕顾鑫凯
陈 斌, 曾 昆, 吴琴燕, 杨 健, 顾鑫凯
(1.江苏大学环境与安全工程学院,江苏镇江 212013; 2.江苏丘陵地区镇江农业科学研究所,江苏镇江 212013)
真菌毒素是真菌产生的次级代谢产物,极易在作物生长、收获及粮食储藏过程中产生。在我国,由于人们的传统饮食规律,谷物食用比例远高过西方国家,使得真菌毒素危害十分明显。其中,脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)是从被禾谷镰刀菌污染的玉米中分离出的一种真菌毒素,并且是粮食作物中常见的污染毒素之一,因其能够引起呕吐,故又称呕吐毒素。DON能够直接污染农作物,然后通过农作物进入到人或动物体内,能够诱发呕吐,导致动物出现厌食、胃肠炎、腹泻、生长缓慢,甚至还会产生免疫抑制或血液病等。有研究表明,90%感染真菌毒素的样本里均含有DON。我国规定谷物及其制品中DON的限量标准为1 mg/kg,联合国食品添加剂专家委员会规定人体对DON及其衍生物每日最大耐受摄入量为1 μg/kg。郭红卫等在对我国河南地区及上海市赤霉病流行年份与非流行年份小麦中镰刀菌污染情况进行调査时,发现DON含量的中位数分别为933.0、14.2 mg/kg,远高于我国规定的限量标准。常规真菌毒素检测以仪器分析方法为主,包括高效液相色谱法、液质联用等技术,尽管灵敏度高、准确性好,但这些仪器分析均需要专业技术人员操作,且仪器设备成本高,前处理过程复杂,不能满足大规模样本快速分析需求。免疫分析方法具有灵敏度高、特异性好等优点,适用于大量样本的现场筛查,已广泛应用于食品安全、环境监测、临床诊断等领域。
免疫分析方法是基于抗原-抗体的特异性结合,结合酶、荧光物质、纳米颗粒等报告分子,输出检测信号。凭借高效催化作用、专一性等特点,酶在免疫分析方法中应用最为广泛,为高灵敏度分析方法的构建提供了重要元件。借助纳米颗粒、聚合物、抗原-抗体、生物素-亲和素等系统,将多个酶共同组装在一起而形成多酶颗粒,极大增加了单位反应单元的酶数量,提高了检测信号值,从而达到提升检测灵敏度的目的。纳米科技的发展为多酶颗粒的制备提供了多种可能,新型的纳米材料,例如纳米金颗粒(AuNPs)、碳纳米管(carbon nanotubes,CNTs)等,具有尺寸小、比表面积大、荷载量大等优势,可作为酶的载体,并且这些纳米材料还可较好地保存酶的催化活性,避免在苛刻条件下酶活性的丧失。笔者所在研究组前期分别合成了基于AuNPs和CNTs的多酶颗粒,发现以CNTs为载体的颗粒能够荷载更多的蛋白酶分子,具有更高的催化效率,并且对于免疫分析方法灵敏度的提升更为显著。
本研究以CNTs为载体,荷载酶蛋白分子,构建通用型的多酶信号颗粒,建立多酶辅助信号放大的DON免疫分析方法,并对市售谷物样本进行检测。该方法操作简单、快速、灵敏度高,可为谷物中DON的检测与监测提供有力的技术保障。
1 材料与方法
1.1 材料与仪器
羊抗鼠酶标二抗(HRP labelled Goat anti-mouse antibody,GAM-HRP),购自美国Jacket公司;明胶和3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine,TMB),购自美国Sigma公司;超高纯羧基化单壁碳纳米管(single-walled carbon nanotubes,SWCNTs),购自江苏先丰纳米材料科技有限公司;DON单克隆抗体以及DON包被原 OVA-DON,购自深圳市科捷实业发展有限公司;其他常规试剂购自国药集团。
多功能酶标仪(奥地利Infinite公司,Infinite M1000 PRO);磁力搅拌器 (德国IKA公司,C-MAG HS4);低温高速离心机(德国Eppendorf公司,5415D)。
1.2 试验方法
1.2.1 间接竞争ELISA方法检测DON的流程 在酶标板中,每孔加入100 μL适量稀释的OVA-DON,4 ℃过夜;倒掉孔内液体,拍干后每孔加入封闭液200 μL(PBS,0.01 mol/L,pH值7.4,含1%明胶),37 ℃孵育2 h,倒掉孔内液体,拍干;采用PBS(0.01 mol/L,pH值7.4)将DON标准品配制成系列浓度,在每个孔中加入50 μL DON标准品,再加入 50 μL 经过适度稀释后的DON抗体,在37 ℃下孵育培养30 min;采用PBST(含0.5% Tween-20 PBS)洗涤3次并拍干,每个孔中加入100 μL适度稀释后的GAM-HRP ,37 ℃下孵育30 min;PBST洗涤3次并拍干,后在每个孔中加入现场配制的TMB显色液100 μL,37 ℃孵育10 min;最后每孔加入50 μL终止液(2 mol/L HSO),并用酶标仪检测 450 nm 处吸光度。以DON标准品浓度的对数为横坐标,为纵坐标绘制标准曲线,其中,为不同浓度标准品对应的值,为标准品浓度为0时,对应的值,即最大值。计算半数抑制浓度(IC)、最低检测限(IC)和检测范围(IC~IC)。
1.2.2 条件优化
1.2.2.1 最适抗原抗体浓度优化 通过使用棋盘法进行研究,寻找抗原抗体的最佳反应浓度。酶标板每行包被不同浓度的OVA-DON,每孔加入 100 μL,4 ℃过夜;洗涤及封闭同“1.2.1”节;将DON抗体用PBS缓冲液分别稀释至不同浓度,并依次加入至不同列孔板中,每孔100 μL,37 ℃孵育 30 min;其余洗涤、加入酶标记物、显色、终止等流程同“1.2.1”节。经过试验,把阳性对照/阴性对照(Positive/Negative,P/N)≥2.1,且吸光度达约1.0时的抗原及一抗浓度作为最佳反应浓度,其中 P/N=(-)/(-)。
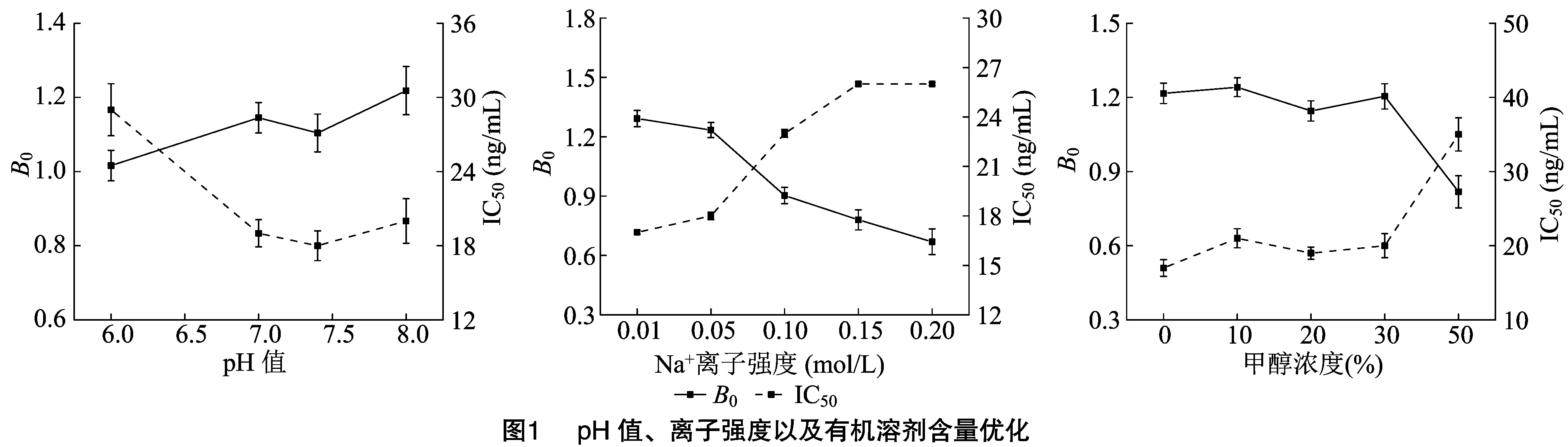
1.2.2.2 最适理化条件的优化 (1)最适pH值:配制pH值分别为6.0、7.0、7.4、8.0 0.01 mol/L PBS缓冲液,采用上述缓冲液稀释DON标准品,按“1.2.1”节方法进行检测,每组设置3个平行,绘制标准曲线并计算IC。(2)最适离子强度:分别配制离子强度为0.01、0.05、0.1、0.15、0.20 mol/L的PBS缓冲液(pH值依据上述试验获得),采用上述缓冲液稀释DON标准品,按“1.2.1”节方法进行检测,每组设置3个平行,绘制标准曲线并计算其IC。(3)最适有机溶剂用量:分别配制含有0%、10%、20%、30%及50%甲醇的PBS缓冲液(pH值和离子强度依据上述试验获得),采用上述缓冲液稀释DON标准品,按“1.2.1”节方法进行检测,每组设置3个平行,绘制标准曲线并计算其IC。
1.2.3 SWCNTs多酶信号颗粒的制备与评估
1.2.3.1 SWCNTs多酶信号颗粒的制备 0.2 mg羧基化SWCNTs,超声悬于1 mL MES溶液中,至SWCNTs完全分散;加入一定量的GAM-HRP,4 ℃混合搅拌过夜;5 000/min离心10 min,去除上清液;将沉淀SWCNTs/GAM-HRP超声重悬于1 mL 含有2% BSA的MES溶液中,4 ℃保存备用。对SWCNT上结合的GAM-HRP用量进行优化,分别加入20、40、60、80 μg GAM-HRP,产物分别命名为SWCNTs/GAM-HRP-1、SWCNTs/GAM-HRP-2、SWCNTs/GAM-HRP-3和SWCNTs/GAM-HRP-4。
1.2.3.2 SWCNTs多酶信号颗粒的评估 应用“1.2.1”节和“1.2.2”节所建立优化后的DON间接竞争ELISA方法,将其中使用的GAM-HRP替换为“1.2.3.1”节中合成不同SWCNTs/GAM-HRP,评估多酶颗粒的结合能力和信号放大效果。
1.2.4 基于多酶辅助信号放大的呕吐毒素检测方法的建立与优化
1.2.4.1 基于多酶辅助信号放大的呕吐毒素检测流程 包被、封闭、DON抗体竞争结合步骤与“1.2.1”节相同;加入不同浓度SWCNTs/GAM-HRP颗粒,振荡条件下37 ℃孵育30 min;显色、终止及读值步骤同“1.2.1”节。
1.2.4.2 条件优化 为进一步提升方法性能,对DON抗体的工作浓度及SWCNTs/GAM-HRP颗粒的工作浓度进行优化。DON抗体设置3个工作浓度(1 ∶2 000、1 ∶4 000和1 ∶6 000),SWCNTs/GAM-HRP设置3个工作浓度(1 ∶10、1 ∶20和1 ∶40),同时设置不同DON标准品浓度(0.0、0.1、1.0 ng/mL)及空白对照(竞争步骤中,不加DON抗体以及DON标准品)。将不同浓度的DON抗体与不同浓度的SWCNTs/GAM-HRP进行交叉匹配,选择灵敏度最高的组合。
1.2.5 方法的性能评估
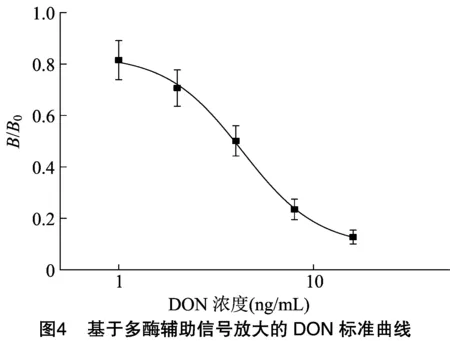
1.2.5.1 间接竞争性标准曲线 基于“1.2.4”节中优化条件,按照“1.2”节中试验流程,分别配制DON标准品浓度为1、2、4、8、16 ng/mL,并绘制标准曲线,每组试验设3个平行。计算半数抑制浓度(IC)、最低检测限(IC)和检测范围(IC~IC)。
1.2.5.2 交叉反应 选取DON结构类似物及不同真菌毒素(3-Ac-DON、15-Ac-DON、T-2毒素、ZEN、AFB1)做交叉反应的测定,对本试验方法的特异性进行评价。交叉反应(cross reactivity,CR)=IC(DON)/IC(类似物)×100%。
1.2.5.3 精密度 将基于多酶辅助信号放大的DON检测方法的标准曲线进行重复测定10次,第2天再次检测,计算批内和批间变异系数(coefficient of variation,CV)。
1.2.6 谷物样本的检测
1.2.6.1 添加回收试验 把大米、玉米和小麦的阴性样品进行粉碎,粉碎后通过20 目筛,称取10 g,加入20 mL 20%甲醇溶液,振荡2 min,取1 mL上清液于4 000/min离心5 min,吸取上清液,并稀释10 倍,配制终浓度为0、1、4、8 ng/mL DON溶液,按“1.2.4.1”节方法进行检测。每种添加浓度重复3次,添加回收率=(检测浓度-本底浓度)/实际添加浓度×100%。
1.2.6.2 实际样本检测 在江苏省镇江市大型超市中,采购大米、玉米和小麦样本各5种,应用“1.2.4.1”节方法进行检测。
2 结果与讨论
2.1 DON间接竞争性ELISA的建立
ELISA方法的建立是基于抗原与抗体的特异性反应,其中,包被原的浓度、抗体的浓度、反应的条件等均会不同程度地影响方法性能,因此需要对其进行优化。首先,采用棋盘法对抗原和抗体的浓度进行优化,由表1可知,通常选择值在1.0左右的配对浓度作为最适条件,其中,包被原1 ∶500/抗体1 ∶8 000、包被原1 ∶1 000/抗体1 ∶4 000和包被原1 ∶2 000/抗体1 ∶2 000这3组均符合此条件。其中,第1组空白值偏高,选择包被浓度较高的一组(包被原1 ∶1 000/抗体1 ∶4 000)为最适工作浓度。

表1 棋盘法筛选最适抗原与抗体浓度
其次,对反应的条件进行优化,包括pH值、离子强度以及有机溶剂含量。由图1可知,pH值在 6.0~7.4时,值变化不大,当pH值达8.0时,值略有增加;同时,当pH值为7.4时,IC值最低。溶液的离子强度越高,值越小,而IC值随离子强度增加而增加。当离子强度为0.01 mol/L时,值最高而IC值最低。在实际样本检测时,需要加入有机溶剂作为提取液,因此,需要评估有机溶剂对反应的影响,选择常用的甲醇进行评估。该方法对甲醇的耐受性较好,当甲醇浓度低于30%时,值和IC值变化不大,当甲醇浓度达50%时,灵敏度显著下降。最终选用0.01 mol/L PBS (pH值7.4,含20%甲醇)作为样品溶液来稀释DON标准品。
基于以上优化条件,建立DON间接竞争检测标准曲线(图2)。该方法线性范围8.85~35.17 ng/mL,IC为18.13 ng/mL,检测限为3.12 ng/mL。

2.2 SWCNTs多酶信号颗粒的优化
以碳纳米管为载体,可荷载较多的蛋白酶颗粒放大检测信号,还可有效保留酶的活性。由图3可知,本研究中,将GAM-HRP偶联在SWCNTs上,形成一种通用的信号放大探针,可适用于间接ELISA方法,用于替代传统的酶标二抗,提升灵敏度。纳米材料上荷载的酶蛋白的量与方法的灵敏度直接相关,因此对GAM-HRP的用量进行优化。随着GAM-HRP用量的增加(从20 μg至80 μg),同等条件下显色的值显著增加。因此,后续试验中GAM-HRP的用量为80 μg,即采用SWCNTs/GAM-HRP-4作为信号放大元件。

2.3 基于多酶辅助信号放大的呕吐毒素检测方法的建立及优化
引入合成的SWCNTs/GAM-HRP-4,构建多酶辅助信号放大的呕吐毒素检测方法。由表2可知,由于酶促信号的放大作用,对DON抗体和多酶信号颗粒的用量再次进行优化,同时设置不同的DON标准品,帮助评估每一种条件下方法的灵敏度。选择的标准为:(1)当DON标准品为0 ng/mL时,显色值在1.0左右;(2)不同的DON浓度条件下,显色呈现明显的梯度为佳;(3)为避免多酶信号颗粒吸附造成的背景干扰,空白值应尽可能小。根据以上条件,发现当 SWCNTs/GAM-HRP-4用量较大(1 ∶10)时,整体背景值均较高(空白超过0.1);在试验中,通过增加洗涤次数、提高洗液中的表面活性剂Tween-20的含量,均不能有效降低背景。SWCNTs/GAM-HRP-4用量为1 ∶20和1 ∶40时,背景值均较低。在DON抗体(1 ∶12 000)/SWCNTs/GAM-HRP-4(1 ∶20)和DON抗体(1 ∶8 000)/SWCNTs/GAM-HRP-4(1 ∶40)这2组条件,最大的值均在1.0左右,同时前一组合在不同DON浓度下,梯度变化趋势更为明显,灵敏度更高。因此,确定最适的DON抗体浓度为1 ∶12 000,SWCNTs/GAM-HRP-4最适浓度为1 ∶20。

表2 DON抗体和多酶信号颗粒的用量优化
基于以上优化后的反应条件,建立了基于多酶辅助信号放大的DON标准曲线。由图4可知,该方法的线性范围为0.93~9.40 ng/mL,IC为 3.93 ng/mL,检测限为0.63 ng/mL。相对于间接竞争ELSA方法,本方法的灵敏度提高约5倍(3.12 ng/mL 至0.63 ng/mL)。在对方法进行优化的过程中,发现在同样的包被浓度条件下,基于多酶辅助信号放大的ELISA方法中抗体的用量(1 ∶12 000)远小于间接竞争ELSA方法(1 ∶4 000)。在与同样浓度的包被原和标准品竞争结合时,抗体越少,越容易被标准品完全抑制,显示出更高的灵敏度;但同时也会导致与包被原结合减少,信号强度降低,因此通过SWCNTs/GAM-HRP有效信号放大,保障了信号强度,使得灵敏度显著增加。与已报道的DON免疫分析方法相比(灵敏度分别为9.83 ng/mL、1.0 ng/mL、2.97 ng/mL),所建立的新方法具有较好的灵敏度,能够满足食品中DON检测的要求。
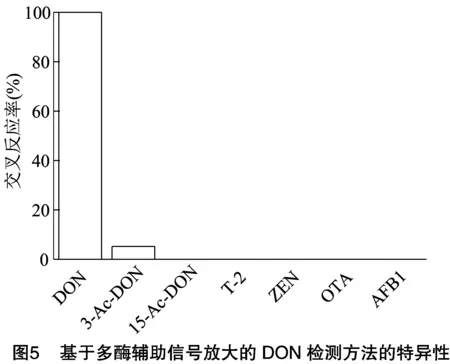
交叉反应结果见图5。由图5可知,所建立的新方法仅与3-Ac-DON有较弱的交叉反应(4.4%),与 15-Ac-DON、T-2、ZEN、OTA和AFB1无明显的交叉反应,这表示本方法具有良好的特异性。由表3可知,本方法的批内差在3.67%~9.09%,平均值为7.27%;批间差在4.72%~13.78%,平均值为9.57%。批内差和批间差均小于15%,表明该方法具有较高的精密度。
2.4 谷物样本的检测
为评价新构建方法的实际应用性,对大米、小麦和玉米3种谷物的样品进行加标回收试验。由表4可知,方法回收率在87.65%~114.50%之间,这个数据表明新方法在实际谷物样品DON的检测中具有较高的准确性。于7月在镇江市吉麦隆及大润发超市中采集了大米、小麦和玉米样品各5个,采用建立的新方法进行检测。由表5可知,15个样本中DON检出浓度在 表3 ELISA方法的批内和批间差异 表4 基于多酶辅助信号放大的DON检测方法添加回收试验 新型纳米材料的发展为免疫分析方法中信号放大策略提供了新的契机。本研究以SMWCNTs为载体,荷载GAM-HRP,构建通用型的多酶信号颗粒,建立了多酶辅助信号放大的呕吐毒素免疫分析方法;相较于间接竞争ELSA方法,该方法的灵敏度提高了约5倍(3.12 ng/mL至0.63 ng/mL);同时具有良好的特异性、准确性。对大米、小麦和玉米加标试验显示,回收率在87.65%~114.50%之间;在15个谷物样本中DON检出浓度在 表5 实际样本检测结果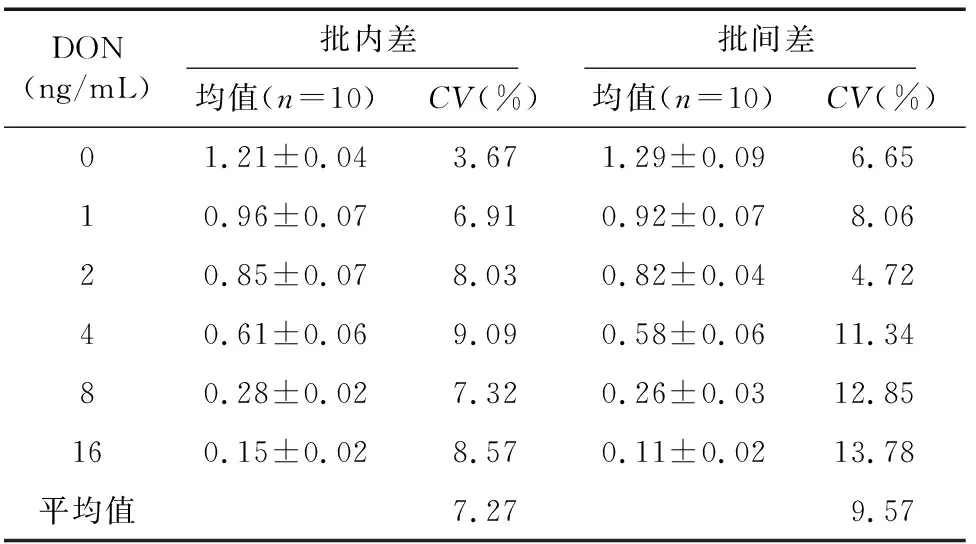

3 结论

