模拟生态系统中恩诺沙星在沉水植物体内蓄积、代谢和消除规律
2022-09-22李传步范培莉李新苍周俊芳房文红
李传步,王 元,赵 姝,范培莉,凌 海,李新苍,周俊芳,房文红
(1.中国水产科学研究院东海水产研究所,农业农村部东海渔业资源开发利用重点实验室,上海 200090;2.上海海洋大学水产与生命学院,国家水生动物病原库,上海 201306)
随着集约化水产养殖日益发展,水产病害愈加严重,抗菌药物被广泛用于疾病的预防和治疗,施用的抗菌药物大部分随着水生动物的代谢而进入到养殖水体中[1]。水体中的抗菌药不仅能通过食物链进入人体而危害人类健康,还能诱导微生物产生耐药基因,并通过水流动介质而传播扩散[2]。恩诺沙星是兽医专用抗菌药,其通过阻断微生物DNA促旋酶和异构酶Ⅳ抑制细菌增殖而产生杀菌效果,具有广谱抗菌作用,在水产动物疾病防治上有明显效果,因此在水产养殖业中被广泛使用[3]。而该类化合物化学结构稳定,难溶于水,并能在水体中持久存在[4]。
2019年,农业农村部等十部委发布《关于加快推进水产养殖业绿色发展的若干意见》,提出要加强水产养殖兽药等投入品的合理使用,提倡水产生态养殖,鼓励利用水生植物对成片养殖池塘和工厂化养殖尾水进行处理,合理利用水资源。目前,关于水产养殖尾水排放标准仅对水体的pH、总氮、总磷、COD等营养盐指标有所规定,尚未对水体中抗菌药残留污染进行要求和规定。
水生植物在处理水体富营养化和重金属污染中已取得很大的进展[5]。目前,越来越多的学者关注水生植物处理水环境中的抗菌药污染研究。CARVALHO等[6]在实验室研究发现,芦苇(Phragmites australis)可以去除水中的恩诺沙星和四环素;国内也有研究报道沉水植物大薸(Pistia stratiotes)和凤眼莲(Eichhornia crassipes)在水培条件下可以去除水中4种抗菌药(盐酸金霉素、氨苄青霉素、盐酸土霉素和盐酸四环素)[7]。除了实验室研究外,也有学者利用水生植物构建人工湿地系统并成功去除了水体中的抗菌药[8-10]。但是,目前相关研究大多都集中于水生植物对抗菌药的去除效率和性能上,很少有关于其蓄积、代谢和消除能力的研究。
根据中国湿地分类国家标准,河蟹养殖池塘为一种人工湿地[11],但关于河蟹池塘沉水植物对抗菌 药 去 除 的 研 究 甚 少,仅ZHANG等[12]、GOMES等[13]和 朱 利 明[14]分 别 研 究 了 苦 草(Vallisneria natans)、伊乐藻(Elodea nuttallii)对恩诺沙星和苦草对磺胺的吸收能力,以及苦草对水体中磺胺的去除规律。因此本研究以河蟹养殖中典型沉水植物苦草、伊乐藻和轮叶黑藻(Hydrilla verticillata)为研究对象,以QuEchERS法(一种简单、快速、安全的样品净化方式)为基础,建立了沉水植物中喹诺酮类抗菌药的HPLC检测方法,通过模拟生态实验比较了几种沉水植物对恩诺沙星的蓄积、代谢和消除能力,旨在评估沉水植物在养殖尾水处理中的修复作用,同时也为水产生态养殖提供理论依据和技术支持。
1 材料与方法
1.1 仪器
高效液相色谱仪(e2695,美国Waters),荧光检测器(2475,美国Waters)高速冷冻离心机(CF16RN,日本HITACHI),旋转蒸发仪(RE-52A,中国重叶),组织匀浆机(T10,德国IKA),多管涡旋混合仪(EFAA-HM-01,中国ANPEL),超声波清洗机(SB-5200D,中国SCIENTZ),超纯水仪(Milli-Q IQ 7000,法国默克)。
1.2 试剂
恩诺沙星(enrofloxacin,ENR)和环丙沙星(ciprofloxacin,CIP)标 准 品 为 德 国Dr.Ehrenstorfer公司产品;乙二胺-N-丙基硅烷化硅胶(PSA)、石墨化炭黑(GCB)、氨基、十八烷基键合相硅胶(C18),以及色谱纯乙腈和甲酸均为CNW产品;乙酸、磷酸、氯化钠、磷酸二氢钾和尿素均为化学纯试剂(沪试)。ENR和CIP事先配制成浓度为100 mg·L-1混合标准母液,置于棕色瓶中4℃保存备用。
提取液A:乙腈;提取液B:0.1%甲酸酸化乙腈;提取液C:1%甲酸酸化乙腈;提取液D:1%乙酸酸化乙腈;提取液E:4%乙酸酸化乙腈,后4者均为体积比(V/V)。
1.3 实验用沉水植物
苦草、伊乐藻和轮叶黑藻采自上海市崇明区惠康水产养殖专业合作社,该合作社无恩诺沙星和环丙沙星使用记录。
1.4 色谱条件
色谱柱为Agilent ZORBAX SB-C18(150×4.6 mm,5μm);流动相为乙腈:0.01 mol·L-1四丁基溴化铵溶液(磷酸调pH至2.80)=10∶90(V/V),使用前进行抽滤、脱气;柱温28℃;流速1.0 mL·min-1;进样量10μL;荧光检测波长,激发光波长(Ex)=280 nm,发射波长(Em)=450 nm。
1.5 前处理方法的建立
称取2.00 g待测沉水植物(苦草)样品,加入10.00 mL提取液,组织匀浆机粉碎5min,振荡提取15 min,加入1.00 g氯化钠,振荡均匀,10 000 r·min-1离心2 min;收集上清液至离心管中,加入50 mg PSA和5 mg GCB,涡旋振荡1 min,10 000 r·min-1离心2 min;取5.00 mL上清液至鸡心瓶中,于40℃旋转蒸发仪减压蒸干,加入1.00 mL流动相,涡旋溶解,过0.22μm滤膜上机分析。
1.6 方法学实验
采用外标法,分别向3种沉水植物(苦草、伊乐藻和轮叶黑藻)样品中加入ENR和CIP,设3个添加水平(0.05、0.10、0.50μg·g-1),根据1.5所建立的方法,以3倍信噪比、外标法和相对标准偏差分别计算检测限、回收率和精密度。
1.7 沉水植物蓄积恩诺沙星模拟实验
实验共设置3组,分别对应苦草、伊乐藻和轮叶黑藻,每组设4个平行。实验在55 cm×42 cm×33 cm的高密度聚乙烯箱中进行,箱子底部铺上厚度5 cm底泥(事先检测不含ENR和CIP),水位高度20.5 cm;每个箱子种植质量(200±2)g、高(18±2)cm的沉水植物,每周添加1 mL的磷酸二氢钾(10 g·L-1)和尿素(20 g·L-1);暂养一周后开始实验,泼洒恩诺沙星使水体浓度为200μg·L-1,在药物泼洒后的1 h、3 h、6 h、12 h、1 d、2 d、3 d、5 d、7 d、10 d、15 d、20 d和25 d采集沉水植物,用纯净水冲洗后置于-20℃冰箱保存。
1.8 数据处理
方法学数据通过Excel进行处理,沉水植物体内的药动学参数通过DAS 3.1进行计算,生物富集系数FBC=Cf/Cw,其中,Cf和Cw分别为药物在生物体内的浓度和水中的浓度。
2 结果与分析
2.1 前处理方法的建立
2.1.1 提取液的选择
分别采用乙腈、0.1%甲酸酸化乙腈、1%甲酸酸化乙腈、1%乙酸酸化乙腈和4%乙酸酸化乙腈,按照1.5的处理步骤,对添加ENR和CIP标准品(0.5μg·g-1)的沉水植物(苦草)样品进行提取,其加标回收率见图1。随着乙腈酸化程度的提高,ENR和CIP的回收率也相应提高,但杂质也随之增多,干扰加大,精密度下降。因此,选择提取液C(1%甲酸酸化乙腈)作为沉水植物中ENR和CIP的提取液。
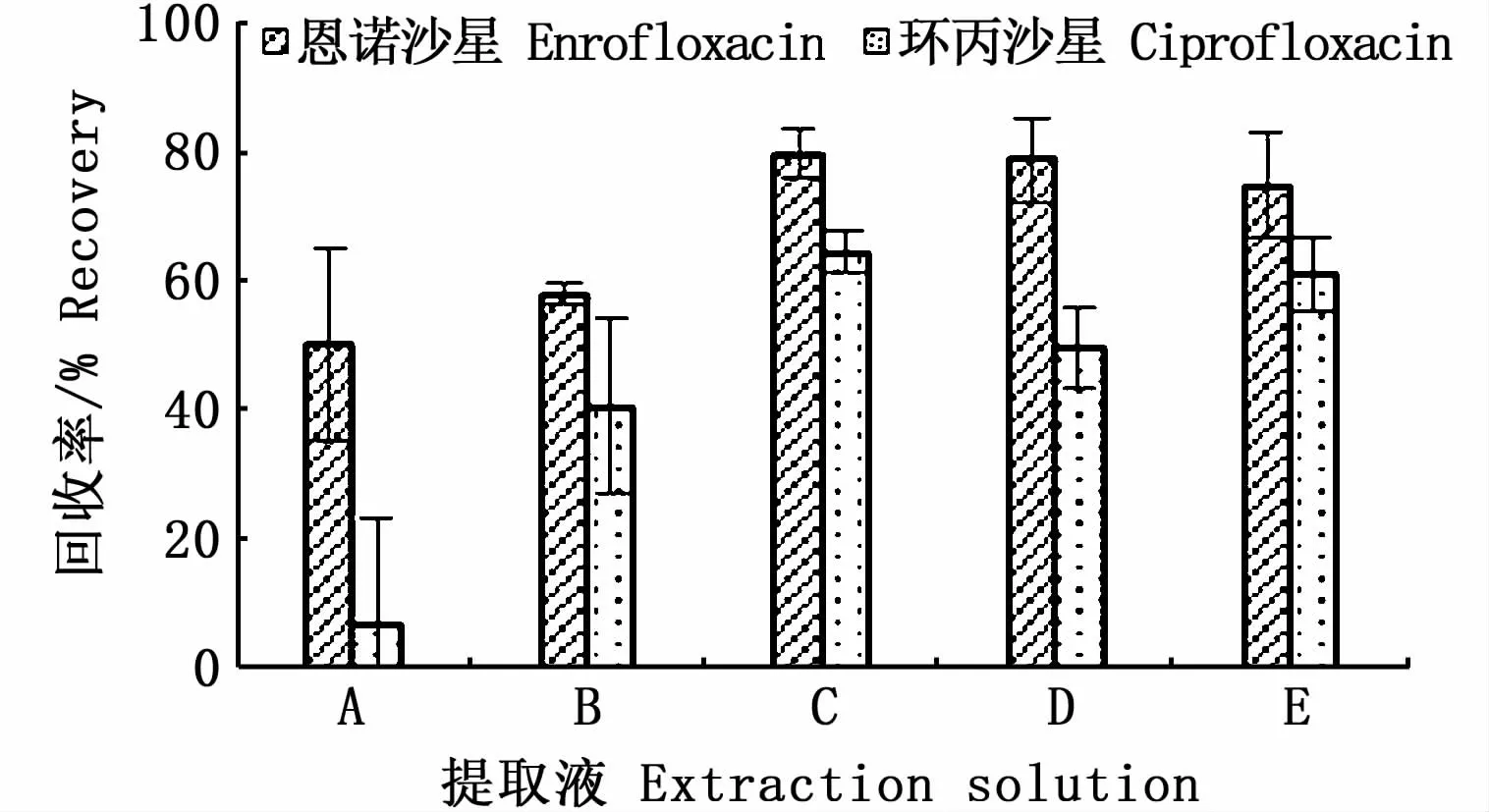
图1 不同提取液下沉水植物中恩诺沙星(ENR)和环丙沙星(CIP)的回收率(n=3)Fig.1 Recovery of ENR and CIP in submerged macrophytes under different extraction conditions(n=3)
2.1.2 萃取盐的选择
为了降低待测物在水相中的溶解度,使有机相和水相分层,设计了0.5 g NaCl、1.0 g NaCl、2.0 g NaCl、0.5 g无水Na2SO4、1.0 g无水Na2SO4和2.0 g无水Na2SO46组实验,结果表明,2种脱水盐对恩诺沙星回收率影响不大,对环丙沙星回收率略有影响,Na2SO4组的重复性没有NaCl稳定。从回收率、重现性来看,1.0 g NaCl组效果最优。
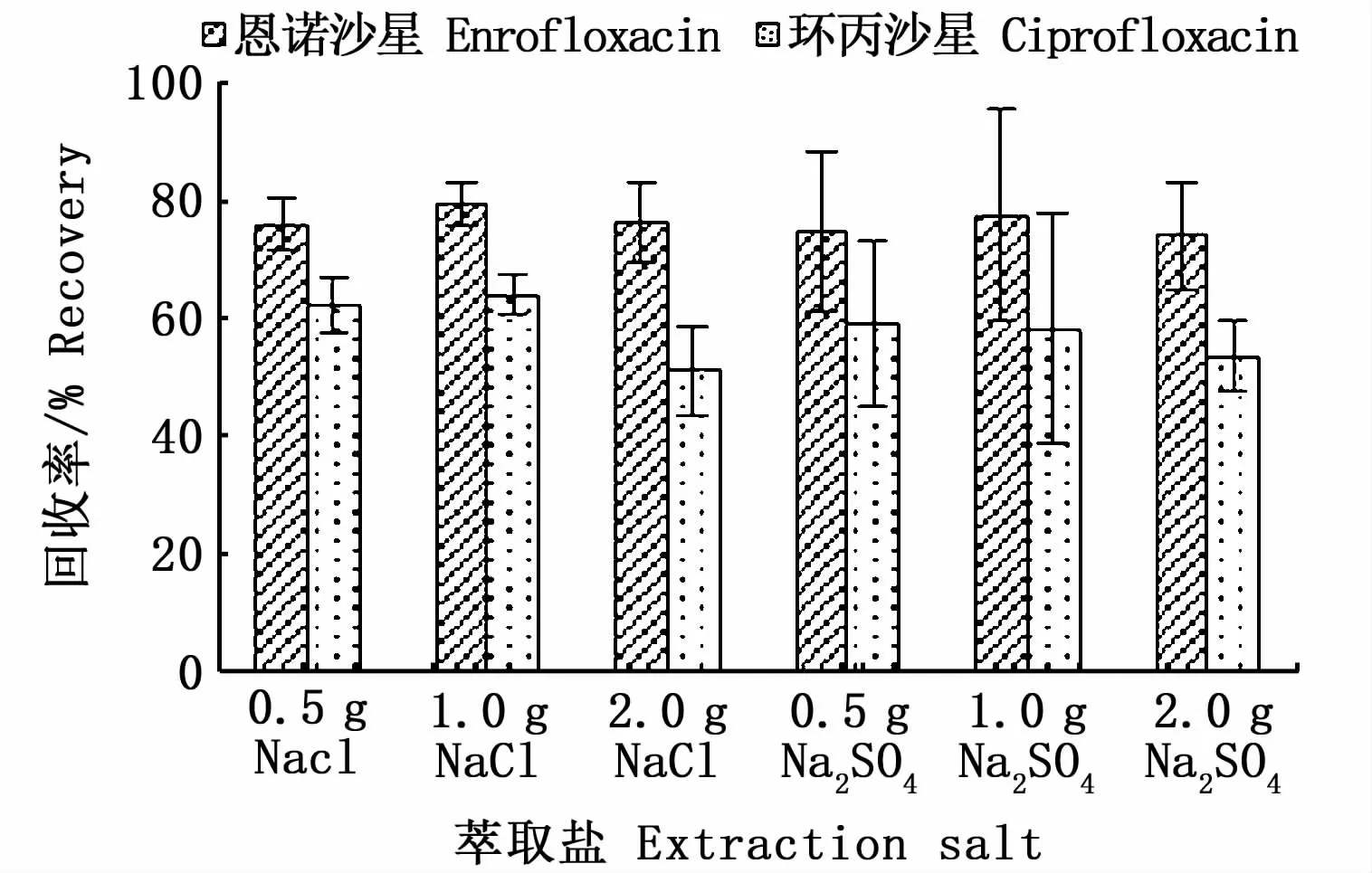
图2 不同脱水盐下沉水植物中恩诺沙星(ENR)和环丙沙星(CIP)的回收率(n=3)Fig.2 Recovery of ENR and CIP in submerged macrophytes with different extraction salts(n=3)
2.1.3 提取时间的选择
沉水植物匀浆在提取液中的涡旋时间长短对ENR和CIP回收率的影响结果见图3。提取效果主要由提取液和样品接触的提取时间所决定,涡旋提取15 min,ENR和CIP回收率最高,涡旋时间再延长未见回收率提高。

图3 不同提取时间下沉水植物中恩诺沙星(ENR)和环丙沙星(CIP)的回收率(n=3)Fig.3 Recovery of ENR and CIP in submerged macrophytes with different extraction time(n=3)
2.1.4 样品净化条件的优化
沉水植物水分含量高、色素含量高、基质复杂,采用QuEChERS法常用的净化剂PSA、GCB、氨基和C18去除样品中碳水化合物、脂肪酸和色素等极性物质[15]。实验设计了不同含量PSA(50 mg、100 mg和150 mg)、GCB(5 mg、10 mg和15 mg)、氨基(50 mg、100 mg和150 mg)和C18(50 mg、100 mg和150 mg)对沉水植物中恩诺沙星和环丙沙星回收率的影响(图4),结果表明,PSA和GCB的回收率及其重现性优于氨基和C18,50 mg的PSA和5 mg的GCB即可达到较高的回收率。进一步实验表明,两者同时使用,基线更加平稳,杂质干扰少。

图4 不同净化剂下沉水植物中恩诺沙星(ENR)和环丙沙星(CIP)的回收率(n=3)Fig.4 Recovery of ENR and CIP in submerged macrophytes cleaned by different purification agents(n=3)
2.2 方法学建立
2.2.1 沉水植物中ENR和CIP色谱行为
图5是ENR和CIP标准品、沉水植物空白样和加标样的HPLC色谱行为图。ENR和CIP的保留时间分别为4.25 min和3.35 min,基线平稳,药物峰分离良好,成BB峰,满足药物分析要求。
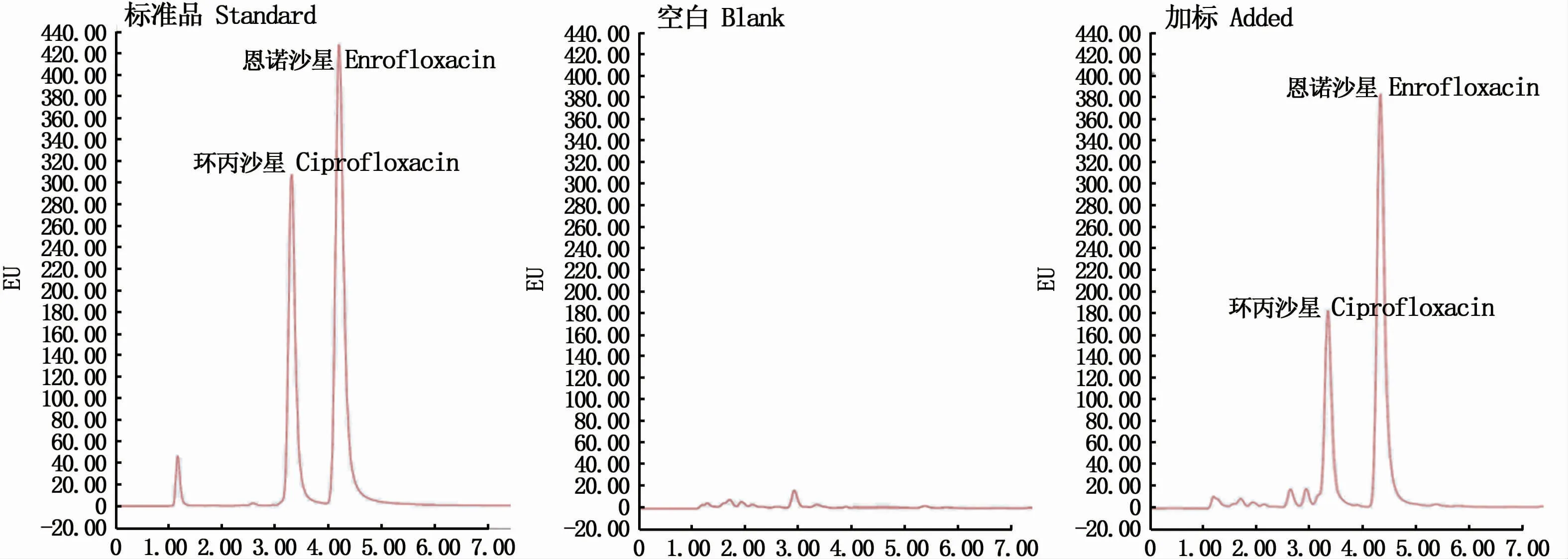
图5 0.5μg·mL-1 ENR和CIP标准品、沉水植物空白和沉水植物加标色谱图Fig.5 Chromatograms of 0.5μg·mL-1 ENR and CIP standard,blank submerged macrophyte and submerged macrophyte added standards
2.2.2 标准曲线和检测限
将恩诺沙星和环丙沙星混标母液(浓度分别为100 mg·L-1)稀释成1、0.5、0.2、0.1、0.05、0.01 m·L-1的标准品浓度进行HPLC分析,以药物峰面积(y)对应药物质量浓度(x)进行线性回归分析,ENR和CIP的标准曲线和检测限见表1。

表1 ENR和CIP的线性关系、相关系数和检测限Tab.1 Linear relationship,correlation coefficient and detection limit of ENR and CIP
2.2.3 回收率与精密度
在空白沉水植物(苦草、伊乐藻和轮叶黑藻)样品中设置ENR和CIP 3个添加水平(0.05、0.10、0.50μg·g-1),按优化后的方法测定回收率。结果显示,在3种沉水植物中ENR平均回收率为79.60%~104.90%,相对标准偏差为0.86%~10.90%;CIP平均回收率为57.26%~102.00%,相对标准偏差为0.80%~11.72%。
2.3 沉水植物对恩诺沙星的蓄积、代谢与消除
2.3.1 沉水植物对恩诺沙星的蓄积与消除规律
施药后,苦草、伊乐藻和轮叶黑藻中恩诺沙星含量随时间的变化见图6。沉水植物中恩诺沙星含量均呈现先快速升高、后下降的趋势,且均在施药后24 h达到最高值,分别为0.82μg·g-1、0.86μg·g-1和2.34μg·g-1,之后均呈缓慢下降的趋势,600 h时恩诺沙星浓度分别降至0.09μg·g-1、0.15μg·g-1和0.22μg·g-1;采用梯形法计算曲线下面积,分别为192.06(μg·g-1)·h、209.92(μg·g-1)·h和471.44(μg·g-1)·h。24 h时沉水植物中恩诺沙星含量最高,此时水样中恩诺沙星浓度平均为0.084 3μg·g-1,推算3种沉水植物对恩诺沙星的生物富集系数FBC分别为9.7、10.2和27.8。
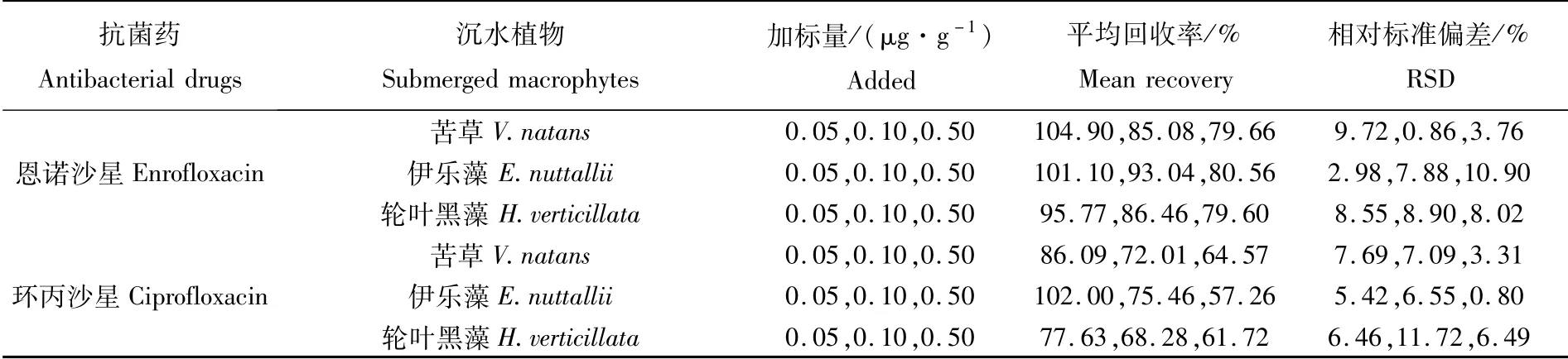
表2 不同沉水植物的加标回收率和精密度(n=3)Tab.2 Recovery and precision of different submerged macrophytes(n=3)

图6 沉水植物中恩诺沙星含量随时间变化(n=4)Fig.6 Profile of enrofloxacin concentrations in submerged macrophytes with time(n=4)
2.3.2 沉水植物中环丙沙星的消除规律
施药后,苦草、伊乐藻和轮叶黑藻中恩诺沙星代谢产物环丙沙星含量随时间的变化见图7。3种沉水植物中环丙沙星浓度总体趋势呈先上升后下降的趋势,且均在施药后72 h达到最高值,分别为0.027μg·g-1、0.029μg·g-1和0.037 μg·g-1,300 h后呈现缓慢下降趋势;采用梯形法计算曲线下面积,分别为8.42(μg·g-1)·h、8.21(μg·g-1)·h和12.21(μg·g-1)·h。苦草、伊乐藻和轮叶黑藻中代谢产物环丙沙星最高含量与恩诺沙星最高含量的百分比分别为3.29%、3.37%和1.58%,代谢产物环丙沙星曲线下面积与恩诺沙星的百分比分别为4.39%、3.87%和2.59%。
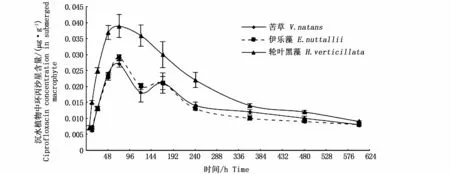
图7 沉水植物中环丙沙星含量随时间变化(n=4)Fig.7 Profile of ciprofloxacin concentrations in submerged macrophytes with time(n=4)
3 讨论
3.1 沉水植物中喹诺酮类的检测方法
沉水植物水分和色素含量高,基质复杂,干扰因素大,已有的前处理方法不能很好适用于沉水植物,本实验从提取液、脱水盐和吸附剂等几方面进行了优化。1)恩诺沙星和环丙沙星在酸性条件下溶解较好,在乙腈中添加甲酸或乙酸,使提取环境呈酸性,能有效抑制药物的离子化,从而提高了待测物在有机相中分配比例。2)QuEChERS法简便、快捷,常用于农产品药残检测的样品前处理,但商品化的QuEChERS试剂不适用于沉水植物。QuEChERS法处理生物样品时,为了降低待测物在水中的溶解度,通常加入NaCl、无水Na2SO4和无水MgSO4等萃取盐[15],因为喹诺酮类药物容易与Mg2+离子形成稳定的螯合物[16],本实验中仅比较了NaCl和无水Na2SO4,从实验结果来看NaCl提取效果的稳定性优于无水Na2SO4。3)比较了不同净化剂对喹诺酮类药物回收率的影响,其中C18对ENR和CIP存在一定的吸收,PSA、氨基和GCB的用量对其几乎没有影响,但氨基的稳定性远低于其他净化剂,而PSA结构中含有2个NH2,吸附量大于氨基,并且两个NH2可以螯合样品中的金属离子,GCB对蔬菜样品中的色素具有很好的吸附效果[17],因此本实验采用PSA和GCB组合,可以有效解决沉水植物中色素等杂质的干扰。
本方法回收率低于罗洁等[18]和田茂军等[19]在蔬菜中喹诺酮类的检测方法,推测其可能的原因是沉水植物在水径流作用下容易蓄积污染物,杂质干扰多从而导致回收率降低。但本方法通过萃取盐和净化剂分别去除水分和杂质,降低浓缩时间和节约成本,更有利于检测工作。
3.2 水生植物在去除水环境化学污染物中作用
水生植物是人工湿地和水产养殖尾水处理系统中的基本组成部分。水生植物不仅直接吸收水中的营养盐供其自身生长,并且能富集水中的农药、抗菌药和重金属等污染物,通过直接吸收、根系分泌作用和根区微生物作用,直接或间接去除化学污染物[20]。有研究报道,人工湿地中,磺胺甲■唑、罗红霉素和氧氟沙星3种抗菌药在种植风车草(Cyperus involucratus)条件下的去除率均高于未种植水生植物的去除率[21]。FERNANDES等[22]在实验室条件下确定了芦苇能吸收并降解恩诺沙星;ZHANG等[12]在模拟池塘环境中发现欧亚苦草(Vallisneria spiralis)能有效去除底泥中的恩诺沙星和环丙沙星,但没有明确是水生植物的吸收降解,还是光降解、水解作用,或是底泥微生物的作用。本实验比较了3种水生植物对恩诺沙星的蓄积作用,发现轮叶黑藻对水环境中恩诺沙星富集远大于其他两种沉水植物,说明研究药物在植物体内的代谢、蓄积和消除规律是明确植物作用的重要手段。
3.3 恩诺沙星在水生植物中的代谢
关于恩诺沙星代谢产物的研究在真菌、哺乳动物、家禽类动物和水生动物中报道很多,但对于水生植物中恩诺沙星代谢产物的研究,仅在欧亚苦草(Vallisneria spiralis)[12]、加拿大伊 乐 藻(Elodea canadensis)[13]、反 枝 苋(Amaranthus retroflexus)[23]、大车前(Plantago major)[23]、小酸模(Rumex acetosella)[23]和 满 江 红(Azolla filiculoides)[23]等植物中提及能将恩诺沙星代谢成环丙沙星,本研究结果与其相一致,在苦草、伊乐藻和轮叶黑藻都能检测到代谢产物环丙沙星的存在,从代谢产物环丙沙星最高含量和曲线下面积来看,与恩诺沙星在水生动物中较为接近[23-24]。GOMES等[13]提出了细胞色素P450很可能参与了水蕰草中恩诺沙星代谢生成环丙沙星的过程,目前关于水生植物中恩诺沙星代谢的研究仅局限于检出环丙沙星,恩诺沙星在水生植物中的代谢机制还需今后进一步深入研究。
