小角X射线散射实验中蛋白质溶液的辐照损伤及防护方法*
2022-09-22邢雪青吴忠华
邢雪青 刘 超 默 广 史 颖 吴忠华**
(1)中国科学院高能物理研究所,北京 100049;2)沈阳化工大学高分子产业高端制造研究院,沈阳 110142)
同步辐射照射物质后,会与物质发生相互作用,导致物质中产生不同程度的辐照损伤。同步辐射使物质产生辐照损伤的相互作用[1]有4种形式,即直接(主要、次要)相互作用和间接(主要、次要)相互作用。直接主要相互作用是:目标原子中的光电效应,即产生一个离子和一个快电子(光电子);直接次要相互作用是:光电子的非弹性散射,即产生电子级联和电离。间接主要相互作用是:溶剂分子中的光电效应,即从溶剂中产生自由基等活性物质(如OH自由基);间接次要相互作用是:自由基等活性物质对目标分子产生化学损伤。一般来说,在固体材料中,辐照损伤以直接相互作用为主。当有水分子存在时,间接相互作用出现,甚至占据主导位置。无论哪种相互作用,辐照导致的结构改变对于同步辐射结构表征都会产生负面影响。特别是随着同步辐射技术的进步,光子通量越来越高[2-4],辐照引起的损伤问题势必越来越严重。在具体的表征实验中,如何评估辐照损伤程度以及如何降低辐照损伤是一个不容忽视的问题。
通常,有机物比无机物的辐照耐受度要差[1]。在常用到的5~20 keV能量范围内,1012cps以内的光通量下,蛋白质等生物大分子受到的辐照损伤最严重[5-7]。小角X射线散射(SAXS)技术是研究蛋白质分子在溶液中的形状、构象、组装和折叠等结构信息的有力工具,并已普遍应用于溶液中生物大分子的结构表征[8-11]。在过去的几十年中,SAXS和广角X射线散射(WAXS)技术研究结构生物学取得了重要的影响,SAXS数据库SASBDB(www.sasbdb.org)自2018年开始向公众发布。截止到2022年1月中旬,该数据库已收集2 520套SAXS实验数据集和3 606个模型[12]。
当高能X射线辐照到蛋白质分子时,会诱导蛋白质分子发生一系列的结构和化学改变,即产生辐照损伤。辐照损伤的产生将严重影响X射线探测实验数据的准确性,在具体的实验中需要根据蛋白质分子的具体情况采取必要的防护措施。蛋白质等生物大分子溶液的辐照损伤产生机理与影响因素决定了如何选择辐照损伤防护策略及其有效性。
1 蛋白质溶液的辐照损伤及影响因素
有关蛋白质等生物大分子晶体辐照损伤效应的研究已经有30多年的历史[13-20,7],这些研究提供了晶体结构辐照损伤效应的识别和量化工具[21-23]。同步辐射SAXS实验中蛋白质等生物大分子溶液的辐照损伤研究也同样历史悠久[24-26]。入射X射线与溶剂水反应产生各种自由基[6,26],自由基又与蛋白质分子发生氧化还原反应,对蛋白质分子结构产生破坏作用,这种通过自由基发生的间接作用比X射线直接作用的辐照损伤危害性还大[27-28]。在一定条件下,溶剂水因同步辐射束照射而发生光解的过程中将产生羟基(OH•)、过氧化氢(HO2•)、活性氧,以及溶剂化电子等自由基[6,28-29]。这些高度反应活性的物质会与蛋白质吸收X射线后形成的自由基结合,导致非常快的多肽链的自由基激活,自由基激活的蛋白质之间的相互作用会产生辐照诱导的聚集物[30]。
使样品结构发生明显改变的辐照剂量称为临界辐照剂量。样品的临界辐照剂量越大,说明其对抗辐照损伤的能力越强。蛋白质分子临界辐照剂量在SAXS实验中要比晶体衍射中低几个数量级[31]。如常温下溶菌酶晶体可以承受约500 kGy的剂量,而溶菌酶溶液只可承受不超过约400 Gy的剂量[30],若使用甘油来调整蛋白质之间的相互作用,则溶菌酶溶液可承受约1 kGy的辐照剂量[30,32]。不同的蛋白质分子的辐照损伤耐受度差异很大,通常在SAXS实验之前预测样品是否容易受到辐射损伤是很困难的,需要根据具体情况进行具体处理。在受辐照的蛋白质稀溶液中会产生肽链的裂解和聚合,在冷冻蛋白质溶液中可以观察到碎裂,但没有聚合产物。自由基清除剂的使用表明,羟基自由基对固体状态下的碎片化和失活没有显著的贡献,而水化电子与蛋白质裂解过程紧密相关[28,33]。
辐照引起的严重结构损伤甚至可目测判断出来,比如清澈溶液中因辐照而有絮状物析出等。大部分情况下,辐照损伤不能通过目测来判断,需要通过表征数据的变化来判断辐照损伤的产生及程度。辐照损伤的产生及程度除与样品本身的特性有关,与样品所处的环境因素也有很大的关系,比如温度、湿度、氧含量等对样品的辐照损伤也有重要影响[1,34-36]。除了样品本身的特性以及环境因素外,影响蛋白质溶液辐照损伤的主要是辐照参数:光束通量、光子能量、探测器效率等,其中影响最大的是光束通量。随着同步辐射束线技术的进步,所提供的X射线通量及通量密度越来越高,导致的辐照损伤或许还会表现出新的特性,如在新升级的第四代光源ESRF-EBS,在高通量下(2×1013cps),高能量(43.44 keV)的光对金属等比较耐辐照的样品也会产生较强的热效应而使其产生结构损伤[37],相应的对辐照损伤的防护也提出了新的挑战。总之,辐照损伤与样品的特性、环境,以及辐照参数息息相关,因而辐照损伤的防护策略也主要从这些方面加以考虑。在讨论辐照损伤防护策略之前,首先要讲解辐照损伤研究中的一个重要物理量——辐照剂量。
2 辐照剂量与临界辐照剂量的定义与计算
不同的光束线具有不同的光束通量、光子能量、光斑尺寸,及光斑形状等。为了方便不同光束线的辐照损伤防护策略进行相互比较和借鉴,统一使用辐照剂量的国际单位(SI)Gy(J/kg)来表示。其定义是每单位质量所吸收的能量,与入射X射线光束通量成正比关系,与入射X射线光子能量、透射系数、光斑尺寸、样品厚度等相关。样品受到的X射线辐照剂量[31]可表示为:
texp是曝光时间(s),f是X射线通量(phs/s),E是X射线能量(J),T是样品透射系数,V是射线照射体积(cm3),ρ是样品质量密度(kg/cm3)。公式(1)表明入射X射线能量E与辐照剂量D成正比。入射X射线能量E还直接影响X射线的透射系数T。接收X射线散射信号的探测器效率高低则直接影响着每帧图像的最短采集时间。精确测量样品处光斑的尺寸对于合理估计样品受到的辐照剂量至关重要。对于液态状的样品,如果样品池有窗口材料,则样品前窗口材料会引起照射到样品上的光强衰减,这部分衰减会导致公式(1)中f的减小,因此需要精确计算出来,可通过窗口材料元素组成及比例得到总的吸收系数,根据吸收公式进行计算可得窗口材料对光强的吸收。
通常,样品辐照损伤的程度可以定性地通过观测经X射线照射后每帧散射图像的变化来判断,但是,用辐照剂量描述的辐照损伤更加定量化。辐照诱导的蛋白质分子聚集只有在至少两个蛋白质分子或“目标”被激活时才会发生[34],即蛋白质发生辐照聚集或其他辐照损伤需要接受一定的辐照剂量(即临界剂量)。临界辐照剂量值是产生辐照损伤前样品可以承受的最大辐照剂量。Jeffries等[27]定义蛋白质溶液的临界辐照剂量为:引起蛋白质回转半径Rg产生0.1 nm偏差所需要的最低辐照剂量。考虑有限样品路径的情况下,临界辐照剂量DThresh可由下式计算得到:
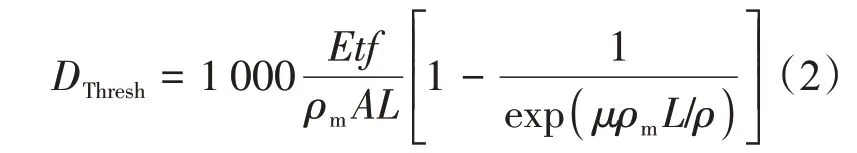
上式中,E为每个光子的能量(单位J/photon),t为从开始曝光至达到临界剂量所经历的时间(s),可以直接从Rg随时间变化的作图中得到。f表示样品经受的光束通量(photons/s)。ρm为样品的质量密度(g/cm3)。A为辐照到样品上的光斑总面积(cm2)。L为光束穿过试样的厚度(cm)。μ/ρ为样品平均质量吸收系数(cm2/g)。因子1 000是为了将剂量单位由J/g转换成J/kg,即Gy。鉴于回转半径的计算与散射背底的扣除密切相关,因此,实验中需要注意背底数据测量的准确性以及扣除方式。比如实验中在测量样品前后注意及时测量背底数据,扣除背底散射时需注意对使用探测器暗电流等的矫正,使用通过样品后的光强对数据进行归一化等。
RADDOSE-3D是计算临界辐照剂量的免费开源软件[22,38]。该软件最初用于X射线大分子晶体学(MX)实验中计算蛋白质晶体吸收的时间和空间 分 辨 三 维 剂 量 分 布[22]。Brooks等[39]对RADDOSE-3D进行了扩展,使SAXS实验的剂量计算变得方便可行。该软件考虑了SAXS实验中的三维几何、毛细管的圆柱形几何形状、样品的液体组成,以及毛细管材料对光束的衰减。使用RADDOSE-3D计算的辐照剂量是经过衍射加权的剂量(DWD)[23]。采集的每一幅散射图所对应的光束通量可通过光电二极管计数得到[39]。
3 蛋白质溶液的辐照损伤判断标准
在蛋白质等生物大分子SAXS实验中,获得可靠散射数据的前提是得到单散射、无聚集的样品,并且在整个测量过程中始终保持样品的这种单散状态。因此,避免因辐照损伤导致蛋白质分子的聚集、展开,以及碎片化[30,33,40],这是小角散射技术的一个关键瓶颈问题。辐照损伤导致聚集效应表现为低角度SAXS强度的增加,而碎片化效应则相反,会导致低角度SAXS强度的降低;蛋白质荷电引起的分子排斥也会降低低角部分散射强度;蛋白质分子的展开通常会导致其回转半径的增大等[30,33]。辐照损伤大多表现为蛋白质聚集,一般不会发生蛋白质分子较大的构象变化或多肽裂解[30]。
辐照损伤会导致所采集的散射数据不能使用,因此需要对辐照损伤的起点进行判断。具体方法有:对样品连续采集一系列散射图谱(帧),通过观察比较散射曲线的变化简单定性分析辐照损伤的起点;获取每条散射曲线零角度散射强度I(0)和回转半径Rg的变化,当变化达到一定程度便表示结构发生变化了;通过软件计算连续采集的散射数据的差异等。
3.1 通过回转半径Rg和或零角度强度I(0)判断
一般认为球状蛋白的Rg增加0.1 nm就代表球状蛋白有显著的质量重分布[30]。利用Rg对溶液中粒子形状和大小的敏感性,可使Rg成为一个量化辐 照 损 伤 的 简 便 手 段[30,41]。对 散 射 数 据 作ln[I(q)]~q2曲线,在0.8<qRgu<1.3范围内,对实验数据作线性回归可用作一种评估辐照损伤的经验手段。上述Rgu是指样品没有受到辐照损伤时的回转半径。对散射曲线的线性回归得到的斜率可用于计算辐照损伤后样品的虚拟回转半径Rgps。此处Rgps并不严格等于聚集后的颗粒回转半径,只是用来表示一种聚集效应的累积[27]。根据回转半径的变化(Rgps-Rgu)可以简单定性分析辐照损伤的起点。已有研究表明辐照损伤与辐照剂量、蛋白质(溶菌酶)溶液浓度、剂量率(单位时间的辐照剂量)密切相关[30,42]:对每一个蛋白质分子溶液而言,存在一个剂量阈值,阈值以下不会造成辐照损伤,阈值以上辐照损伤随剂量的增大而变得严重[30];溶液中的辐照效应与蛋白质的浓度有关[43],在较低的蛋白质浓度下,产生一种“稀释效应”,溶液稀释1倍辐照损害将变成2倍[43],单位辐照剂量产生一定量的OH自由基,可以激活一定数量的蛋白质分子[30];在较高的剂量率下,自由基激活的溶菌酶在给定的辐照剂量下会更集中并相关联[30]。
3.2 判断辐照损伤起点
为了防止辐照损伤对实验结果产生影响,蛋白质溶液的SAXS数据的采集时间都极短,导致每帧的信噪比都较差,因此有必要确定任意两个散射曲线是否相似[39],从而将相似曲线进行平均来降低噪声,同时判断出辐照损伤的起点,得到临界剂量值。每帧之间的相似度可使用ATSAS软件包中DATCMP[44]程序的CorMap[45]检验功能进行评估。CorMap检验是在两曲线相似的空值假设(null hypothesis)下,观察计算两曲线差值为正值或负值的最长延伸的概率P。如果P高于一个给定的显著性阈值,那么可以认为相比较的两帧是相似的[39]。CorMap检验对每个实验连续采集的前3条曲线(帧)进行两两比较,以确保它们是相似的(设定阈值P>0.01)。然后将所有后续帧与第一帧进行比较。当CorMap检验在P=0.01显著性水平上发现3个连续帧(为了排除通过光束的异常值,例如气泡或粒子)不相似时,认定辐照损伤变得显著。在3个连续的不同帧中,将第一帧所代表的样品吸收辐照剂量定义为阈值或临界剂量DThresh。
Brooks等[39]开发了一个Python库,对散射曲线相似度检验的结果可进行可视化分析。利用这一点,就有可能为显著的辐照损伤起点定义一个简单的度量标准。可视化分析的核心之一是两帧之间的相关矩阵(图1)。这些相关图显示出两帧之间的相似度。当两帧相似时,相关图类似于随机晶格(图1a,b),表示相比较的两条曲线中数据两两相减,差值取正取负完全随机。然而,当任意两帧之间有系统差异时,相关图中会有大区域连续的黑色或白色(图1c,d),即差值不再随机,有连续多个数据点之间差值连续取正或连续取负。上述数据在ESRF的BM29束线上的BioSAXS实验站采集[39]。
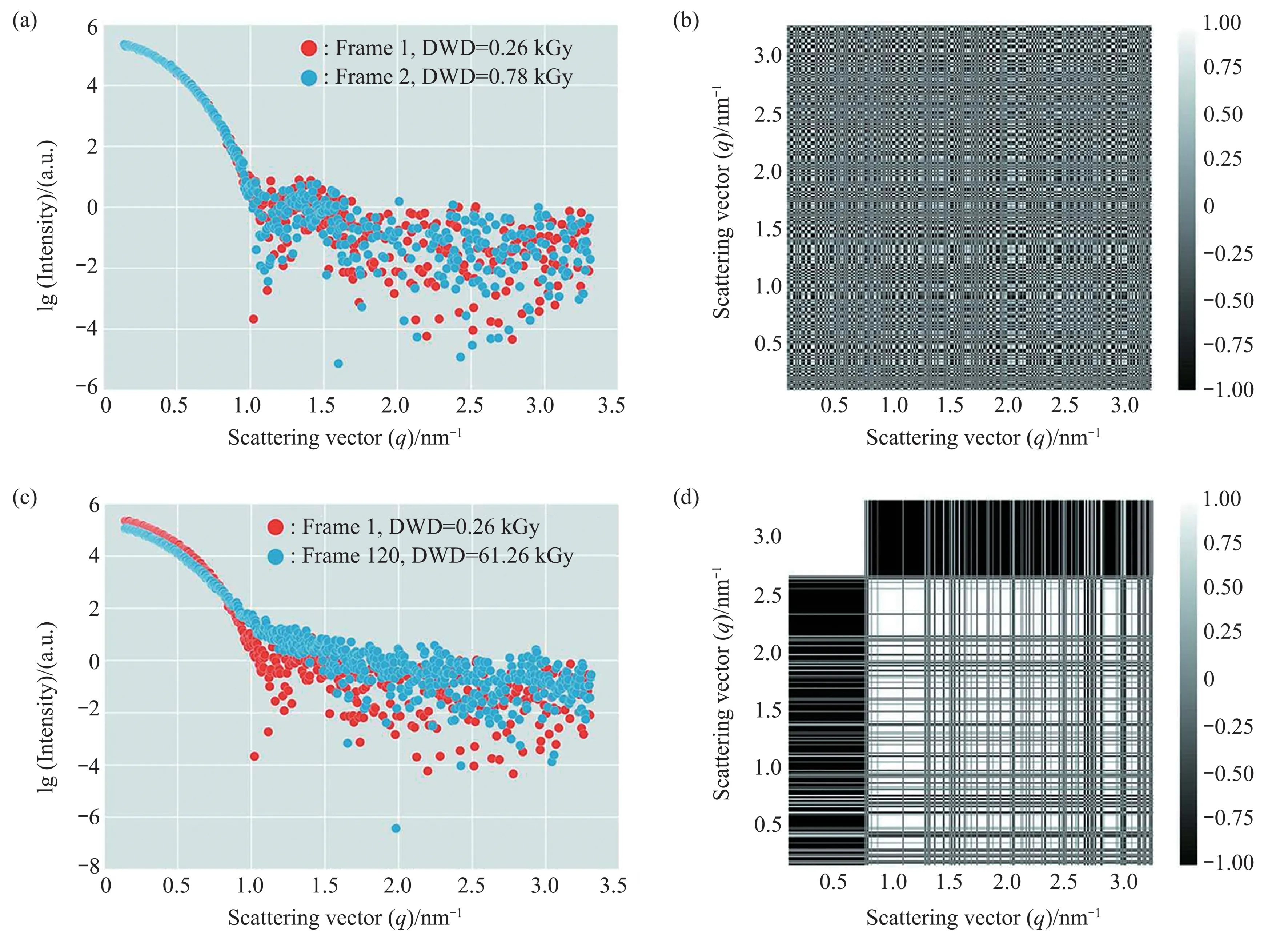
Fig.1 Similarity comparison of continuous acquisition frames of GI protein[39]图1 连续采集GI蛋白质溶液SAXS曲线相似度比较[39]
另外可分别以每帧作为参考帧对辐照损伤进程进行可视化分析[39],计算每帧与其余帧之间的相似度形成的散点图。Brooks等[39]计算了采集的第2~120条曲线与采集的第1条曲线的相似度图谱。使用变量C代表在对应的两两相关图中连续白色或黑色块的最长长度。每一点根据该点横坐标对应散射数据与第一条散射曲线相关CorMap的P值取色,P=1,表示对应比较的两条曲线是相似的,对应该散点取蓝色;P<0.01,表示对应比较的两条曲线不相似,对应该散点取橙色。介于0.01和1之间的点标为绿色,表示两条曲线也是相似的。采用10 mmol/L二硫苏糖醇(DTT)保护剂添加进GI(葡萄糖异构酶)溶液中,将采集的120帧数据分别两两比较按上述相同的涂色方式得到热图[39]。如果仅考虑和第1帧比较,那么从第8帧开始就已经发生辐照损伤。然而,经过所有帧两两比较后发现,第8帧到第57帧之间的数据可以认为和第7帧是相似的。因此,第8~57帧对应的散射曲线也是可用的,对应的样品可看作未发生辐照损伤[39]。CorMap的优点是其不使用实验强度上的误差,这些误差在数据处理过程中往往因不准确传递而被错误估计。为了使不同研究人员的实验相互间具有可比性,最有效的方法是将辐照损害的进程作为样品吸收剂量的函数进行追踪。CorMap结合RADDOSE-3D获得辐照损伤的曲线起点以及对应的辐照剂量阈值[39]。
4 蛋白质溶液SAXS辐照损伤防护方法
对蛋白质溶液的SAXS实验而言,整个测量过程中始终保持样品的单分散状态是获得有效数据的基础。然而,辐照损伤通常会改变样品的单分散性。因此,蛋白质溶液的SAXS测量需要最大限度地降低辐照损伤,延长有效采谱时间,增加数据信噪比。由于蛋白质等生物大分子的独特性,它们的临界辐照剂量高度依赖样品。有些蛋白质分子可以经受长时间的同步辐射照射而不产生辐照损伤,有些蛋白质分子则会很快变性析出。更为复杂的是,临界剂量很可能随着溶剂条件(盐种类、pH等)的变化而改变。因此,辐照损伤防护策略需要根据每种蛋白质分子的具体特性,从环境、辐照参数等方面综合考虑。蛋白质的辐照损伤可能严重依赖于其形成聚集体的倾向,也可能依赖于缓冲液成分,改变缓冲液也可能改变蛋白质形成聚集体的倾向。所以,SAXS实验前要充分调研样品,尽量获得全面的样品信息,设计有效的采谱方案,优化数据的采集方式[1]。实验中采取积极有效方式,避免不必要的照射,使用高敏低噪声探测器,尽量缩短曝光时间并增强信噪比[1]。总之,要在减少辐照损伤的前提下安全地获得SAXS数据。
降低蛋白质溶液辐照损伤的总体思路是:减少样品单次曝光的受辐照剂量,提高样品的辐照剂量阈值(临界辐照剂量)。从辐照剂量计算公式(1)可以看出:衰减光通量[27]、减少单幅图(帧)的曝光时间[2,46-53]、散焦光斑[36]、使液体振荡/移动/循环/流动[54-60,27]、使用低能量入射X射线等方法都可以减少单幅图(帧)对应的单位体积样品受到的辐照剂量,从而避免或减缓辐照损伤的发生。此外,低温/冷冻[31,61]、添加保护剂(常温保护剂和低温保护剂)[30-31,39,54,62-67]、使用共振软X射线等方法等也可以提高样品的辐照剂量阈值[68],获得更长的有效采谱时间,以增强数据信噪比。以下将从衰减光强、减少曝光时间、样品流动、冷冻、添加保护剂、降低入射X射线光子能量等6个方面介绍辐照损伤的防护措施及效果。
4.1 衰减入射光强法
当蛋白质溶液的单幅SAXS图(帧)的采集时间已是实验站可实现的最短曝光时间,而采集到的前两幅图就不相似,导致无法判断采集的第一幅图谱是否已受辐照损伤的影响。在这种情况下,衰减光强是降低辐照损伤首当其冲的方式,尤其对于一些不需要超快时间分辨或者瞬态研究的样品来说更是如此。欧洲分子生物学实验室(EMBL)的P12 BioSAXS束线[69]光通量最高可达1013photons/s,但其经常使用的通量是5.1×1012photons/s。该束线配备了一套光通量衰减器,由3个过滤转盘组成。每个过滤转盘上可安装10个衰减箔,其中1个为空。第1个转盘上安装有6~54 μm的9个铝箔,第2个转盘上有60~540 μm的9个铝箔,第3个有75~675 μm的9个钛箔。通过3个转盘可以得到1 000种不同衰减程度的组合,例如在10 keV处,光通量可得到从0.96到2×1015的不同衰减倍数。因此,可以针对特定的样品微调或定制不同的入射光强度。图2a~c[27]展示了溶菌酶溶液(4.4 g/L)散射强度随入射光强衰减程度的变化。从连续采集5次曝光50 ms的散射曲线可以看到,在未衰减光强(5.1×1012phs/s)时,最先采集的两条曲线差别就很大,说明起码从第2条曲线开始,也可能第1条曲线对应的蛋白质已经发生辐照损伤。但是衰减到7.3×1011phs/s和1.8×1011phs/s后,连续采集的5条散射曲线表明对应的蛋白质并未发生辐照损伤,但是信噪比却变差。所以,在使用衰减入射光强以降低辐照损伤时,在降低信噪比和减少辐照损伤之间达到最佳平衡是关键。图2d给出了不同衰减水平下散射数据的初始损伤速率(此处定义为回转半径随时间的变化值ΔRpsg·s-1)。由此可知,入射X射线强度越高,初始损伤率就越大。

Fig.2 Effect of incident intensity attenuation on the critical dose of samples[27]图2 光强衰减对样品临界剂量的影响[27]
4.2 减少单次曝光时间法
减少单幅图的曝光时间是降低单幅图对应辐照剂量最简单且最常用的方式。EMBL的P12生物SAXS束线是关注辐照损伤最多的SAXS束线之一,在该束线上使用频率最高的采谱方式是50 ms/帧[2,46-49,52,70],先进行1 s内的50 ms×20幅图的采集,若此20帧没有发生辐照损伤,后续便直接采用每幅图1 s曝光时间的连续采集,直至所需要的数据量[46]并比较。
日本Spring8的BL40XU束线光子通量为1×1015phs/s,通过不同的脉冲方式实现了微秒[3]、亚纳秒[71]、皮秒[4]时间尺度的数据采集。其中,微秒X射线脉冲用于蛋白质晶体衍射和小角散射实验,获得蛋白质分子瞬态结构信息。采谱时间降低到微秒可大大降低单幅SAXS图受到的辐照剂量。Sigma Koki公司为此束线制作了所有的快门系统,通过圆盘旋转快门和刀片通断摆动快门的组合实现6微秒X射线脉冲。
在辐照剂量超高的自由电子激光(XFELs)中,预防辐照损伤的主要方式是采用串列晶体学方法[72-73],每个喷射而出的样品悬浮液滴最多被一个脉冲照射,照射X射线脉冲可短到飞秒量级,因而每一幅图的曝光时间极短。一般要求单次曝光脉冲持续时间要短于辐照损伤所需时间,以使辐照损伤还来不及发生,以极高的剂量(如100 Ggy,8 keV)在极短的时间(如<40 fs)内将需要的信号采集完成。
总之,减少单幅图的曝光时间,连续曝光多次,直到辐照损伤导致SAXS图谱发生明显变化,再将辐照损伤发生前的数据平均得到最终数据。减少单次曝光时间的方法是最常见的避免辐照损伤的方法。此外,使样品流动也能有效减少辐照损伤,也是常用到的一种方式。
4.3 样品流动法
为了降低辐照剂量同时提高信噪比,可增大样品光照体积,将辐照剂量平摊到更多的样品中,如通过使X射线光束散焦变大,但此方式效果有限,且可能降低空间分辨率。常用且效果更佳的方法是流动或平移样品,缩短光束照射同一处样品的时间。通过样品流动的方式将辐照剂量分摊到更大的体积中,从而降低单位质量样品吸收的能量,即辐照剂量,达到减少辐照损伤、延长有效总曝光时间的目的。XFELs中的液体样品通过液体射流、气溶胶或分子束的方式持续地传送到X射线光束中[72-73],保证每个入射X射线脉冲照射的都是新鲜的样品。此方法通常需要的样品量较大,对于比较珍贵或者稀少的样品则不适合。可考虑样品振动或循环流动的方式。溶菌酶水溶液的流动状态(流速30 μl/s)和静止状态相比,临界剂量起码提高了5倍[27]。
普通流动的方式对减少辐照损伤虽然有效,但是由于样品在毛细管中流动时,处于层流状态,毛细管中心和管壁之间的流速分布很不均匀。毛细管中蛋白质溶液的层流可以用一个简单的抛物线径向速度曲线来描述[74]。由毛细管中的层流速度公式(3)可知:在管壁处的流速趋于零[54]。
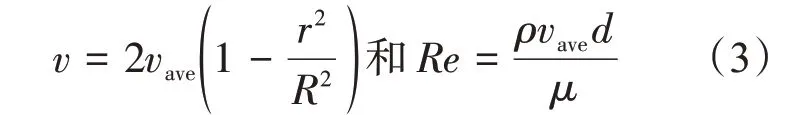
由剂量公式(1)可知蛋白质分子受到的X射线剂量与它在光束中的停留时间成正比,因此,流速分布对辐照剂量在样品中的分布有很大的影响,流速趋近于零的边界条件导致了样品管壁附近承受着极高的辐照剂量[57]。
为了克服普通层流模式下管壁处样品因不流动而受到的严重辐照损伤,Kirby等[54]在澳大利亚同步加速器的SAXS/WAXS束线上使用共流法进行了共流状态下核糖核酸酶RNAse A蛋白质溶液耐辐照损伤的研究。该共流法需要一个特制的共流毛细管样品池(图3)。在共流样品池中,缓冲液靠近毛细管内壁流动,而样品集中在毛细管中间流动。缓冲液流量由泵控制的总流出量和样品流入量的差值决定。中心采样流的直径取决于总流量中的分数样品流量。同时为了消除测量时间内辐照损伤对缓冲液的影响,还可在缓冲液中加入适量甘油。不同入射光强条件下,分析比较了样品在普通流动池和共流池中分别获得的SAXS一维曲线的统计相似性、回转半径、最大尺寸、低角部分散射强度、整体散射强度、零角度强度、Porod体积、分子质量等多个参数,结果显示:各个参数受辐照损伤的影响在共流模式下都比普通流动模式下小。用于SAXS测量的毛细管若被污染,会导致背底数据出现错误,进而使采集到的蛋白质散射信号变得不准确。此共流模式不仅对蛋白质辐照损伤有保护作用,同时还可以避免毛细管的污染。样品流动是保护蛋白质溶液免受辐照损伤的一种有效方式。与普通流动相比,共流方式(蛋白质溶液在毛细管的中心,不接触管壁)可以使蛋白质溶液辐照耐受度比普通流动的方式提高一个数量级。因此与静止模式相比,选择速度合适的共流模式可使辐照损伤临界剂量至少提高50倍。
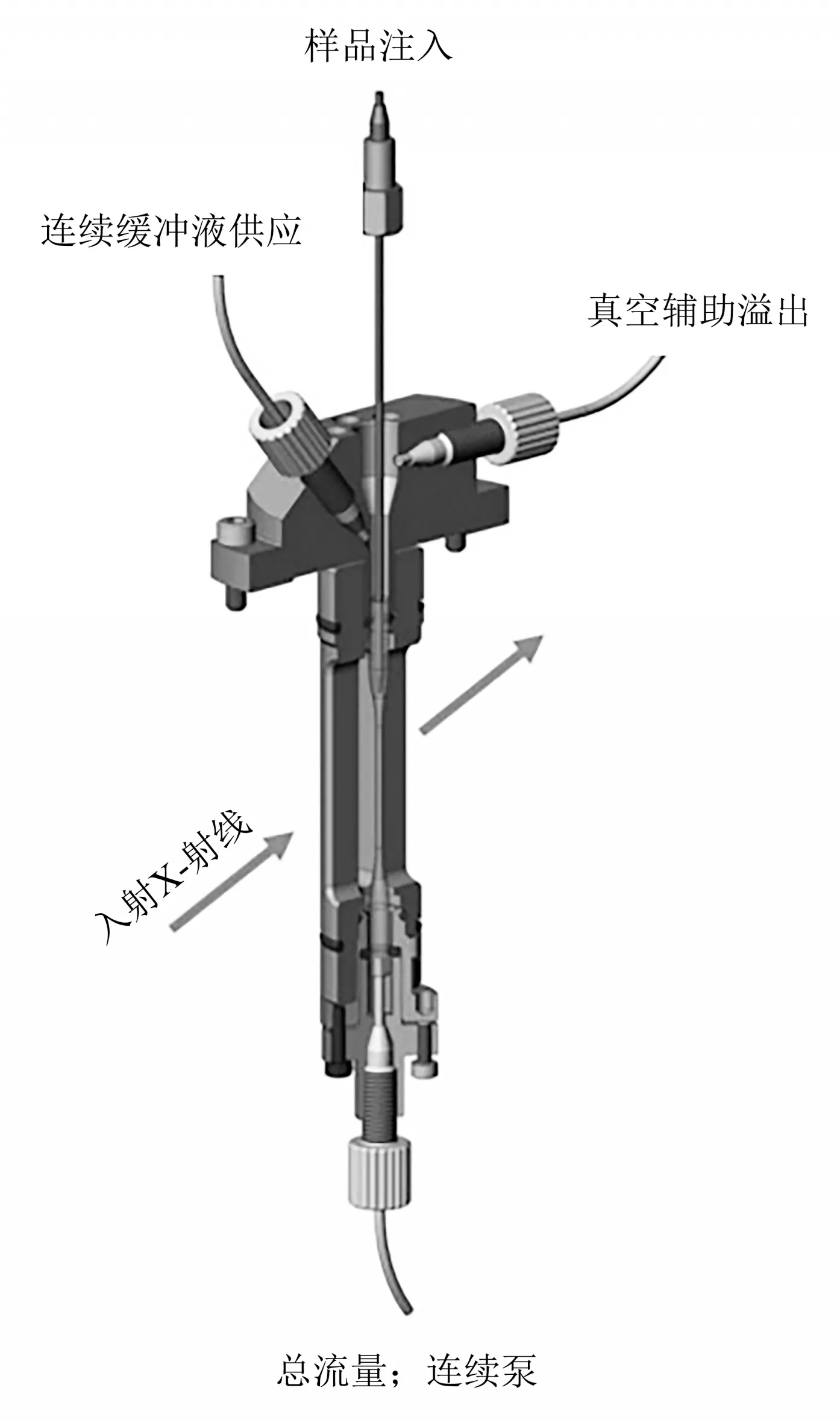
Fig.3 Cross-sectional view of the sheath flow sample cell[54]图3 共流样品池剖视图[54]
相对来说,共流模式还没有普通流动模式应用广泛。因此有必要介绍一下普通流动模式下毛细管直径的选择。在普通流动模式下,最佳样品厚度只考虑最佳散射,或样品的最佳吸收厚度为1,即μx≈1,μ为样品吸收系数,x为样品物理厚度。溶液样品的最佳厚度为水的吸收系数的倒数,大致为1 mm(8 keV时)或2 mm(10 keV时)。对辐照非常敏感的样品而言,样品最佳厚度的计算除考虑散射外,还需要考虑辐照损伤。Schroer等[74]对比研究了两种直径的毛细管对最终散射数据的影响。只考虑散射信号计算的最佳厚度为1.9 mm(10 keV时),选择接近最佳样品厚度的毛细管尺寸(内径尺寸1.7 mm)。另一种考虑到散射信号和辐照损伤,选择小于理论计算最佳厚度的尺寸,选为0.9 mm。选择更小直径的毛细管是为了增加受照与不受照体积的比例,从而提高样品的利用率,但需注意毛细管的直径不能小于光斑的尺寸,否则浪费光通量。此外,对于连续流实验,更小的毛细管可以获得更高的流速,以便更快地通过光束和更新样品,从而减少辐照损伤的累积效应。尽管更小的毛细管直径会降低信噪比,但是结合更有效的数据收集方案可以额外补偿光路长度(毛细管直径)减少引起的信号减弱,最终从未损坏的样品中得到更高质量的散射数据。
通过测试比较发现:直径小于最佳厚度(特定能量下吸收系数的倒数)的毛细管确实能全面改进辐照敏感生物样品的SAXS曲线。图4比较了两种尺寸毛细管样品散射曲线随时间的变化,显示使用更小直径的毛细管确实会增加样品的辐照剂量阈值。相对于大直径的毛细管,小直径毛细管曝光采集更长时间也未见辐照损伤对数据产生影响。随着总体积流量的增加,单位质量样品的受辐照剂量都有所减小,对两种毛细管中溶菌酶辐照损伤开始的时间都延长了。在相同的总体积流量下,较小直径毛细管比大直径毛细管中的单位质量样品受辐照的剂量要低。因此,辐照损伤开始的时间更晚,能获得更多未受辐照损伤影响的数据。对于给定的线性流速,不同流速下的两个毛细管的速度曲线表明,在直径0.9 mm的毛细管中,缓慢移动的样品边界层要薄得多,因此沉积蛋白质和聚集物的可能性更低,可使溶菌酶溶液曝光时间整体延长1~2个数量级。相关的SAXS研究是在EMBL P12 BioSAXS束线完成的,所用入射光子能量为10 keV(λ=0.124 nm),光斑尺寸是200 μm×350 μm(V×H)。
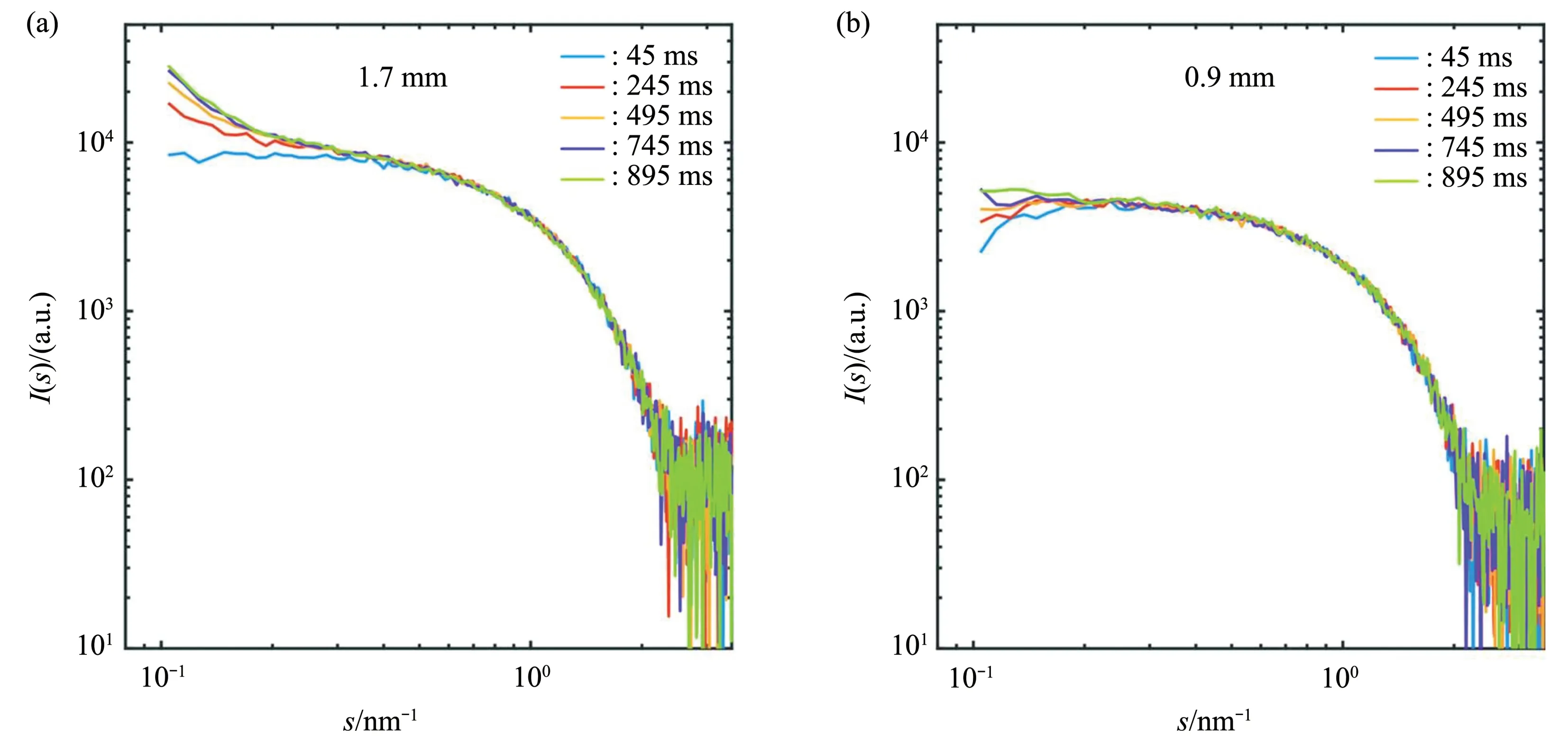
Fig.4 Effect of capillary diameter on irradiation damage of samples[74]图4 毛细管直径对样品辐照损伤的影响[74]
辐照剂量的定义是单位质量吸收的能量,因此以上3种防护方法都没有提高样品的辐照剂量阈值,只是让辐照损伤变得缓慢(衰减光强)、或分摊到更多个散射曲线中(减少曝光时间)、或分散到更大的体积(流动)中。其中流动的防护方式导致样品用量消耗很大,对于非常珍稀的样品就不合适,如一些重要的膜蛋白等。因此,对于样品量稀少的生物大分子,提高样品的辐照剂量阈值更有意义。以下介绍3种提高辐照剂量阈值的方法,即低温冷冻法、防护剂法,以及共振软X射线散射法。
4.4 低温冷冻法(cryo-SAXS技术)
在晶体衍射和电子显微镜观测中,通常将生物大分子冷冻到100 K附近的温度来缓解[75-76]辐照损伤[21]。这种冷冻方法可极大地减小生物样品的辐照损伤,降低所需样品的最小体积,拓展SAXS技术到稀有生物大分子的研究中。在100 K附近,溶剂中自由基的扩散几乎全部消除,冷冻溶剂的网络结构像脚手架一样不仅稳固了生物大分子结构,而且还可防止辐照引起的结构较大松弛。在冷冻生物大分子晶体衍射中,晶体可以承受的最大辐照剂量约是30 MGy,比常温样品的最大辐照剂量高出20~150倍[18,75-76]。这种冷冻方式对辐照损伤的防护作用与分子种类无关。成功的冷冻过程中蛋白质分子的结构保存完整,且在整个冷冻过程中没有冰核产生,同时实现溶剂快速完全的玻璃化。冷冻蛋白质样品过程中,溶剂的玻璃化可通过快速冷冻技术来实现,比如将样品放入液氮或液态丙烷中、或样品插入冷气流中、或高压下冷冻样品[21,77]。此外,加入冷冻保护剂(如甘油等)可以降低溶剂完全玻璃化对冷冻速率的要求。冷冻技术在SAXS研究中具有广泛的应用,尤其对辐照极其敏感的蛋白质溶液而言,冷冻小角散射(cryo-SAXS)技术是一种降低辐照损伤、提高样品最大承受辐照剂量的有效方法[78]。
Cryo-SAXS技术的成功应用关键在于能重复制备样品及准确收集数据。直接测量得到的溶液SAXS数据中总是包含来自溶剂的散射背底,而散射背底是需要准确扣除的。在cryo-SAXS技术中,若冷冻过程导致溶剂产生了冰晶,那么来自冰晶或者其他任何密度不均匀体的散射背底都会严重影响待测样品的散射信号准确获得,更为困难的是这些散射背底难以复制,从而导致散射背底不能准确扣除。因此,cryo-SAXS技术的关键是找到一种将溶剂均质玻璃化的可靠方法,同时还要保证溶解其中的蛋白质分子结构完整性。合适的冷冻速率、冷冻保护剂种类,以及浓度选择是获得均质玻璃化溶剂的关键。冷冻保护剂的选择将在后面4.5节详细介绍。Meisburge等[78]在SAXS束线(CHESS G1)上整合了一台畅喷氮制冷机(open-flow nitrogen cryocooler),获得了小液滴在氮气流中完全玻璃化的条件。通过选择45%质量浓度的聚乙二醇-200作为冷冻保护剂,获得GI(常被用作SAXS的测量标样)溶液在100 K温度完全玻璃态下的SAXS数据及分析结果,证实cryo-SAXS可以极大地提高GI蛋白辐照剂量阈值,同时结构保持不变。对于普通蛋白质溶液,常温下辐照耐受度为1~10 kGy,甚至更低,比如溶菌酶在常温无保护剂时剂量阈值是~400Gy,而冷冻条件下辐照剂量耐受度可以提高2~5个数量级,直到3.7 MGy对应的散射曲线也没有辐照损伤出现的痕迹[78]。此外,低温冷冻法需要的样品体积很小。光照样品体积小到15 nl还可以获得足够好的数据。而普通常温样品需要10~20 μl才可以获得足够好的数据。因此,低温冷冻法对辐照敏感、样品稀少、随时间容易降解、无法在常温下进行SAXS测试的蛋白质溶液有重要意义。以上GI的SAXS数据是在CHESS G1束线采集的。入射光能量10.5 keV,光通量为6.3×1010photons/s,光斑大小(H×V,FWHM)为119×193 μm2,或入射光能量10.0 keV,通量1.0×1011photons/s,光斑大小为220×190 μm2。
冷冻SAXS技术的样品池设计与常规SAXS技术的样品池设计不同。因为需要快速均匀玻璃化样品溶液,首先要求样品池的体积尽量小,这样液滴才易于快速完全玻璃化,其次,为便于温度的快速传递,样品池不能做成完全封闭的类型。目前文献报道过3种样品池,其中两种为无窗设计[78],因此样品池中光路路径不固定。另一种为有窗设计,因此样品在光路具有固定的路径。无窗样品池的主要缺点是无法用传统方式将背底准确扣除,需要更为复杂的扣除过程[78]。根据传统SAXS技术,准确的背底扣除首先要复制出与样品有相同厚度的玻璃化背底。这对于无窗样品池来说是不可能实现的,因此限制了无窗样品池的广泛使用。Hopkins等[61]为了便于扣除cryo-SAXS技术的散射背底,使用微加工技术制作了适用低温冷冻SAXS技术的固定路径(有窗)的硅材质样品池,此类有窗样品池能较好地解决cryo-SAXS中无窗样品池背底扣除的困难。
两种无窗样品池均来自Meisburge等对cryo-SAXS技术的研究中[78],第一种无窗样品池是圆柱状结构。溶液样品体积约1 μl,由长1.8 mm、直径860 μm、管壁25 μm厚的聚酰亚胺组成,入射光沿圆柱体中心轴通过。为了实现样品与不锈钢支架间的热分离,装载样品的圆柱管粘在直径510 μm、壁厚25 μm的一小段聚酰亚胺管材上。第二种无窗样品池是使用表面张力将样品固定在一个标准聚酰亚胺环中,样品直径约600 μm。用于cryo-SAXS实验的有窗样品池是一种微加工制作、且在光路中有固定溶液路径长度的硅材质样品池(图5)[61]。样品支架的几何形状是由蚀刻掩模和各向异性KOH蚀刻决定的[61]。此样品池顶部开放,体积小到纳米量级,形状与普通样品池类似。这类样品池为低温冷冻SAXS技术的推广应用提供了极大的便利。由于低的散射背底和低的X射线吸收,样品池只有640 nl的体积,且光照样品体积仅为2.5 nl,又具有可重复的样品冷却特性,因此这类样品池的背底扣除可用常规方式进行扣除,可研究样品量极少的蛋白质溶液体系。
Fig.5 Windowless sample cell[61]图5 无窗样品池[61]
4.5 添加防护剂法
以上降低辐照损伤的策略都是物理的方式,除冷冻技术外,样品本身的辐照耐受度并没有增加,只是将辐照剂量分散到更多的样品中或更多的SAXS图谱。增强生物大分子的辐照耐受度还可以采用化学的方式,比如添加防护剂法。蛋白质溶液在X射线的作用下产生多种自由基,自由基再引起蛋白质分子聚集等损伤行为[29]。消除自由基或者减少自由基对生物大分子的影响也是一种有效的保护措施。当健康(正常)细胞受到辐照时,它们通过释放固有的保护分子,如超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和金属硫蛋白(MT)[79-81],来抑制自由基的破坏作用,加强DNA的修复。氨磷汀、维生素E、抗坏血酸、胡萝卜素、褪黑素和硫辛酸衍生物等自由基清除剂对正常细胞和组织具有一定的保护能力[82-83]。有些纳米材料也已被证明在某些情况下具有良好的抗辐照能力[62],如碳纳米管普遍具有强化的性能和内表面,特别适合用来捕获溶液中的自由基。稀土氧化铈(CeO2)纳米颗粒也可用作自由基清除剂,用于保护正常组织免受辐照损伤[65]。这些纳米颗粒可能是一种治疗性再生纳米药物,可以清除活性氧。活性氧是辐照诱导细胞损伤的罪魁祸首,因而,此类物质可以作为保护剂候选对象[66-67]。还原剂(如乙醇、Tris、EDTA和DTT)也可作为自由基清除剂,用来消除辐照对蛋白质的损害[6]。高浓度的冷冻保护剂(如甘油、乙二醇、聚乙二醇、葡萄糖和其他糖类)已被证实可有效减少辐照对蛋白质晶体的损害[84]。然而必须注意的是,高浓度的低温凝结剂可能会对蛋白质溶液产生多种副作用,如蛋白质稳定性变差、蛋白质体积减少、溶剂黏度增加和散射对比度的减少等。
辐照损伤防护剂主要是通过调节蛋白质相互作用的冷冻保护剂,又可以分成冷冻条件下使用和常温条件下使用的冷冻保护剂。用于cryo-SAXS技术的冷冻保护剂有聚乙二醇(PEG)、乙二醇、甘油、二甲基亚砜(DMSO)等。如前所述,在cryo-SAXS技术的应用中,最大的障碍是产生多余和不可重复的冰。在冷冻蛋白质晶体学(MX)技术中,冷冻速率、冷冻剂种类、浓度的选择是均匀彻底玻璃化的最重要因素。而对于冷冻SAXS技术来说,除此限制条件外,还受限于其他条件。大部分冷冻保护剂的电子密度比水大,冷冻保护剂的加入使溶剂整体电子密度增加,导致溶液样品和溶剂背底之间的电子密度差变小,使得样品散射能力降低,最终导致散射信号的信噪比变得更差。因此,最佳选择的冷冻保护剂应在低浓度下就可起到冷冻保护作用,同时还要和水的电子密度相差不大。基于这些条件,Meisburger等[31]发现聚乙二醇PEG-200是几种小分子冷冻保护剂(包括甘油、乙二醇、DMSO)中最优的。所需PEG-200的最低浓度可以通过检验是否有冰晶的散射强度来判断,若在q≤0.02Å-1区域没有多余的散射强度产生就表示没有冰晶形成。结果表明,当PEG-200的浓度达到45%时,冰的散射信号才完全消失。使溶液完全玻璃化所需的DMSO最低浓度是45%(w/w),所需乙二醇或者甘油的最低浓度是50%(w/w)[21]。在常温下用来提高蛋白质溶液耐辐照能力的低温保护剂有甘油、乙二醇、蔗糖、海藻糖以及其他糖等。Kuwamoto等[30]研究了甘油、乙二醇、蔗糖在常温下对溶菌酶(含有四个链内二硫键)的保护作用,添加少量的冷冻保护剂,如甘油、乙二醇和蔗糖,可以有效地降低辐照损伤。甘油和乙二醇在100 mmol/L浓度范围内同样有效,蔗糖也有类似的有效浓度。Castellví等[63]将几种小分子化合物用于低分子质量、低浓度的蛋白质溶液体系中作为辐照损伤防护剂,起到很好的防护作用,同时还不会对背底散射能力产生明显影响。
低温保护剂降低辐照损伤的机理可能是:在存在少量冷冻保护剂的情况下,蛋白质与蛋白质间的相互作用发生了变化[30]。低温保护剂对缺乏二硫键的其他蛋白质的辐照损伤也有减少作用[30]。因此,乙二醇,甘油和蔗糖抑制辐照损伤的作用或许适用于更加广泛的SAXS测量。Jeffries等[27]考察了溶液添加剂对抑制辐照损伤的影响,以RNAse蛋白为例,研究无添加剂及不同添加剂情况下的临界辐照剂量值,10 g/L RNAse溶液处于静止状态,以全光通量采集的SAXS数据(7×30 ms曝光)显示30 ms曝光后便显示严重的辐照损伤,临界剂量值仅为0.32 kGy;添加1 mmol/L DTT的SAXS数据显示临界剂量增加至1.61 kGy;添加1 mmol/L抗坏血酸的SAXS数据显示临界剂量值为1.07 kGy;添加5%(v/v)甘油的SAXS数据显示临界剂量值为5.29 kGy。说明添加剂可显著降低样品的辐照损伤,特别是在添加甘油的情况下,直到暴露在全光束中300 ms后才检测到损伤[27]。在常温下使用的低温保护剂中,甘油是被使用最频繁的一种保护剂。小角散射数据库SASBDB中约一半的数据是在有防护剂的条件下获得的,而其中又有约一半的保护剂使用的是甘油[63]。甘油同时还可以消除溶剂因辐照而发生的变化[54]。
不同保护剂在不同浓度下的辐照损伤防护效果不同。Brooks等[39]定量计算了抗坏血酸、DTT、乙二醇、甘油、硝酸钠、蔗糖、四甲基哌啶氮氧化物(TEMPO)、海藻糖等8种辐照损伤保护剂针对GI防护的效果以及浓度依赖性。结果显示,几种辐照防护剂的防护效果有显著的浓度依赖性。其中,抗坏血酸、甘油和硝酸钠的防护效果均表现出强烈的浓度正依赖性;DTT则表现出相反的行为;蔗糖、TEMPO和海藻糖表现出很小的正依赖性,但即使在最高浓度(10 mmol/L)下,3种试剂的RDOT(辐照损伤开始阈值)也小于2。RDOT定义为溶液添加保护剂后与未添加保护剂时的剂量阈值之比,常用来量化辐射效果的改进。这表明这些放射性保护剂在增加样品的剂量耐受性方面不是很有效。乙二醇的RDOT随浓度从1~5 mmol/L增大而减小,但在10 mmol/L时又有较大的增大。因此,乙二醇的保护能力并不是浓度的简单单调函数。最有效的辐照损伤保护取决于样品中保护剂的浓度。低浓度(1 mmol/L和2 mmol/L)DTT是最有效的。
使用辐照损伤防护剂来减轻或者消除辐射损伤是一个简单而有效的方法,也是一个重要的研究方向,还有很多面纱等着去揭开。比如高效且低散射背底的新型防护剂类型或者防护剂组合值得进一步研究。特别是常温下能将每个蛋白质分子固定在一个笼子里面,禁止蛋白质分子与蛋白质分子相遇,像脚手架一样困住每个蛋白质分子,且不使蛋白质发生构象改变的物质,就像冷冻后的溶剂网格,值得投入大量的时间和精力来寻求。
4.6 使用共振软X射线散射(RSoXS)
常规SAXS实验的X射线能量范围通常是8~12 keV。在软X射线环境下,共振软X射线散射(RSoXS)使用的能量<2 keV,这允许探测多种元素的K或L吸收边,其中一些元素在生物系统中是普遍存在(C、N、O)或常见(如Ca)的。在元素吸收边进行X射线散射实验,由于键合方式或元素组成的不同,样品中不同部分之间的散射强度对比度可能增加多个数量级。RSoXS是一种用于聚合物薄膜探测的技术。它以约0.1 eV的能量分辨率调整X射线能量来提高散射对比度[85]。RSoXS能够区分样品中不同的化学成分,并且具有近似纳米级的空间分辨率。
Ye等[68]使用RSoXS技术对牛血清白蛋白(BSA)进行了研究,使用的样品体积比使用硬X射线测量所需样品体积小了多个量级,却仍然可得到水溶液中BSA的形状和大小。与硬X射线相比,软X射线对蛋白质分子的辐照损伤明显减弱。硬X射线会破坏所有类型的键,导致蛋白质变性,从而导致蛋白质聚集。然而,RSoXS可以选择性地损伤某些类型的化学键。当X射线能量从10 keV降到285.3 eV后,辐照损伤仅局限于特定键。因此,软X射线可减轻辐照损伤对蛋白分子结构的总体影响,辐照剂量耐受度也比硬X射线高出多个数量级。从辐照剂量公式中也可以看出,单位时间内的辐照剂量与光子能量成正比。需要注意的是,当光子能量很低时,适合的样品厚度就要很薄。比如在C元素的吸收边,用于RSoXS溶液散射的最佳厚度仅为1 μm,只是10 keV光子能量下最佳厚度的千分之一,可是两种厚度的样品分别在两种方法中得到的散射强度却大致相当。因此,RSoXS技术特别适合用量稀少的样品,但对样品池的制作精度要求会很高。
以上详细介绍了几种在蛋白质溶液散射实验中常用到的辐照损伤防护策略。在具体的实验中,往往要根据实际需求同时采用几种方式(比如缩短曝光时间、增加样品流动、和添加保护剂)来进行辐照损伤防护。缩短曝光时间、冷冻样品、和添加保护剂也可以联合用于辐照损伤防护。无论采取哪些方式,缩短单次曝光时间,累积连续采集次数都是要用到的,这是避免辐照损伤对散射数据产生影响的必要方式。
5 总结与展望
辐照损伤与样品的种类、浓度、辐照剂量、辐照剂量率、辐照损伤防护剂种类等多种因素有关。对于经验丰富的SAXS实验者和束线科学家来说,优化束线和样品条件将辐照损害降低到合理可及的程度是非常值得且有必要的。然而,由于样品的多样性,对于用户量巨大的装置来说,辐照损伤的防护措施可能是复杂多样的。在光通量极高的生物大分子SAXS实验中,为了尽可能地避免辐照给生物大分子结构带来损伤,需尽可能结合多种防护措施。对于溶液样品,从辐射损伤防护效果上来说,低温冷冻(cryo-SAXS)技术是最好的,临界剂量也可提高2~5个数量级,但实现起来比较困难,需要高度专业化的仪器设备,同时数据采集和分析都比较复杂,与实验站其他设备的组装也要提前考虑好。常温下的辐照防护措施与冷冻条件相比更加方便实现。样品流动和连续短时间采谱是必不可少的。从辐照损伤防护的角度考虑,毛细管样品的厚度也要比只考虑散射计算出来的最佳厚度适当小一些,还应当结合振动或分子排阻凝胶色谱等措施避免样品在毛细管内壁的沉淀聚集。当然,最好的样品流动方式是共流方式,比普通流动相比临界剂量至少可以提高1个数量级。同时针对不同的生物大分子,选择合适的保护剂,以及合适的保护剂浓度也是必须的。根据样品的特性及实验要求,也可考虑是否降低光通量来降低样品的辐照损伤,比如衰减光强、散聚光斑等。然而,每一种辐照损伤防护措施都有相应的代价,比如添加剂可能改变溶剂的化学性质(如DTT对二硫键的还原),造成样品可能有害的改变;降低光通量会使数据信噪比变差等。软线共振技术虽然可以显著降低蛋白质溶液的辐照损伤,但是实验条件相对苛刻,样品需要放置于高真空环境内,窗口材料也需要谨慎选择,不合适窗口材料对光强的吸收会非常强或者对信号造成干扰。另外,共振技术数据分析也相对复杂,因此该方法发展比较缓慢。
HEPS粉光小角散射束线光子通量为1015cps(12 keV时)[86],与日本Spring8的BL40XU束线具有相同数量级的光子通量。在BL40XU束线上,针对蛋白质溶液,每幅散射图曝光时间可短到6 μs。通过简单对比可知,在HEPS的粉光小角散射束线上进行微秒时间的数据采集应该是充分且恰当的。有文献报道了DESY PETRA III的P12束线在10 keV入射光,500 μm×250 μm光斑尺寸,5×1012cps光子通量下,浓度为10 g/L的RNAse蛋白质在5%体积分数的甘油存在的静止状态下,可以测量到300 ms而不出现辐照损伤[27]。HEPS粉光小角散射站的光通量是P12束线的200倍,面积是其两倍(参考光斑尺寸500 μm×500 μm),不考虑能量的差异,达到相同的阈值剂量,HEPS粉光小角散射可以连续测量3 ms而不出现辐照损伤。对于辐照损伤不是很明显的普通蛋白质或者蛋白质复合物,在P2束线曝光1 s均没有辐照损伤产生[2,46-49,52,70],对 应 在HEPS上 最 少 可 以 曝 光10 ms。CHESS G1束线对GI在光斑尺寸119 µm×193µm,光子通量6.3×1010cps,光子能量10.5 keV的冷冻SAXS条件下,总曝光时间可达2 460 s,类比在HEPS粉光小角散射站可曝光1.5 s。
一般情况下,超快或瞬态时间分辨的生物大分子SAXS研究需要在高通量的粉光小角散射束线上进行。若样品对辐照损伤极为敏感,进行辐照损伤的防护是必须的。缩短常温下曝光时间、增加样品流动/振动/共流、减少毛细管直径、添加合适的辐照防护剂、低温保护等,都是抑制辐照损伤的途径。如果样品不需要时间分辨,但对辐照损伤又极其敏感,那么衰减光强也是一个解决辐照损伤的很好途径。总之,辐照损伤防护需要针对具体样品,权衡利弊,采用最佳的措施。
对于普通蛋白质溶液的SAXS实验来说,找到一种低散射背底、强吸收自由基的物质,与甘油等冷冻保护剂联合起来使用,或许可以达到更佳的效果。甘油可调节蛋白质之间的相互作用,在蛋白质分子表面形成一层厚厚的水化层,在这种情况下,所产生的自由基可被自由基清除剂清除掉,避免其进一步对蛋白质分子的破坏作用。有关蛋白质等生物大分子溶液的辐照损伤机理,以及各类自由基清除剂的作用机制仍值得广泛深入细致的研究。
