可减弱豆腥味酵母菌的筛选及其在豆渣饮料中的应用
2022-09-21陈臣田同辉刘政李立何晓葳于海燕马新新田怀香
陈臣,田同辉,刘政,李立,何晓葳,于海燕,马新新,田怀香*
(1.上海应用技术大学香料香精化妆品学部,上海 201418;2.上海清美绿色食品(集团)有限公司,上海 201314)
豆渣是豆浆或豆腐生产过程中产生的不溶性残渣,是豆制品加工过程中常见的一种副产物。我国是世界上豆渣生产量最大的国家之一,每年豆制品加工企业(不包括榨油)能产生约2 000万吨湿豆渣[1-2]。研究表明,豆渣中含有丰富的膳食纤维、蛋白质等营养物质,具有良好的保健功能[3]。然而,目前多数企业对豆渣的利用率极低,企业对豆渣的处理方式大多是以低价售卖给养殖户作为饲料,或直接当作废弃物处理[4]。造成这种现象的主要原因之一是豆渣的豆腥味严重,以其为原料制作的相关产品在风味方面难以被消费者接受[5],因此,改善豆渣风味,尤其是减弱其豆腥味对其利用率的提高具有重要意义。
目前用于减弱豆渣豆腥味的方法主要有物理法、化学法、酶法和发酵法,前3种方法因存在能耗大、副反应多、试剂污染严重、需严格控制反应条件等不足而未得到广泛应用[6-7]。发酵法主要是依靠特定微生物的产香和酶解能力产生风味良好的代谢产物来掩盖豆腥味,或将豆腥味物质进一步分解成为其他风味组分,从而达到减弱豆腥味的效果[8]。发酵法在减弱豆渣豆腥味方面具有非常好的潜力,其效果的关键取决于如何针对产生豆腥味的关键化合物进行筛选从而获得可降低豆腥味的微生物[9-10]。
基于此,本研究首先利用顶空固相微萃取与气相色谱-质谱联用技术(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPMEGC-MS)分析未发酵豆渣中的风味物质,通过气相色谱-嗅闻技术(gas chromatography-olfactometry,GC-O)结合香气活力值(odor activity value,OAV)确定主要豆腥味风味化合物;在此基础上,通过对不同酵母菌发酵所得的豆渣样品进行感官评价及豆腥味风味组分分析,筛选出能利用豆渣发酵产香且可减弱豆渣豆腥味的优质菌株,并将其应用于豆渣饮料中。本试验可为豆渣的综合利用以及附加产品的开发提供一定的理论依据,对豆渣的综合利用具有重要意义。
1 材料与方法
1.1 材料与试剂
新鲜豆渣样品:上海市清美绿色食品(集团)有限公司;发酵乳制品(乳扇、乳饼):采样于云南大理地区,于4℃低温采样箱保存后运输至上海应用技术大学样品处理实验室;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)、麦芽浸粉肉汤(malt extract broth,MEB):北京陆桥技术有限责任公司;通用引物NL1和NL4、琼脂糖凝胶:北京康为世纪生物科技有限公司;2-辛醇(分析纯)、正构烷烃 C6~C30(色谱纯):美国 Sigma-Aldrich Chemical公司;黄原胶、高酰基结冷胶(均为食品级):美国Kelco公司;食用白砂糖、柠檬酸(均为食品级):浙江一诺生物科技有限公司。
1.2 仪器与设备
LDZX-50KBS灭菌锅:上海申安医疗器械厂;XSPBM-2CE生物显微镜:上海彼爱姆光学仪器制造有限公司;ProFlexPCR 仪:美国Applied Biosystems公司;DYCP-32A电泳仪:北京六一生物技术有限公司;THZ-98A超净工作台、GHP-9050隔水式电热恒温培养箱:上海一恒科学仪器有限公司;Agilent 7890B-5977B气相色谱质谱联用仪:美国安捷伦科技有限公司;ODP-3嗅闻仪:德国Gerstel科技有限公司;75 μm CAR/PDMS萃取头:美国Supelco公司。
1.3 方法
1.3.1 豆渣中主要豆腥味化合物的确定
1.3.1.1 HS-SPME-GC-MS分析条件
采用顶空固相微萃取-气质联用法分析豆渣样品中的香气成分,分析条件参照Tian等[11]的方法并稍作修改,每个样品均平行测定3次。
顶空固相微萃取(headspace-solid phase microextraction,HS-SPME)条件:称取2 g新鲜豆渣样品置于20 mL 顶空瓶中,加入 2 mL NaCl溶液(30 g/L)和 20 μL内标物2-辛醇(40 mg/L)。顶空瓶用聚四氟乙烯硅胶垫密封后置于250 r/min、60℃水浴中平衡10 min后,将提前老化好的萃取头插入顶空瓶中萃取40 min。萃取完成后将萃取头置于GC进样口250℃解吸5 min,进行气相色谱-质谱分析。萃取头第一次老化时间为30 min,之后每次使用后老化15 min。
气相(gas chromatography,GC)条件:HP-Innowax色谱柱(60 m×0.25 mm×0.25 μm);载气为氦气,流量1 mL/min;升温程序:初始温度40℃保持3 min,以5℃/min速率升至120℃,保持4 min,以8℃/min速率升至200℃,保持8 min,最后以10℃/min升至230℃,保持10 min;进样方式为不分流进样,进样口温度为250℃。
质谱(mass spectrometry,MS)条件:电子轰击离子源(electron-impact ionization,EI),电离能量为 70eV;离子源温度230℃,接口温度250℃,四极杆温度150℃;扫描模式为全扫描,质量扫描范围m/z 30~450。
定性分析:挥发性化合物的定性通过与NIST 17谱库进行比较,保留匹配度大于80的结果。同时根据相同色谱条件下C6~C30正构烷烃的保留时间计算检测物质的保留指数(retention index,RI),并与文献报道的RI值进行比对。
定量分析:挥发性风味物质含量的测定采用内标法,根据化合物与内标物峰面积的比值进行计算。所用内标物为20 μL 2-辛醇(浓度为40 mg/L),根据于海燕等[12]的方法计算待测物质的浓度。
1.3.1.2 GC-O分析及OAV值测定
采用Agilent7890B气相色谱仪,配ODP-3嗅觉检测器端口进行嗅闻分析,色谱条件和升温程序与1.3.1.1中GC条件一致。采用时间强度法(odor specific mag nitude estimation,OSME)进行GC-O分析。选取5名嗅觉灵敏、已受过气味识别培训的感官评价人员,在试验过程中描述并记录各气味活性化合物的出峰时间以及香气描述,并使用0~5的5点强度级别评估香气强度(aroma intensity,AI)。0表示未检测到,3表示强度中等,5表示非常强烈。对同一样品平行测定3次,统计同一出峰位置有2次以上相似的气味描述及其香气强度值,最终香气强度值为5名评价人员嗅闻记录的香气强度平均值[13]。
OAV值:风味物质的平均浓度与阈值之比。暂不考虑风味物质的相互影响,OAV<1时,该物质对样品总体气味贡献不明显,反之,则此风味物质对整体风味贡献较大,且OAV值与贡献风味比重呈正比。通常认为OAV≥1的物质为风味活性物质[14]。
1.3.2 具有豆腥味减弱能力酵母菌的筛选
1.3.2.1 酵母菌的分离纯化
将采集的发酵食品样品在研钵中捣碎,称取1 g研磨后的样品加入含有9 mL无菌水的试管中,充分振荡混匀得10倍稀释样液。无菌吸取1 mL10倍稀释样液加入含有9 mL无菌水的试管中,充分振荡混匀得102倍稀释样液,照此方法依次制备103倍~106倍稀释样液。吸取0.1 mL 103倍~106倍4个梯度的稀释样液涂布于PDA培养基中,每个稀释度设3个重复。平板于30℃恒温倒置培养48 h后,用无菌牙签挑选不同大小、颜色、形态的菌落在PDA培养基上反复划线至分离得到酵母单菌落[15]。
1.3.2.2 发酵豆渣的制备
分离纯化后的酵母菌用MEB培养基调整浓度至107CFU/mL~108CFU/mL后,在 10 000 r/min、4℃条件下离心10 min,弃上清液,加入无菌水振荡混匀后在相同条件下离心弃上清液,如此重复操作2次~3次以完全洗去菌液中的培养液。在无培养液的菌体中加入等体积无菌水并混匀作为接种液。按照6%接种量接入装有10g灭菌豆渣的150mL广口锥形瓶中,加入30mL无菌水搅拌均匀后置于恒温恒湿培养箱中于30℃固态发酵5 d,发酵后的样品以RS-1~RS-20命名。空白对照组除不接种酵母菌外其余条件均和试验组一致。
1.3.2.3 感官评价初筛具有豆腥味减弱能力的酵母菌
感官评价在标准感官实验室进行,依据GB/T 16291.1—2012《感官分析选拔、培训与管理评价员一般导则第一部分:优选评价员》对评价成员进行筛选和培训,通过考察感官识别及表达能力,选择感觉灵敏度高,表达能力强的感官评价人员16名,建立感官评价小组,其中男、女性各8名,年龄范围在20周岁~30周岁。评价过程:称取各酵母菌发酵后的豆渣样品5 g于棕色不透明的带盖盒子中,使用随机3位数字组合编号后呈递给感官评价人员进行感官嗅闻。结合先前的研究基础[16]以及感官分析参考[17],评价人员分别对豆腥味、青草味、酸味、氧化味、氨味、豆香味、椰香、甜香、酯香、曲香共10种感官属性进行评价。评价结果采用9分制打分(0分表示未嗅闻到,9分表示气味极强),每个样品重复评价3次,记录各评价人员的评分结果,最后取平均值即为香气强度值。
1.3.2.4 GC-MS复筛目的菌株
对于感官评价初步筛选出的发酵后豆腥味强度较低的豆渣样品,通过GC-MS检测进行复筛,验证并分析各菌株豆腥味减弱效果。GC-MS分析方法及条件同1.3.1.1节。
1.3.2.5 目的菌株形态学和26S rDNA鉴定
形态学鉴定:将分离纯化得到的目的菌株接种在PDA培养基上,于30℃下培养48 h,观察并记录菌落形态;挑选典型菌落制成水浸片,在光学显微镜下观察细胞形状[18]。
分子鉴定[6]:以目的菌株菌液为模板,采用通用引物 NL1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和 NL4(5’-GGTCCGTGTTTCAAGACGG-3’)进行 26S rDNA的聚合酶链式反应(polymerase chain reaction,PCR)扩增。扩增体系为 50 μL(NL1 和 NL4 各 2 μL,ddH2O19 μL,菌液 2 μL,2×GoodStar Best Master Mix 25 μL)。PCR扩增条件:95℃预变性10 min,95℃变性30 s,55℃退火 30 s,72℃延伸 20 s,共 30个循环,最终72℃延伸5 min,4℃保温。得到的PCR产物用1%的琼脂糖凝胶电泳进行检测后送至上海生工生物工程有限公司完成测序,将测得的序列在NCBI中进行生物大分子序列比对(basic local alignment search tool,BLAST)比对。利用MEGA6.0对所测菌株与该菌属内其他菌株序列进行系统发生树的构建。
1.3.3 目的菌株在豆渣饮料中的应用
1.3.3.1 豆渣饮料的制备
豆渣饮料制作工艺见图1。
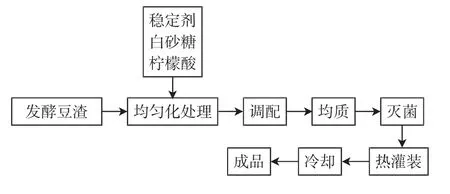
图1 豆渣饮料制作工艺流程Fig.1 Process flow chart of making bean dregs beverage
1.3.3.2 豆渣饮料的感官评价与豆腥味化合物分析
采用未发酵、初筛所得菌株和目的菌株发酵后的豆渣为主要原料分别制备饮料样品,对各组饮料样品分别进行豆腥味感官评价以及豆腥味化合物GC-MS检测分析并进行比较。GC-MS分析方法及条件同
1.3.1.1,感官评价方法同1.3.2.3。
1.3.4 数据处理
数据采用SPSS 21进行单因素方差分析,利用邓肯多重检验评定样品间差异性,当p<0.05时有显著性差异;利用独立样本t检验对豆腥味化合物含量间的差异性进行分析。采用Origin Pro 9.0对感官评价结果作图。
2 结果与分析
2.1 豆渣中主要豆腥味化合物的确定
新鲜豆渣中鉴定出的主要豆腥味化合物见表1。
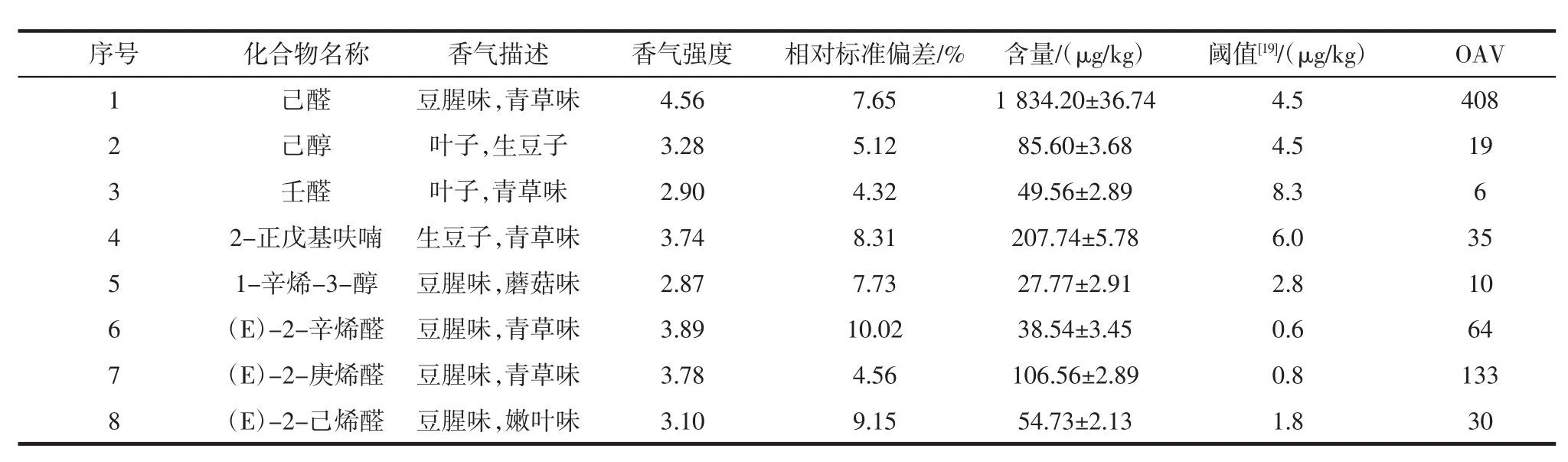
表1 豆渣中鉴定出的主要豆腥味化合物Table 1 The main beany odor compounds identified in okara
由表1可知,新鲜豆渣(未发酵)中己醛、己醇、壬醛、2-正戊基呋喃、1-辛烯-3-醇、(E)-2-辛烯醛、(E)-2-庚烯醛、(E)-2-己烯醛8种物质对豆渣豆腥味贡献最大。其中,醛类物质在检出种类及含量上均占较高比例,己醛在所有挥发性组分中含量最高,为1 834.2 μg/kg,是造成豆渣豆腥味严重的主要风味物质之一[20]。研究表明,豆渣不良风味如豆腥味和苦涩味的形成主要与大豆在研磨过程中发生的酶促反应相关[21]。当大豆在25℃左右浸泡和研磨时,大豆细胞破裂使得脂肪氧合酶与处于隔离状态的脂质及其它生物活性物质发生接触,并利用空气中的分子氧、温度等因素迅速发生氧化反应,从而产生大量挥发性风味物质如醛类、酮类、醇类等,这些物质只要微量存在,就会产生令人不愉快的气味[22]。
本试验结果与李慧勤等[23]的研究结果一致。此外,本试验还确定了己醇、(E)-2-辛烯醛、(E)-2-己烯醛3种豆腥味香气活性化合物,它们同样对豆渣豆腥味的形成产生重要影响。尽管这些物质在单独存在时会表现出生豆味、青草味、嫩叶味等,但它们在豆渣体系中混合以后产生的嗅觉综合效应则会变为明显的豆腥味[24]。
2.2 感官评价初筛结果
各菌株发酵样品的定量描述感官评价结果见图2。
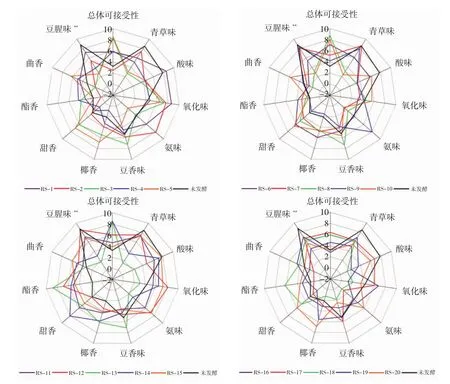
图2 未发酵与20个发酵豆渣样品感官评价雷达图Fig.2 Sensory evaluation radar chart of unfermented and 20 fermented okara samples
由图2可知,其中有20个发酵样品的豆腥味评分低于未发酵豆渣,表明对应的20株酵母菌可能有改善豆渣豆腥味的作用。这20个发酵豆渣样品呈现不同的香气轮廓特征,可能的原因是酵母菌生理生化能力如产酸、产酯、耐盐等的不同[25-26]。因此,它们以豆渣为底物发酵所产生的代谢产物在种类和含量上也存在一定的差异,进而影响发酵豆渣风味。其中,RS-3、RS-5、RS-8、RS-10、RS-13、RS-14,6 个发酵样品的豆腥味评分与未发酵样品相比显著降低(p<0.01),总体接受度评分明显提高,因此选择这6个发酵豆渣样品进行下一步的GC-MS复筛分析。
2.3 GC-MS复筛结果
通过GC-MS对1个未发酵样品及初筛得到的6个发酵豆渣样品进行分析,鉴定出的挥发性化合物种类及含量见表2。
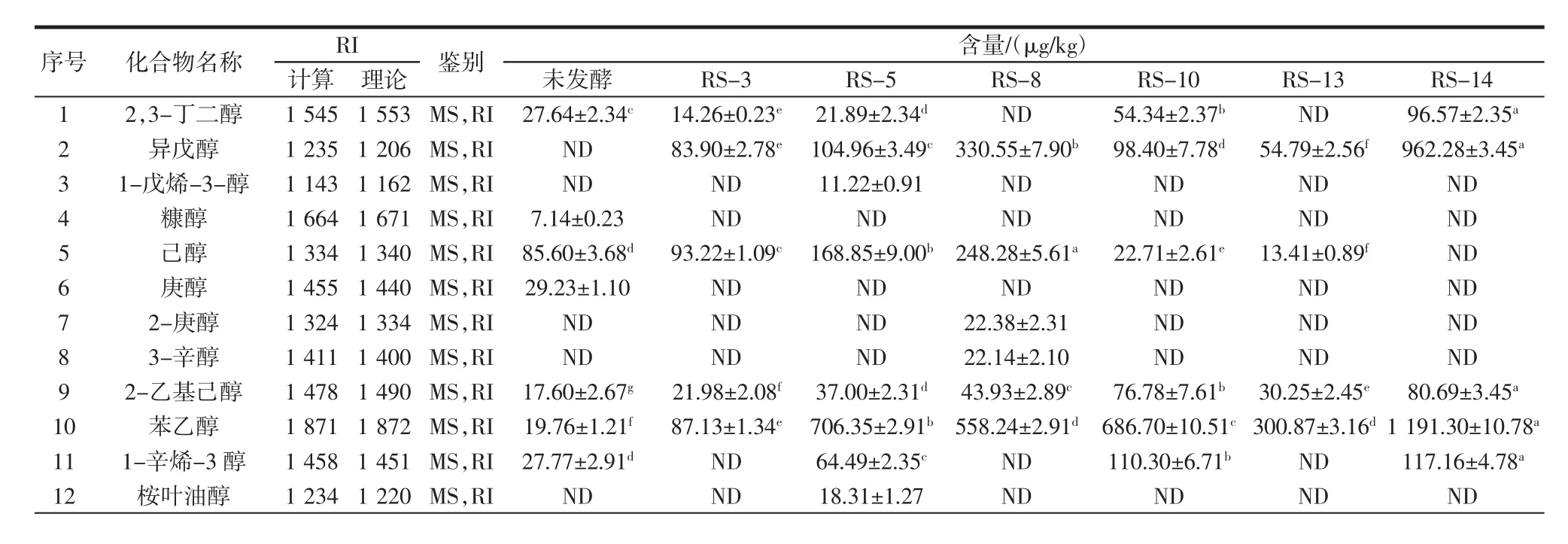
表2 豆渣样品中挥发性化合物种类及含量Table 2 Types and contents of volatile compounds in okara samples
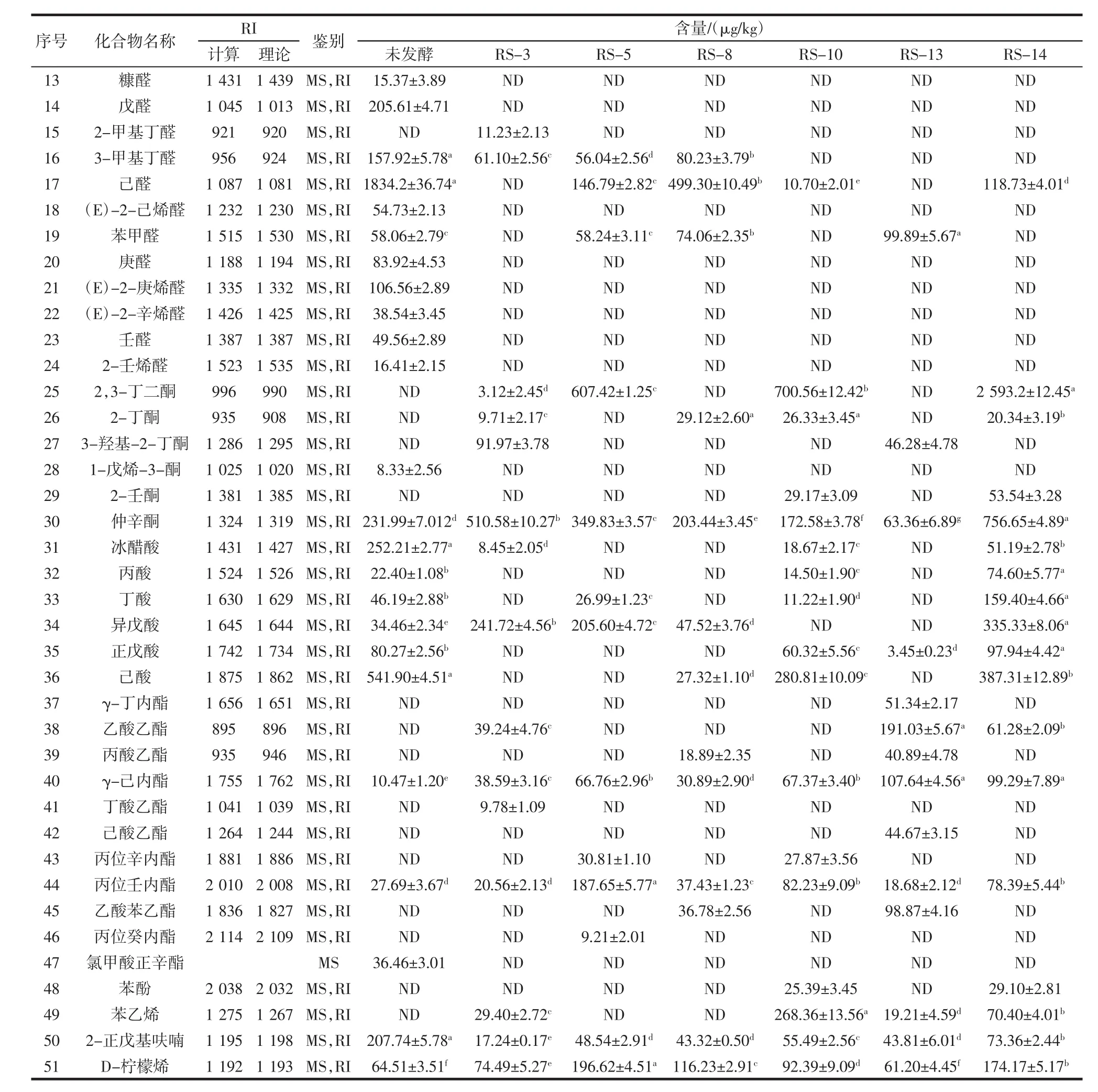
续表2 豆渣样品中挥发性化合物种类及含量Continue table 2 Types and contents of volatile compounds in okara samples
由表2可知,在7个豆渣样品中共鉴定出51种香气成分,主要包括醇类、醛类、酯类、酮类、酸类等。其中,醇类物质在未发酵豆渣样品中含量较低,但在经酵母菌发酵后的多数样品中苯乙醇、2-乙基己醇和异戊醇的含量有所增加。它们由酵母菌分解脂肪酸产生[27],阈值较低,具有甜香及花香,对豆腥味起一定的掩盖作用[28]。醛类化合物的阈值通常较低,也是豆渣豆腥味的主要来源[29]。庚醛、(E)-2-辛烯醛、(E)-2-庚烯醛、壬醛已被证实是许多豆类制品中的典型豆腥味物质[30-32],这些物质均未在发酵后的样品中检出。在6个发酵豆渣样品中检出的醛类物质包括己醛、3-甲基丁醛和苯甲醛,它们是由酵母菌在发酵过程中分解不饱和脂肪酸形成的过氧化物裂解产物[33]。其中己醛是对豆渣豆腥味贡献最大的关键化合物,其含量可作为衡量豆腥味的指标,与未发酵样品相比,发酵后的样品中该物质的含量显著降低(p<0.05)[34-36]。RS-3和 RS-13菌株发酵后的豆渣中未检出己醛,表明这两株酵母菌的豆腥味减弱能力较其它4株更佳。经6株酵母菌发酵后,豆渣中酯类物质含量有所增加。其中RS-13发酵样品中酯类物质的种类及含量增加最为明显,发酵过程新生成γ-己内酯、乙酸乙酯、乙酸苯乙酯等,相对含量提高约40%。酯类物质绝大部分都带有浓郁的果香、奶香及花香等,可有效掩盖豆腥味,提高样品的整体可接受度[37-38]。酮类物质对豆渣气味的贡献相对较小[39]。对于酸类,6个发酵样品中己酸、戊酸及冰醋酸的含量较多,这些酸通常具有酸臭味,会影响豆渣样品的整体接受度。RS-13发酵样品中酮类和酸类物质含量均较低,因此带来的不良风味弱,相较于其它发酵豆渣样品整体风味更佳。
未发酵及6株酵母菌发酵后的豆渣样品中主要豆腥味化合物含量如图3所示。
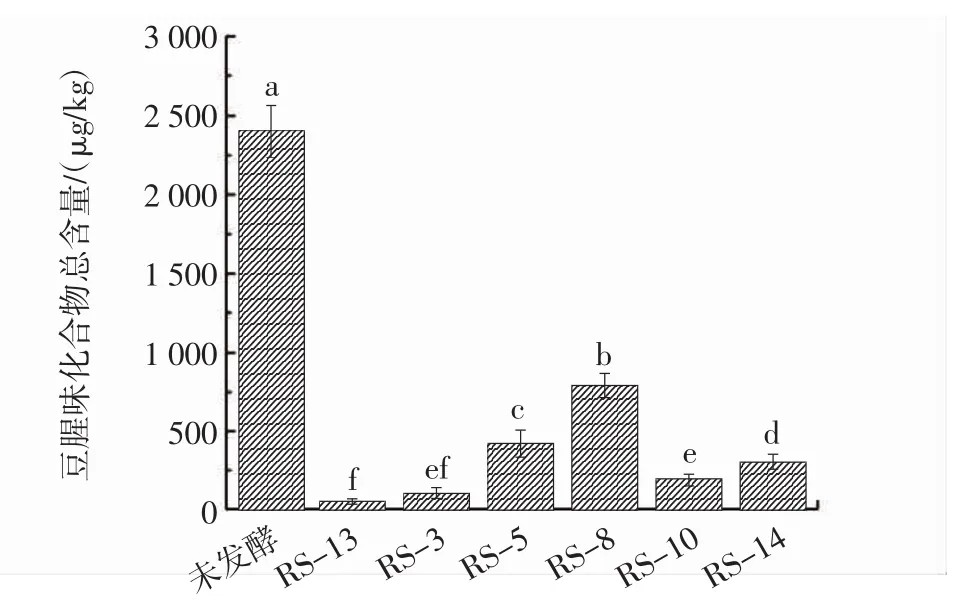
图3 未发酵及发酵豆渣样品中豆腥味化合物总含量Fig.3 Content of beany flavor compounds in unfermented and fermented okara samples
由图3可知,经酵母菌发酵后的豆渣样品中主要豆腥味化合物含量均下降明显,与未发酵豆渣相比具有显著性差异(p<0.05)。其中RS-13发酵后的豆渣样品中8种主要豆腥味成分总含量降至57.22 μg/kg,仅为未发酵豆渣的1/40,在所选菌株中豆腥味减弱效果最佳。基于以上分析,确定RS-13为目的菌株,进行下一步的形态学及基因序列测定分析。
2.4 目的菌株RS-13形态学及26S rDNA鉴定结果
RS-13的形态学特征见图4。
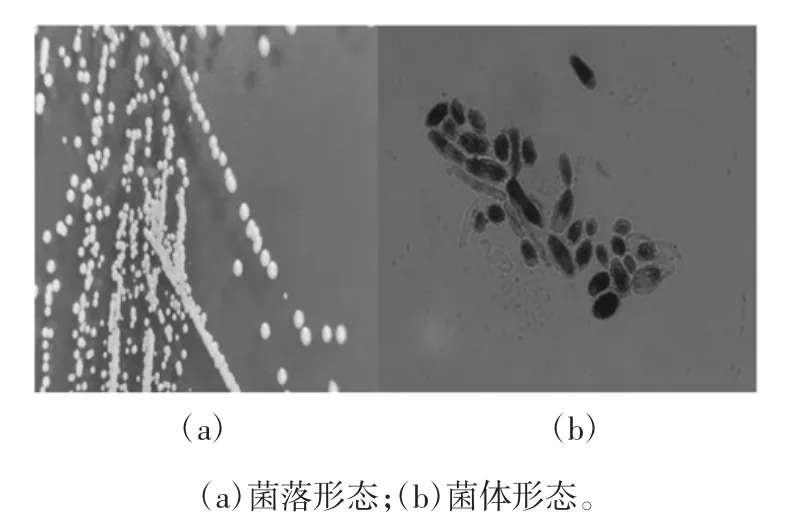
图4 RS-13的形态学特征(1 000×)Fig.4 Morphological character of RS-13(1 000×)
对RS-13的基因序列进行测定,26S rDNA结果显示RS-13与菌株Pichia fermentans GQ(Sequence ID:GQ458040)的同源性最高,高达99%,相似度>95%,因此判断该菌种为发酵毕赤酵母,利用MEGA 6.0软件构建的系统发生树见图5。
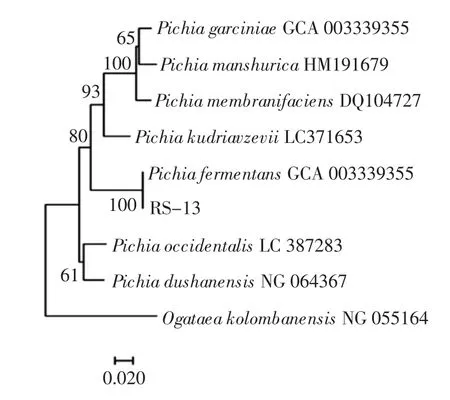
图5 RS-13基于26S rDNA基因的系统发生树Fig.5 RS-13 phylogenetic tree based on 26S rDNA gene
2.5 目的菌株RS-13在豆渣饮料中的应用
为验证目的菌株RS-13对豆渣制品豆腥味改良效果,分别采用未发酵豆渣、初筛所得菌株RS-3(初筛结果中该菌株豆腥味减弱效果同样较佳,故选其作为对比)和目的菌株RS-13发酵后的豆渣作为原料制备豆渣饮料,并对饮料成品进行主要豆腥味化合物含量测定及豆腥味定量描述感官评价,分析结果见表3。
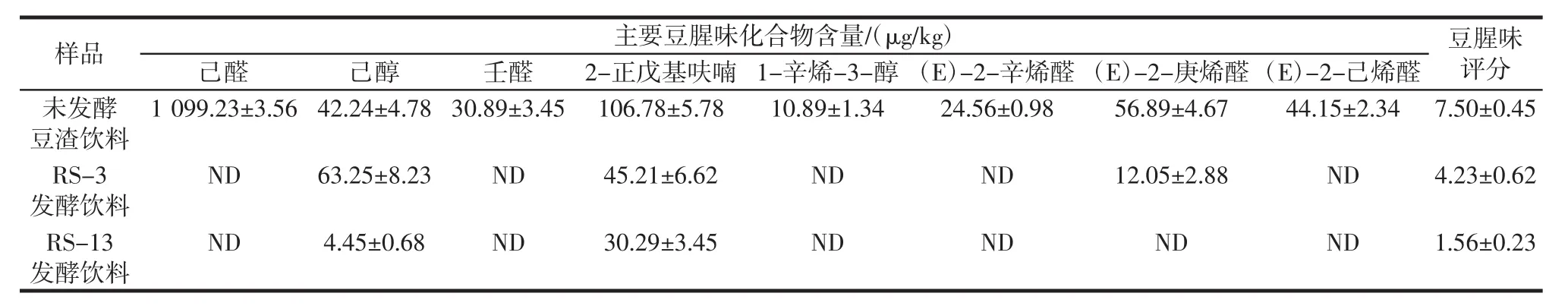
表3 未发酵豆渣饮料与发酵豆渣饮料中主要豆腥味化合物含量及豆腥味感官评分比较Table 3 Comparison of the beany flavor compounds content and sensory scores of unfermented and fermented okara beverages
由表3可知,与未发酵豆渣饮料及其它菌株发酵豆渣饮料相比,采用RS-13发酵豆渣制备而成的豆渣饮料中主要豆腥味化合物含量及豆腥味评分最低。表明RS-13菌株对于发酵豆渣饮料同样具有明显的豆腥味减弱效果,可将其应用于豆渣制品中进行豆腥味的改善。
3 结论
以豆渣为研究对象,通过HS-SPME-GC-MS、GCO测定以及OAV分析,确定新鲜豆渣中8种主要豆腥味化合物为己醛、己醇、壬醛、(E)-2-己烯醛、2-正戊基呋喃、1-辛烯-3-醇、(E)-2-辛烯醛、(E)-2-庚烯醛。分析不同酵母菌发酵对豆渣挥发性成分以及感官属性尤其是豆腥味的影响,发现RS-13菌株发酵样品的主要豆腥味化合物总量最低,只有未发酵样品的1/40;此外,使用该菌株发酵后的豆渣样品中还生成多种醇类、酯类物质,对于整体的风味特征有明显改善及促进作用。经形态学和26S rDNA鉴定,该菌株为发酵毕赤酵母(Pichia fermentans)。将该菌株应用于豆渣饮料的制备,可以有效减弱饮料成品的豆腥味,提高整体可接受度。本研究为豆渣豆腥味的去除提供参考,也为提高豆渣综合利用率及其产业化发展提供了一定的理论依据。
