烟草花蕾酶解基底高效制备美拉德反应中间体研究
2022-09-21孙振春林叶春张长云苏贤坤
孙振春,杨 慧,瞿 方,林叶春,张长云,龙 勇,苏贤坤*
烟草花蕾酶解基底高效制备美拉德反应中间体研究
孙振春1,杨 慧1,瞿 方2,林叶春1,张长云1,龙 勇3,苏贤坤1*
(1.贵州省烟草科学研究院,贵阳 550081;2.贵州黄果树金叶科技有限公司,贵州 安顺 561000;3.贵州铜仁烟草分公司,贵州 铜仁 554300)
美拉德反应中间体Amadori重排产物(ARP)作为烟草重要潜香物,具有常温下化学性质稳定,加热后可快速形成新鲜风味的特性,是性能优异的潜在烟用香料。为了获得产率高、能明显改善烟香品质的ARP产品,本研究以烟草花蕾为原料制备烟草花蕾酶解液,以此为溶剂,在控温真空条件下补充脯氨酸和葡萄糖以促进脯氨酸-葡萄糖ARP的合成。结果表明,烟草花蕾酶解物作为反应溶剂在90 ℃,25 mbar条件下反应120 min获得的ARP产率较水溶液反应体系由39.91%提高至92.20%,实现了烟草花蕾脯氨酸-葡萄糖ARP的高效制备;化学反应动力学分析表明,烟草花蕾酶解液体系制备ARP反应活化能为14.64 kJ/mol,低于水溶液制备体系(25.68 kJ/mol),合成更易进行。卷烟加香感官评吸结果表明,烟草花蕾基ARP能有效改善烟气品质,提高香吃味。
Amadori重排产物;烟草花蕾;美拉德反应;化学反应动力学
美拉德反应中间体Amadori重排产物(ARP)作为重要的呈香前体物在烟草调制、复烤、醇化等阶段对烟草本香的形成有显著贡献[1]。美拉德中间体是在美拉德反应初期,由氨基酸与还原糖羰氨缩合后,经脱水、重排形成。其理化性质稳定,本身不具备完整风味属性,但在后续热加工中可迅速形成理想风味[1-2]。因此,ARP作为香基模块可用以实现风味的受控形成,在传统及新型烟草制品中应用潜力较大。
ARP制备方法可分为有机法和水相法。有机法由于生产成本高、反应步骤多、制备过程不安全而难以进行规模化生产[3]。邓仕彬[1]、DELGADO等[4]、黄梅桂等[5]通过特定示踪剂与美拉德反应产生的中间体结合,抑制终产物的褐变程度,由此指示ARP大量生成的时间,进而实现常压水相法制备ARP。在此基础上,通过控温真空脱水反应,ARP产率可达40%,而添加竞争性捕获剂如半胱氨酸、谷胱甘肽、表没食子儿茶素没食子酸酯(EGCG),可使特定体系ARP产率显著提升至90%以上[6-7]。但是,上述捕获剂的使用会造成烟本香协调感减弱、成本提升。因而,选取一种新型天然添加物以实现ARP产率提升,同时增进烟气香韵协调性和丰富性,具有重要意义。
烟草花是重要的烟田资源,以其为原料制备的烟用香料富含40余种醇、醛、酸、酯、酮、呋喃和吡啶,可以增进烟气细腻柔和度,降低杂气和刺激性[8-9]。因此,烟草花蕾常被用于制备美拉德完全反应混合物香料(MRP),而用于制备美拉德反应单体物的研究较少[10]。由于烟草花蕾本身富含有机酸、多酚类、萜类等功能组分,特别是其中的苹果酸、绿原酸、琥珀酸、草酸等多羟基不饱和酸类具有较强的抗氧化性,与之前报道的EGCG、谷胱甘肽、半胱氨酸在功能或结构上存在一定相似性,因而具有提高ARP水相合成产率的潜力[11-12]。但利用烟草花蕾作为反应底物用以制备ARP的相关研究尚属空白。
本研究基于水相控温脱水制备ARP的方法,以烟草花蕾酶解物为反应基底,研究其对ARP产率的影响,分析其ARP反应动力学,进行了卷烟加香感官评价,旨在进一步丰富ARP制备方法,并为烟草花蕾资源精细开发提供理论支持。
1 材料与方法
1.1 试验材料与试剂
1.1.1 烟草材料 烟草花蕾取自云烟87品种,种植于贵州省安顺市平坝区实验基地,于2021年6月将花枝取样,去除花托,花瓣避光自然风干,0~4 ℃冰箱保存备用。
1.1.2 试剂 L-脯氨酸、葡萄糖:食品级,上海源叶生物科技有限公司;氢氧化钠、盐酸、甲醇、乙醇、氯化钠、无水硫酸钠、1,2-二氯苯、乙酸苯乙酯:分析纯,国药集团化学试剂有限公司;甲酸、乙腈、二氯甲烷:色谱纯,国药集团化学试剂有限公司;N-1-脱氧-1-L-脯氨酸-D-果糖:95%纯度,实验室制备。漆酶:食品级,济南东轩生物工程有限公司;果胶酶:30000 U/g;纤维素酶:10000 U/g;碱性蛋白酶:200 U/mg,均购自阿拉丁试剂有限公司。
1.1.3 主要仪器与设备 悬臂式搅拌器(MYP2011-50,上海梅颖谱仪器仪表制造有限公司);旋转蒸发仪(KV600,德国艾卡公司);集热式恒温搅拌器(DF-101S,上海秋佐科学仪器有限公司);高温烘箱(FED 240,德国宾德公司);超高效液相色谱仪(ACQUITY UPLC,美国沃特世公司);蒸发光检测器(ACQUITY ELSD,美国沃特世公司);全数字化核磁共振波谱仪(Aduance Ⅲ 400 MHz,德国布鲁克AXS公司);超高效液相色谱-质谱联用仪(SYNAPT Q-TOF-MS,美国沃特世公司)。
1.2 试验设计
1.2.1 降解酶筛选 分别采用果胶酶、漆酶、碱性蛋白酶、纤维素酶对烟草花蕾(以下简称烟花)进行酶解,计算提取率,并将酶解液喷洒于烟丝混合均匀后进行感官评价,确定适宜的酶制剂。
1.2.2 花蕾酶解液制备ARP效果研究 根据筛选结果,选择果胶酶作为降解酶。分别对比烟花酶解液、超纯水、烟花水提液作为反应基底加入葡萄糖及脯氨酸制备ARP的产率,并利用质谱仪及核磁共振仪对ARP提纯物进行定性和定量鉴定。
1.2.3 酶解液提高ARP产率的动力学分析对比分析以水溶液、烟花酶解液为反应基底,与脯氨酸、葡萄糖在不同反应温度梯度与时间条件下形成ARP的产率变化,计算反应活化能。
1.3 试验方法
1.3.1 酶解 将风干后的烟花在45 ℃条件下干燥24 h,而后超微粉碎过200目筛,按质量比7∶93加水溶解,分别加入一定量的酶于50 ℃下反应3 h,(果胶酶、漆酶、碱性蛋白酶、纤维素酶分别按照0.2%、0.1%、0.4%、0.4%进行添加[13]),而后95 ℃高温灭酶5 min,酶解液经双层400目纱布过滤后获得反应底液。同等条件下不添加酶提取3 h,过滤得到烟花水提液。

1.3.2 不同溶剂反应体系ARP制备效果比较 在水、烟花水提液、酶解反应液中加入0.2 mol/L葡萄糖及脯氨酸,调节初始反应pH至7.4,根据预试验结果,于负压25 mbar,90 ℃条件下控温脱水反应120 min,冰浴冷却,获得不同产率的美拉德反应氨基糖类化合物粗品。
1.3.3 ARP纯化 将美拉德反应粗品用去离子水复溶,而后使用H+型Dowex50WX8离子交换树脂柱(26 mm × 300 mm)对中间体粗品溶液进行分离纯化。使用去离子水对样品中的葡萄糖进行洗脱,并通过2,3,5-三苯基四唑氯化物(TTC)对葡萄糖进行检测,至洗脱液不含还原糖后使用0.1 mol/L氨水对样液中的脯氨酸及ARP进行洗脱。通过高效液相色谱-蒸发光检测器(HPLC-ELSD)对洗脱液进行检测,并收集仅含有ARP的样品。将该样品真空浓缩、冷冻干燥,并使用甲醇和冷丙酮对样品反复纯化洗脱至99%纯度,脱水后干燥保藏待用。
1.3.4 ARP定性表征 质谱分析表征:将获得的纯品通过超高效液相色谱-质谱联用仪(UPLC-MS-MS)进行定性分析。通过BEH C18色谱柱(2.1 mm× 100 mm × 1.7 μm)进行分离。色谱条件为:柱温45 ℃;流动相0.1%甲酸乙腈;线性梯度2%~100%;流速0.3 mL/min;检测波长200~600 nm;进样量 1 μL。质谱条件:电喷雾离子源(ESI),正离子模式;毛细管电压3.5 kV;离子源温度100 ℃;脱溶剂气体温度400 ℃;气流量700 L/h;锥孔电压20 V;锥孔气流量50 L/h;碰撞能量6 V;检测器电压1.8 kV;质量范围20~1000/。
核磁共振表征波谱仪(NMR)表征:将N-1-脱氧-1-L-脯氨酸-D-果糖纯品粉末(15 mg)溶解于500 mL重水中。完全溶解后将其转移到NMR管中。利用全数字核磁共振波谱仪和5 mm PABBO探针,在25 ℃下做1H-NMR谱和13C-NMR谱测定。
1.3.5 ARP定量表征 采用外标法对ARP进行定量分析。蒸发光检测器漂移管温度50 ℃,喷雾器温度45 ℃,气体压力30 psi。由于ELSD蒸发光检测器信号是按取对数为线性,因而设为以10为底数的浓度的对数,设为以10为底数的峰面积的对数,得到脯氨酸-葡萄糖ARP标准曲线为=1.637 2+6.489 9。

1.3.6 卷烟加香 使用喉头喷雾器将空白水溶液反应体ARP、烟花水提液体系ARP、酶解液体系ARP及未加脯氨酸与葡萄糖的酶解液空白对照与烟丝按质量比1∶200均匀喷洒于烟丝中,采用DELUXE手动卷烟器将加香的烟丝打入空烟筒中卷制,把烟支放在温度(22±2)℃、湿度(60±2)%的恒温恒湿箱中平衡48 h,备用于感官品质评吸。
1.3.7 感官评吸 在GB 5606.4—2005的基础上,由贵州省烟草科学研究院9名评吸专家对卷烟加香后品质特征,包括香气质、香气量、杂气、刺激性、吃味进行评吸打分,得分随感官品质增加而递增,计分标度0至10分,总评分以平均值记[14]。
1.3.8 ARP合成反应动力学分析 将脯氨酸与葡萄糖在80、90、100、110 ℃温度条件下分别在水溶液和酶解液体系下反应30、60、90、120、150 min,根据阿伦尼乌斯方程计算不同体系ARP反应活化能(a)。
2 结 果
2.1 酶解处理对烟花提取质量的影响
不同酶制剂处理烟花后酶解液质量如表1所示。结果表明,纤维素酶的提取率最高,达36.1%,但纤维素酶与蛋白酶感官评吸结果均得分较低,表明纤维素酶、蛋白酶引入较多的蛋白质,间接增加了杂气和刺激性。果胶酶与漆酶则表现出较好的感官品质,综合感官评分为6.67与6.38。提取率并未与感官评分呈正相关,但其对生产成本影响显著,综合考虑感官评吸结果与提取率,选取烟花果胶酶酶解液进一步研究。

表1 酶解处理对烟花提取质量的影响
注:同列不同小写字母者表示处理间差异达到显著(≤0.05)水平。
Note: different lowercase letters in the same column indicate the significant level of 5% difference (≤0.05).
2.2 ARP的结构鉴定
对烟花酶解液反应体系制备的ARP提纯物进行质谱分析,UPLC-MS分析结果如图1所示。研究表明[15-16],N-1-脱氧-1-L-脯氨酸-D-果糖相对分子质量为277,根据质谱电离原理其所具有的亚氨基结构容易与质子结合形成=278的离子片段;当该片段连续脱去两分子H2O,即形成/=260与242的特征离子碎片,/=232离子碎片为母离子脱去一分子羧基后的离子碎片,/=116为母离子脱去两分子H2O与糖残基后的离子碎片,而/=128则为母离子脱去两分子H2O与氨基酸残基后的离子碎片。图1表明ARP的质谱特征与N-1-脱氧-1-L-脯氨酸-D-果糖一致,确定该物质为N-1-脱氧-1-L-脯氨酸-D-果糖。
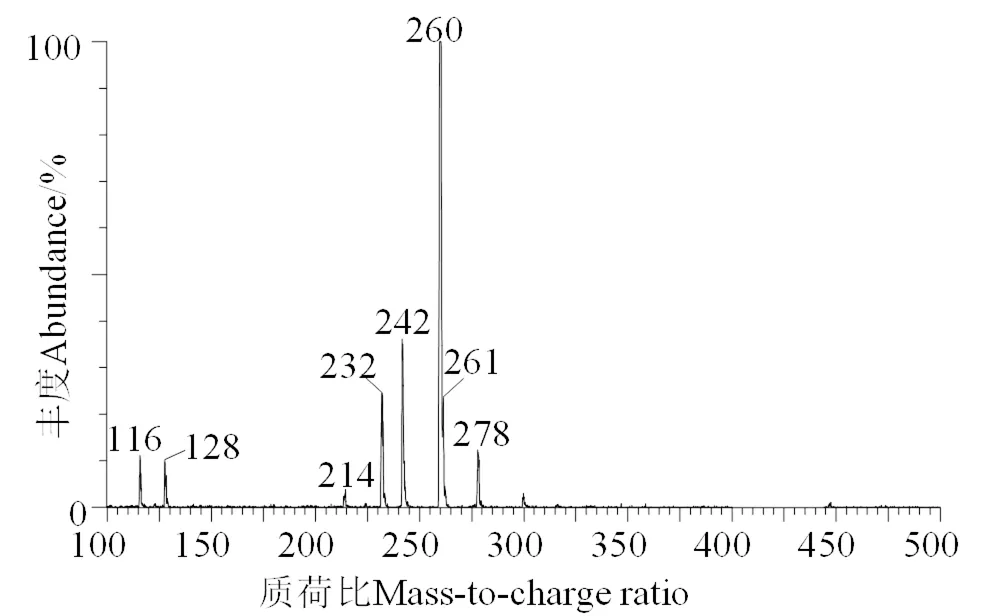
图1 N-1-脱氧-1-L-脯氨酸-D-果糖质谱图
将所得到的ARP粗品通过离子交换树脂纯化、冷冻干燥后获得粉末,并进行核磁共振分析。如图2、图3核磁共振氢谱(1H-NMR)和碳谱(13C-NMR)所示,在核磁共振图谱的预测区域中找到了共振信号,4种核磁归属N-1-脱氧-1-L-脯氨酸-D-果糖。N-1-脱氧-1-L-脯氨酸-D-果糖分子中由于含有葡萄糖基,在水中存在分子互变异构现象。13C-NMR谱在化学位移δ为207.00处有响应信号,表明存在N-1-脱氧-1-L-脯氨酸-D-果糖的链状酮式结构,但其较低的化学位移响应值说明N-1-脱氧-1-L-脯氨酸-D-果糖开链形式的含量相对较低。而β-D-吡喃糖、α-D-呋喃糖、β-D-呋喃糖和α-D-吡喃糖形式是可以观察到的4种主要构型。它们的化学位移如下:
N-1-脱氧-1-L-脯氨酸-D-果糖:1-β,1H NMR (400 MHz, D2O): δ = 4.26-3.24 (8H, H-2, H-3, H-4, H-5, H-6, H-8), 2.69-1.88 (6H, H-9, H-10, H-11);13C NMR (100 MHz, D2O): 173.86 (COOH), 95.65 (C-1), 71.47 (C-3), 70.92 (C-2), 69.97 (C-4), 68.90 (C-8), 63.75 (C-5), 59.32 (C-6), 57.37 (C-11), 28.28 (C-9), 23.36 (C-10).
N-1-脱氧-1-L-脯氨酸-D-果糖:2-α,1H NMR (400 MHz, D2O): δ = 4.26-3.24 (8H, H-2, H-3, H-4, H-5, H-6, H-8), 2.69-1.88 (6H, H-9, H-10, H-11);13C NMR (100 MHz, D2O): 174.13 (COOH), 101.80 (C-1), 82.69 (C-2), 82.54 (C-4), 73.69 (C-3), 69.40 (C-8), 60.69 (C-5), 58.66 (C-6), 57.23 (C-11), 28.65 (C-9), 23.29 (C-10).
N-1-脱氧-1-L-脯氨酸-D-果糖:2-β,1H NMR (400 MHz, D2O): δ = 4.26-3.24 (8H, H-2, H-3, H-4, H-5, H-6, H-8), 2.69-1.88 (6H, H-9, H-10, H-11);13C NMR (100 MHz, D2O): 173.72 (COOH), 98.91(C-1), 80.78 (C-4), 76.10 (C-2), 73.69 (C-3), 69.40 (C-8), 60.69 (C-5), 58.66 (C-6), 57.23 (C-11), 28.77 (C-9), 23.29 (C-10)。
N-1-脱氧-1-L-脯氨酸-D-果糖:1-α,1H NMR (400 MHz, D2O): δ = 4.26-3.24 (8H, H-2, H-3, H-4, H-5, H-6, H-8), 2.69-1.88 (6H, H-9, H-10, H-11);13C NMR (100 MHz, D2O): 173.86 (COOH), 96.45 (C-1), 73.67 (C-2), 71.95(C-3), 69.40 (C-4), 68.90 (C-8), 63.75 (C-5), 59.32 (C-6), 57.37 (C-11), 28.28 (C-9), 23.36 (C-10).
N-1-脱氧-1-L-脯氨酸-D-果糖的开链形式:1H NMR (400 MHz, D2O): δ=4.26-3.24 (8H, H-2, H-3, H-4, H-5, H-6, H-8), 2.69-1.88 (6H, H-9, H-10, H-11);13C NMR (100 MHz, D2O): 207.00 (C=O), 173.95 (COOH), 73.67 (C-2), 72.20 (C-4), 71.11 (C-3), 65.50 (C-8), 62.50 (C-5), 57.90 (C-6), 56.80 (C-11), 28.65 (C-9), 23.29 (C-10).
根据1H-NMR和13C-NMR 谱图分析及化学位移,并结合N-1-脱氧-1-L-脯氨酸-D-果糖在水中的存在构型,可推测其相对分子质量、分子式与质谱结构表征结果一致,为N-1-脱氧-1-L-脯氨酸-D-果糖离子片段。
2.3 果胶酶酶解液对脯氨酸-葡萄糖体系ARP产率的影响
不同反应溶剂下ARP产率如表2所示,未外源添加脯氨酸与葡萄糖的烟花酶解液在90 ℃,25 mbar条件下反应120 min,未见有ARP生成,表明酶解物本身不具有ARP反应前体。当外源补充脯氨酸与葡萄糖后,反应在水溶液体系下进行,ARP产率为39.91%,有39.91%的脯氨酸与葡萄糖反应转化为ARP;当反应溶剂为烟花水提液时,该产率显著升高至77.99%;而当酶解处理烟花后,以酶解液作为反应溶剂,ARP产率进一步提高至92.20%。

化学位移Chemical shift/10-6

化学位移Chemical shift/10-6
表2 不同反应溶剂对ARP产率的影响
Fig. 2 Effects of ARP preparation reaction solvent on the yield of ARP

溶剂种类Solvent type脯氨酸浓度Proline concentration/(mol∙L-1)ARP浓度ARP concentration/(mol∙L-1)产率Productivity/% 酶解液空白对照Enzymatic hydrolysate blank control0.000.000.00 未反应Initial concentration0.20±0.03a0.000.00 水溶液Aqueous solution0.11±0.01b0.08±0.01b39.91±4.95c 水提液Water extract0.08±0.01c0.16±0.01a77.99±5.23b 酶解液Enzymatic hydrolysate0.08±0.01c0.18±0.01a92.20±5.50a
2.4 动力学分析
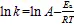
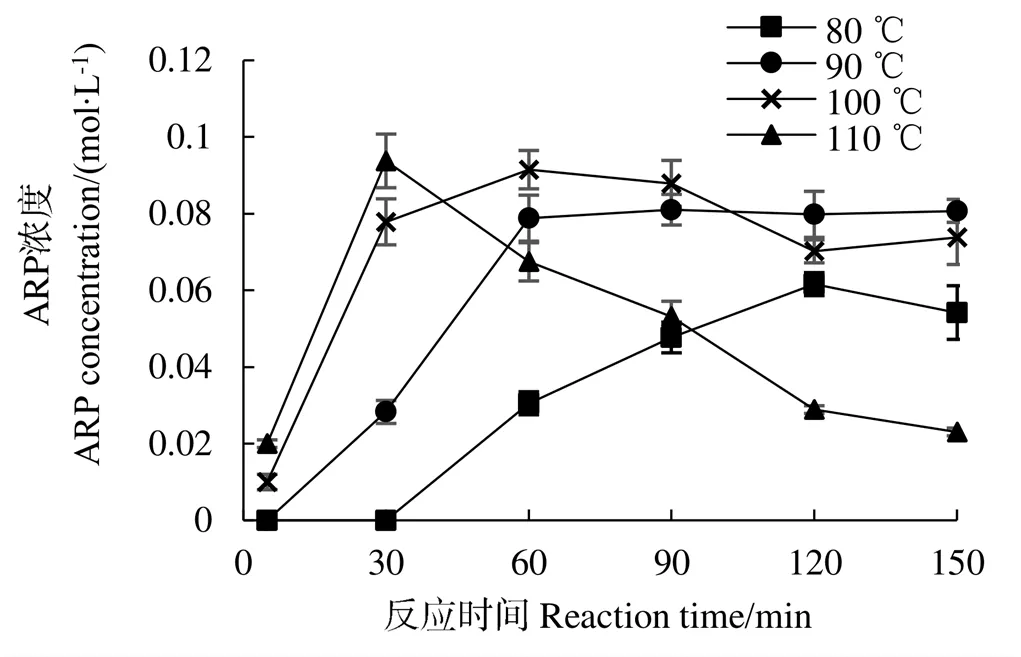
图4 水溶液体系中温度对热反应过程ARP化合物浓度的影响
烟花酶解液体系ARP随反应时间、温度变化的规律与水溶液体系趋势一致(图5),但ARP积累显著高于水溶液体系,在90 ℃反应120 min 时ARP获得最高浓度。当反应温度为80、90、100 ℃时,进行Inc~方程拟合,分别得到=0.040 70.032 8(²=0.973 3),=0.045 6−0.024(²=0.907 8),=0.053 2−0.030 2(²=0.940 2)。ln对1/的函数线性方程为=−1 760.4+1.777 6,a=14.63 KJ/mol,该活化能较水溶液反应体系活化能(a=25.68 kJ/mol)大大降低,表明在烟花酶解液体系下ARP合成更容易进行,可以显著提高脯氨酸-葡萄糖ARP产率。
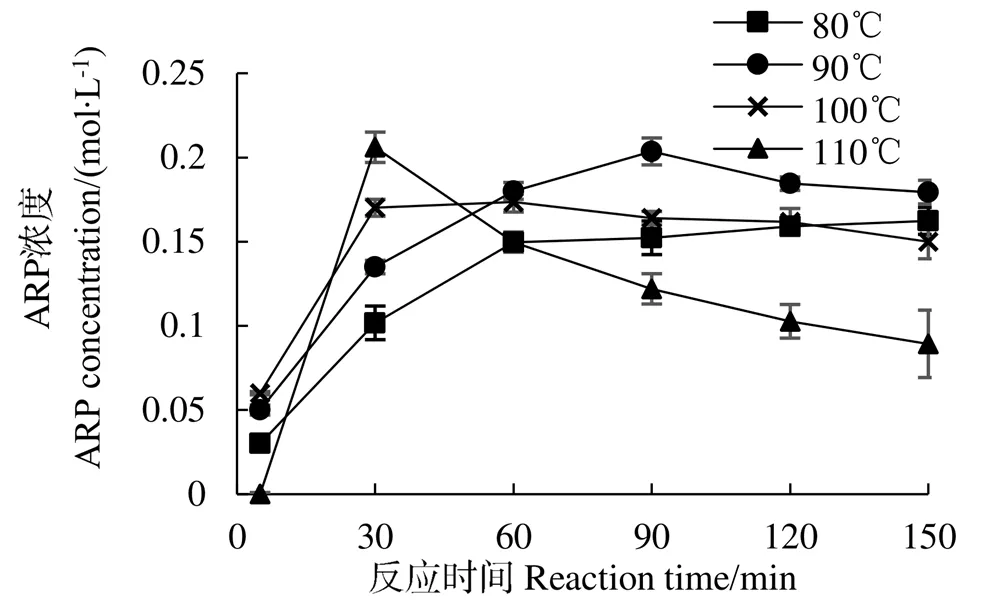
图5 烟花酶解液体系中温度对热反应过程Amadori化合物浓度的影响
2.5 烟花ARP卷烟加香感官评价
分别将空白水溶液反应体系ARP、烟花水提液体系ARP、酶解液体系ARP及未加脯氨酸与葡萄糖的酶解液空白对照溶液加入卷烟烟支进行评吸[1,14],结果如表3所示,烟花酶解液ARP感官评吸结果显著优于水溶液和烟花水提液反应体系,感官评价平均分为7.67,显著高于水溶液与水提液反应体系制备的ARP。水溶液体系制备的ARP相较于水提液体系的感官评吸结果表现更好,平均分为7.04,高于水提液体系ARP。未外源补充糖氨的酶解液空白对照,相较于水溶液ARP及水提液ARP有更好的感官表现。结合表2结果表明,烟花经过酶解后制备ARP可使得ARP产率显著提升,对卷烟感官评吸结果提升明显。
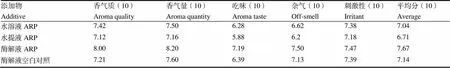
表3 不同反应体系制备的ARP卷烟加香感官评价
3 讨 论
美拉德反应中间体作为重要的致香前体物,其制备工艺是开发应用的关键。目前常用的水相制备法ARP产率较低,非烟添加剂的使用则会给烟气引入杂气,带来不协调香气[1,14]。在本研究中利用烟花酶解液作为功能反应基底制备脯氨酸-葡萄糖ARP,酶法辅助提取的使用可将致香原料中不利呈香的前体物如蛋白质、淀粉、木质素等分解为可利用的小分子糖类、氨基酸等组分,从而降低烟花青杂气,在后续工艺中美拉德反应过程亦可进一步利用降解的小分子参与热反应,以产生协调而丰富的香气[9-10,14]。提取率作为样品提取效率与提取程度的反应,影响着生产成本。不同酶制剂的酶解效果表明,纤维素酶提取率最高,碱性蛋白酶提取率最低,但果胶酶与漆酶则表现较好的感官结果。但是,从纤维素酶与果胶酶处理结果发现,提取率最高时的加香卷烟并未呈现出最好的感官得分,这可能跟酶本身作为蛋白质,对卷烟加香燃吸品质会产生影响有关[14]。同时,酶解液作为反应溶剂制备的ARP相较于水溶液和水提液体系感官结果更好,而烟花水提液则不可避免的引入色素、果胶等植物固有大分子物质,杂气较酶解液及水溶液体系更重。
在反应过程中,水既是溶剂,又是反应物[17],使得ARP在纯水溶剂条件下反应呈多向式可逆联动,ARP形成与降解同步进行,其产率多在50%以下[1]。热反应过程中,真空条件有利于氨基酸与葡萄糖形成的N-葡萄糖基胺脱去1分子H2O,改变反应平衡,促进反应不断向正向进行,从而促进ARP更有效积累[18-19]。为了进一步提高ARP产率,YU等[7]通过在水溶液中补充功能性组分,如表没食子儿茶素没食子酸酯(EGCG)等,可以使得美拉德反应下游生成的脱氧糖酮被捕获,以促进ARP的生成。而在本研究中并未选取非烟来源的添加剂,而是利用酶法辅助提取法使得烟花中不利呈香的果胶进一步水解为半乳糖醛酸,起到细胞壁破坏作用,从而使烟草原料中内源功能组分尽可能溶至提取液中加以利用。烟花细胞内流出的功能性组分,多酚类如绿原酸、芸香苷,非挥发性有机酸如苹果酸、琥珀酸等,与已知的脱氧糖酮捕获剂(如EGCG)具有类似的多羟基结构,这可能使得美拉德反应开始后反应路径改变、下游副产物被捕获,从而降低ARP形成反应活化能的目的,与崔和平等[19]、YU等[6]、WEI等[20]报道的多酚类化合物对于ARP水相产率提高的结果一致,最终使得烟花酶解液反应体系ARP产率显著高于水溶液和水提液体系。
本研究在烟丝中添加烟花酶解液制备的ARP,感官评吸得分优于添加空白水溶液制备的ARP。这一方面可能是由于酶解后烟花致香性能被再次挖掘,异味和青杂气也一定程度减弱;另一方面则可能是脯氨酸作为烟草内源主要氨基酸,由其所制备的ARP与卷烟天然融合感更强,从而对香气质、香气量的提升更直接;同时,在烟花酶解液和ARP共同作用下,混合体系美拉德反应物较纯水相单一种类的美拉德反应中间体在香气量、吃味、香气丰富度优势明显,在香韵协调性和烟香融合感方面更好[18]。烟花酶解液空白对照评价好于水溶液和水提液ARP体系,也证明了酶解液中丰富的细胞内源组分对于卷烟香气的改善作用。
4 结 论
本研究表明,烟花酶解液可以作为功能反应基底,对脯氨酸-葡萄糖美拉德反应重排产物(ARP)制备产率有显著促进作用。反应动力学结果表明,在烟花酶解液参与ARP形成过程中,反应活化能显著降低,有利于反应向ARP合成积累方向进行。同时,由于烟花酶解液的存在,烟花基ARP在卷烟评吸品质特征方面较空白水溶液ARP和烟花水提液ARP提升明显。研究有望为传统卷烟和新型烟草制品香精香料制备提供新的思路。
[1] 邓仕彬. 美拉德反应中间体的水相制备及其在卷烟中的应用[D]. 无锡:江南大学,2017.
DENG S B. Preparation of Maillard reaction intermediates inaqueous medium and its application of cigarettes[D]. Wuxi: Jiangnan University, 2017.
[2] TROISE A D, BERTON-CARABIN C C, FOGLIANO V. Amadori products formation in emulsified systems[J]. Food Chemistry, 2016, 199(15): 51-58.
[3] STEFANOWICZ P, KIJEWSKA M, KAPCZYŃSKA K, et al. Methods of the site-selective solid phase synthesis of peptide-derived Amadori products[J]. Amino Acids, 2010, 38(3): 881-9.
[4] DELGADO-ANDRADE C, SEIQUER I, HARO A, et al. Development of the Maillard reaction in foods cooked by different techniques. intake of Maillard-derived compounds[J]. Food Chemistry, 2010, 122(1): 145-153.
[5] 黄梅桂. 大豆肽美拉德反应体系中色泽抑制及其机理研究[D]. 无锡:江南大学,2012.
HUANG M G. Study on color inhibition and its mechanism in Maillard reaction system of soybean peptide[D]. Wuxi: Jiangnan University, 2012.
[6] YU X H, CUI H P, HAYAT K, et al. Effective mechanism of (-)-epigallocatechin gallate indicating the critical formation conditions of Amadori compound during an aqueous Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 2019, 67(12): 3412-3422.
[7] YU J H, CUI H P, TANG W, et al. Interaction of (-)-epigallocatechin gallate and deoxyosones blocking the subsequent Maillard reaction and improving the yield of N-(1-Deoxy-D-xylulos-1-yl)alanine[J]. Journal of Agricultural and Food Chemistry, 2020, 68(6): 1714-1724.
[8] 许春平. 以烟草花蕾为原料制备烟用香料的研究[C]//上海第四届全国香料香精化妆品专题学术论坛论文集. 上海:全国轻工业香精香料行业生产力促进中心:上海香料研究所,2015:40.
XU C P. Study on the preparation of tobacco flavor from tobacco bud [C]//Shanghai, the fourth national symposium on spice and fragrance cosmetics symposium. Shanghai: National Light Industry Flavor and Fragrance Industry Productivity Promotion Center: Shanghai perfume Research Institute, 2015: 40.
[9] 许春平,王充,李萌姗,等. 不同产地烤烟花蕾浸膏挥发性成分的主成分分析[J]. 轻工学报,2017,32(2):48-57.
XU C P, WANG C, LI M S, et al. Principal component analysis of volatile components of flue-cured tobacco bud extract from different producing areas[J]. Journal of Light Industry, 2017, 32(2): 48-57.
[10] 马宇平,苏东赢,许春平,等. 通过美拉德反应法以烟草花蕾为原料制备烟用香料的方法,CN103849467A[P]. 2014-06-11.
MA Y P, SU D Y, XU C P, et al. Preparation of tobacco flavor from tobacco bud by Maillard reaction: CN103849467A[P]. 2014-06-11.
[11] 李萌姗. 烟草花蕾精油的提取、生物活性及其应用研究[D]. 郑州:郑州轻工业大学,2016.
LI M S. Study on extraction, bioactivity and application of tobacco bud essential oil[D]. Zhengzhou: Zhengzhou University of Light Industry, 2016.
[12] 许春平,李萌姗,谭兰兰,等. 不同产地烟草花蕾精油的抑菌和抗氧化能力比较研究[J]. 中国烟草学报,2016,22(3):72-78.
XU C P, LI M S, TAN L L, et al. Comparative study on antibacterial and antioxidant capacity of tobacco bud essential oil from different producing areas[J]. Chinese Journal of Tobacco, 2016, 22(3): 72-78.
[13] 张鹏,于静洋,龙章德,等. 美拉德反应改善烟草薄片质量的应用研究[J]. 食品与机械,2016,32(3):39-44.
ZHANG P, YU J Y, LONG Z D, et al. Application of Maillard reaction to improve the quality of tobacco flakes[J]. Food and Machinery, 2016, 32 (3): 39-44.
[14] 崔凯,孟广宇,刘艺,等. 感知标示量度卷烟感官评价方法的建立及应用[J]. 烟草科技,2015,48(3):74-78.
CUI K, MENG GY, LIU Y, et al. Establishment and application of sensory evaluation method of cigarette based on sensory labeling[J]. Tobacco Science and Technology, 2015, 48(3): 74-78.
[15] MILLS F D, HODGE J E. Amadori compounds: vacuum thermolysis of 1-deoxy-1-l-prolino-d-fructose[J]. Elsevier, 1976, 51(1): 9-21.
[16] JUN W, YIMIN L, BAIZHAN L, et al. Electrospray positive ionization tandem mass spectrometry of Amadori compounds[J]. Journal of Mass Spectrometry, 2008, 43(2): 262-264.
[17] TOMAS D, NATHALIE C, SANDRA A, et al. Degradation of the Amadori compound N-(1-deoxy-D-fructos-1-yl) glycine in aqueous model systems[J]. Journal of Agricultural & Food Chemistry, 2002, 50(19): 5472-5479.
[18] HUAN Z, WEI T, HEPING C, et al. Formation kinetics of Maillard reaction intermediates from glycine-ribose system and improving Amadori rearrangement product through controlled thermal reaction and vacuum dehydration[J]. Food Chemistry, 2020, 311: 125877.1- 125877.10.
[19] 崔和平. 美拉德反应中间体的水相制备及其加工风味形成规律研究[D]. 无锡:江南大学,2019.
CUI H P. Study on aqueous phase preparation and processing of Maillard reaction intermediates and the law of flavor formation[D]. Wuxi: Jiangnan University, 2019.
[20] WEI T, HEPING C, FULI S, et al. N-(1-Deoxy-d-xylulos-1-yl)- glutathione: a maillard reaction intermediate predominating in aqueous glutathione-xylose systems by simultaneous dehydration-reaction[J]. Journal of Agricultural and Food Chemistry, 2019, 67(32): 8994-9001.
Preparation of Amadori Compounds Based on Tobacco Flower Enzymatic Hydrolysates
SUN Zhenchun1, YANG Hui1, QU Fang2, LIN Yechun1, ZHANG Changyun1, LONG Yong3, SU Xiankun1*
(1. Tobacco Science Institute of Guizhou Province, Guiyang 550081, China; 2. Huangguoshu Jinye Technology Co., Ltd., Anshun, Guizhou 561000, China; 3. Tongren Branch of Guizhou Provincial Tobacco Company, Tongren, Guizhou 554300, China)
Maillard Rearrangement Products (ARP), which are regarded as one of the tobacco latent aromatic substances, showed a relative high reaction activity under thermal processing. APP thus could be used as novel tobacco flavors and fragrances. To increase the productivity of ARP and the aroma quality, the enzymatic hydrolysate of tobacco flower coordinated with vacuum evaporation was used to synthesize ARP via Maillard Reactions. The ARP productivity of tobacco flower enzymatic Maillard reaction system was significantly increased from 39.91% to 92.20% at 90 ℃ and 25 mbar for 120 min. The chemical kinetic showed that the activation energy of the reaction present in the enzymatic hydrolysate solution was 14.64 kJ/mol, which was much lower than the reaction in aqueous solution. The sensory evaluation showed that the quality characteristics and coordination of the cigarette smoke was significant improved, providing a new solution for novel tobacco flavor design.
Amadori rearrangement product; tobacco flower; Maillard reaction; chemical reaction kinetics
10.13496/j.issn.1007-5119.2022.04.013
TS41+1
A
1007-5119(2022)04-0096-08
贵州省科技厅基础研究计划项目{黔科合基础-ZK[2021]一般175};贵州省科技厅科技计划项目{黔科合平台人才[2020]4102号};中国烟草总公司贵州省公司科技项目(2022XM14);贵州省烟草科学研究院项目{烟科院[2021]12号}
孙振春(1991-),男,助理研究员,博士,研究方向为烟草香味化学。E-mail:zhenchunsun@hotmail.com
,E-mail:65613687@qq.com
2021-10-14
2022-08-08
