不同类型胰蛋白酶消化Vero 细胞和KMB-17 细胞的比较
2022-09-21阮朝列陈洪波张泽珩雍国胜刘伯川赵红玲刘双芹廖国阳李卫东
阮朝列,陈洪波,张泽珩,雍国胜,刘伯川,赵红玲,陈 瑜,刘双芹,廖国阳,李卫东,周 健
(中国医学科学院 北京协和医学院 医学生物学研究所,云南 昆明 650118)
基于细胞培养的生命科学与生物制品行业在当今已经得到了广泛的发展与应用[1].通过大量的细胞培养,可以有针对性、大规模、快速地生产各类生物制品[2].细胞传代是细胞培养中必不可缺的环节,对于贴壁细胞而言,根据每种细胞的类型和其生长特点以及实验目的,当细胞密度达到传代要求时就要进行传代操作.细胞传代一般使用胰蛋白酶消化细胞使得细胞间的粘附蛋白(如胶原蛋白、钙粘蛋白、纤连蛋白、整连蛋白等)降解,从而使细胞分开.胰蛋白酶一般分离于动物的胰腺组织,目前最常用的胰蛋白酶大多来源于猪胰腺.一方面,不同来源的胰蛋白酶对于不同的细胞作用效果是不一样的,且胰蛋白酶的活性与其种类、浓度、作用时间、温度等都有关.Vero 细胞(非洲绿猴肾细胞)和KMB-17 细胞(人二倍体细胞)作为生物制品行业长期以来的“明星”细胞,特别对于疫苗行业来说,它们用于狂犬疫苗、新冠疫苗、脊髓灰质炎疫苗、肠道病毒疫苗等疫苗的生产[3].因此,研究胰蛋白酶对Vero 细胞和KMB-17 细胞的消化效果很有必要.另一方面,出于对伊斯兰国家及人群信仰的尊重,生产出满足Halal(清真)验证的疫苗是生物制品中不可忽视的一个环节,这就使得传统来源于猪的胰蛋白酶将不得使用[4-5].来源于牛胰腺组织的胰蛋白酶和非动物源的合成消化酶TrypLE 在市场上也得到了充分的应用[6],这就为我们寻求猪源胰蛋白酶的替代品提供了可能.
本研究比较了市面上常用的4 种消化酶消化Vero 细胞和KMB-17 细胞的效果.选择1 种传统的来源于猪的胰蛋白酶、2 种来源于牛的胰蛋白酶和合成的消化酶TrypLE,试图探寻培养细胞的最佳消化工艺和Halal(清真)验证中关于猪源胰蛋白酶的替代问题,以期为以细胞传代培养为基础的生物制品行业的发展提供借鉴.
1 材料与方法
1.1 细胞Vero 细胞购自欧洲动物细胞收藏中心(ECACC,编号03129010),传至141 代制成工作种子库,由本实验室保存.KMB-17 细胞(人胚肺二倍体细胞),中国医学科学院医学生物学研究所具有自主知识产权,工作代数30 代.
1.2 主要试剂及仪器MEM 培养基(KMB-17 细胞用)、DMEM 培养基(Vero 细胞用)、0.01 mol/L PBS 溶液和猪源胰酶(配制后活力为1 451.25 U/mL)由中国医学科学院医学生物学研究所提供.新生牛血清购于兰州民海生物工程有限公司.牛源胰酶-1干粉(货号T9935,批号SLBZ0316,活力13 164 U/mg)、牛源胰酶-2 干粉(货号T9935,批号SLBR5744V,活力4 508 U/mg)购于SIGMA 公司.两种牛源胰酶溶解后,牛源胰酶-1 活力为1 462.67 U/mL,牛源胰酶-2 活力为1 502 U/mL,3 种动物源胰酶溶液均添加EDTA-Na2至终质量浓度为0.08 mg/mL,pH 均为7.6.全合成胰蛋白酶TrypLE 试剂(货号12605010)购于Thermo Fisher Scientific 公司;Countstar 自动细胞计数仪购自上海睿珏生物科技有限公司.CCK-8 试剂盒购自碧云天公司,用于检测细胞增殖和毒性.96 孔板;6 孔板;T25 细胞培养瓶;酶标仪;二氧化碳恒温培养箱.
1.3 细胞培养及消化细胞复苏后传代至12 个T25 细胞培养瓶中,细胞生长成致密单层后,随机每3 瓶(n=3)为一个实验组,共4 组.每组用0.01 mol/L 的PBS 洗去残留培养基后分别加入5 mL 的猪源胰酶、牛源胰酶-1、牛源胰酶-2 和全合成胰蛋白酶TrypLE 浸润30 s 后弃去,置37 ℃温箱继续消化,直至显微镜下观察到细胞变圆脱落并出现细胞断裂现象时,加入5 mL 细胞培养液终止消化,统计消化时间.反复吹吸使细胞分散,混匀后吸取稀释后的细胞悬液用Countstar 自动细胞计数仪检测细胞密度及细胞活率.
1.4 细胞增殖和毒性检测与生长动态分别将每组消化下来的细胞稀释至2×105mL−1,接种至96孔板和6 孔板继续培养.96 孔板每孔接种100 μL细胞悬液,共接种5 块板,每块板含4 种不同酶消化的细胞,每种酶消化的细胞共8 个孔(n=8),培养至12、24、48、72、96 h 后取出加入CCK-8 试剂孵育1 h,然后用酶标仪测定吸光度(450 nm)用于评价细胞增殖和毒性.6 孔板每孔接种2.5 mL 细胞悬液,共接种10 块板,每种酶消化的细胞各3 个孔(n=3),培养至24、48、96、120、144 h 后取出用0.125%猪源胰酶消化细胞检测细胞密度和活率.
1.5 重复性验证采用筛选出的最优消化条件对T25 瓶培养的细胞进行消化传代,传代培养96 h 后统一用猪源胰酶消化细胞后检测活细胞密度,实验进行10 次(n=10),计算10 次实验活细胞密度的变异系数CV(coefficient of variation,%),用于评价消化酶在多次实验中的重复性和稳定性,CV=(标准偏差/平均值)×100%.
1.6 统计学分析应用Prism 8 软件对实验数据进行统计分析,不同胰蛋白酶组间采用t检验和单因素方差分析(F检验),以P<0.05 为差异有统计学意义(P<0.05 标*,P<0.01 标**,P<0.001 标***,P<0.000 1 标****).
2 结果
2.1 消化酶种类和细胞类型对消化效果的影响细胞的消化差异以细胞活率为主要评价指标.组间t检验结果显示,消化酶的种类对消化作用存在影响.在Vero 细胞消化实验中,猪源胰酶与牛源胰酶-1、牛源胰酶-2、TrypLE 的消化能力存在显著差异;牛源胰酶-1 与牛源胰酶-2 消化能力无显著差异;牛源胰酶-1 与TrypLE 消化能力有显著差异,牛源胰酶-2 与TrypLE 消化能力有显著差异(图1(a)).TrypLE 消化Vero 细胞活率为88.85%(表1).在KMB-17 细胞消化实验中,消化酶的种类对KMB-17 细胞消化能力均无显著差异(图1(b)),消化后平均细胞活率均大于98%(表1).值得注意的是,4种胰蛋白酶消化Vero 细胞和KMB-17 细胞的平均消化时间存在显著差异(图1(c)、(d)),但消化时间与细胞活率之间并不直接相关,说明相同的活力单位下不同来源的消化酶对不同的细胞的消化能力和对细胞的作用机制是不一样的.
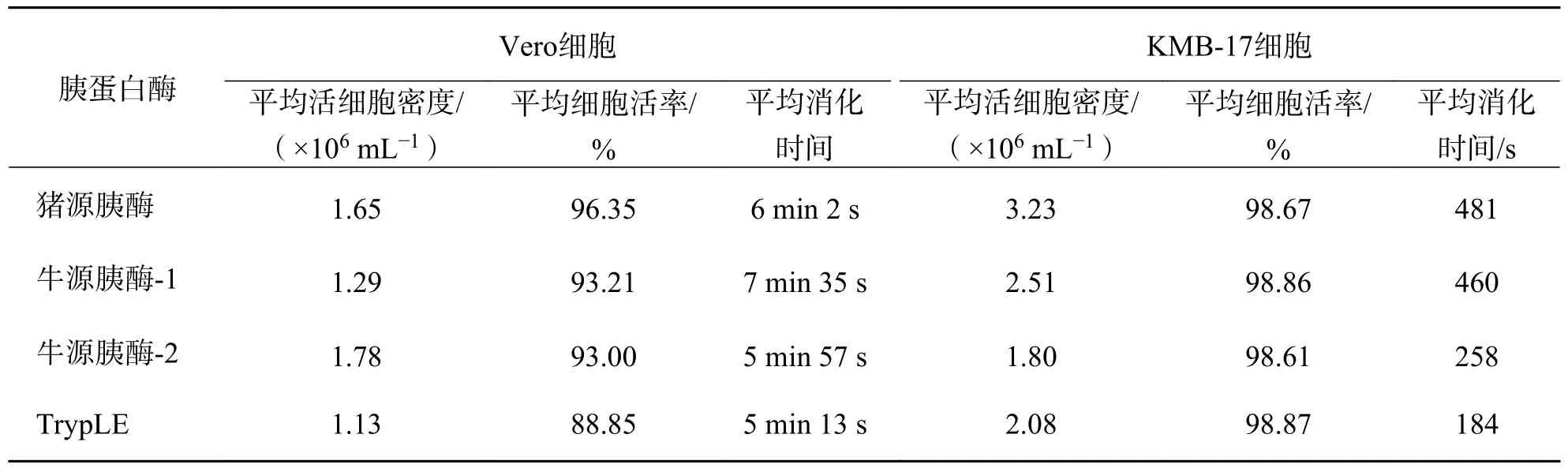
表1 不同种类消化酶消化Vero 细胞和KMB-17 细胞效果(n=3)Tab.1 Effect of different digestive enzymes on Vero cells and KMB-17 cells (n=3)
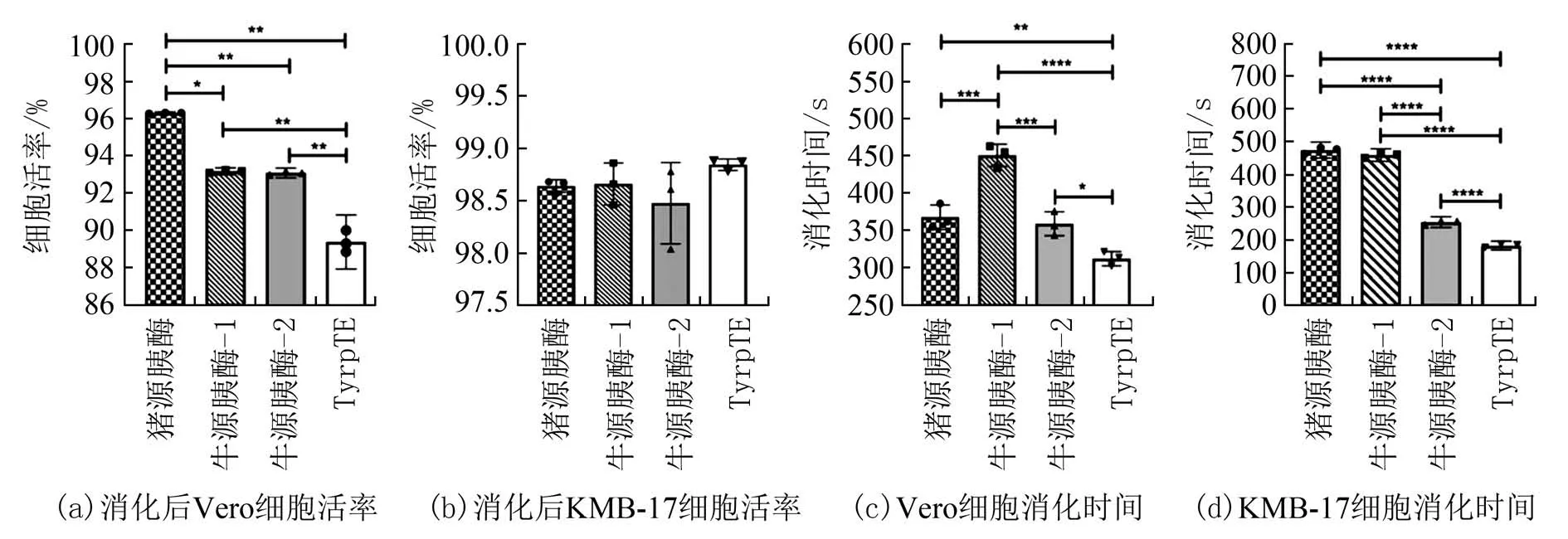
图1 不同种类消化酶消化Vero 细胞和KMB-17 细胞效果对比Fig.1 Comparison of digestion effects of different digestive enzymes on Vero cells and KMB-17 cells
2.2 胰蛋白酶的种类对细胞增殖活力的影响细胞经不同的胰蛋白酶消化后接种至96 孔板中,采用相同条件培养至不同时间后用CCK-8 试剂检测细胞增殖和毒性.单因素方差分析(F检验)结果表明胰蛋白酶的种类对于细胞增殖和毒性有影响.Vero 细胞在4 种胰蛋白酶消化后培养12 h 表现出明显的细胞增殖和毒性差异(图2(a)).随着时间的延长差异越明显,其中牛源胰酶-2 在24 h 后即表现出与其他3 种胰酶明显的差异,说明牛源胰酶-2 对于Vero 细胞的增殖和毒性影响最大;猪源胰酶和牛源胰酶-1 在各阶段未表现出显著差异.全合成胰酶TrypLE 虽然在消化Vero 细胞后细胞活率小于90%(88.4%),但其对Vero 细胞的增殖和毒性影响却最小.说明牛源胰酶-1 和TrypLE 均可作为候选胰酶用于Vero 细胞的消化.KMB-17 细胞在24 h 内均未表现出明显的细胞增殖活力差异(图3).48 h 之后牛源胰酶-2 相对于其他3 种胰酶来说对细胞增殖和毒性的影响最小,说明牛源胰酶-2 消化的KMB-17 细胞的效果好.
2.3 不同胰蛋白酶消化传代后细胞生长动态细胞经不同的胰蛋白酶消化后传代至6 孔板中按相同的条件进行培养,并绘制生长曲线.从Vero 细胞生长曲线(图4)可见,相较于TrypTE,使用猪源胰酶、牛源胰酶-1 和牛源胰酶-2 消化Vero 细胞在一定程度上延长了细胞生长的潜伏期,这与细胞增殖和毒性检测结果一致(图2).与Vero 不同的是,KMB-17 细胞经牛源胰酶-1 和TrypTE 消化后细胞潜伏期长达72 h(图5),这与细胞增殖活力检测结果一致(图3).细胞培养至144 h 后,经猪源胰酶、牛源胰酶-1 和TrypLE 消化后的Vero 细胞密度相对牛源胰酶-2 高,但无统计学差异(图6(a)).猪源胰酶和牛源胰酶-2 消化后的KMB-17 细胞活细胞密度最高,无统计学差异;与猪源胰酶和牛源胰酶-2 相比较TrypLE 消化KMB-17 细胞活细胞密度最低,其次是牛源胰酶-2(图6(b)),有统计学差异.
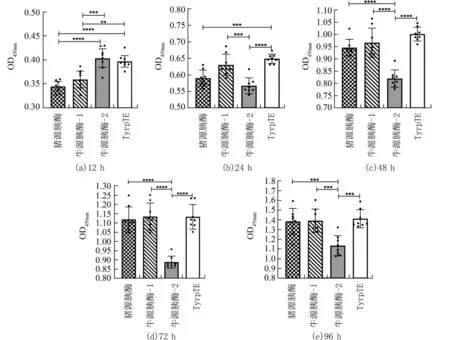
图2 不同种类消化酶消化Vero 细胞各阶段增殖活力对比(n=8)Fig.2 Comparison of the proliferation activity of Vero cells in different stages of digestion with different digestive enzymes (n=8)
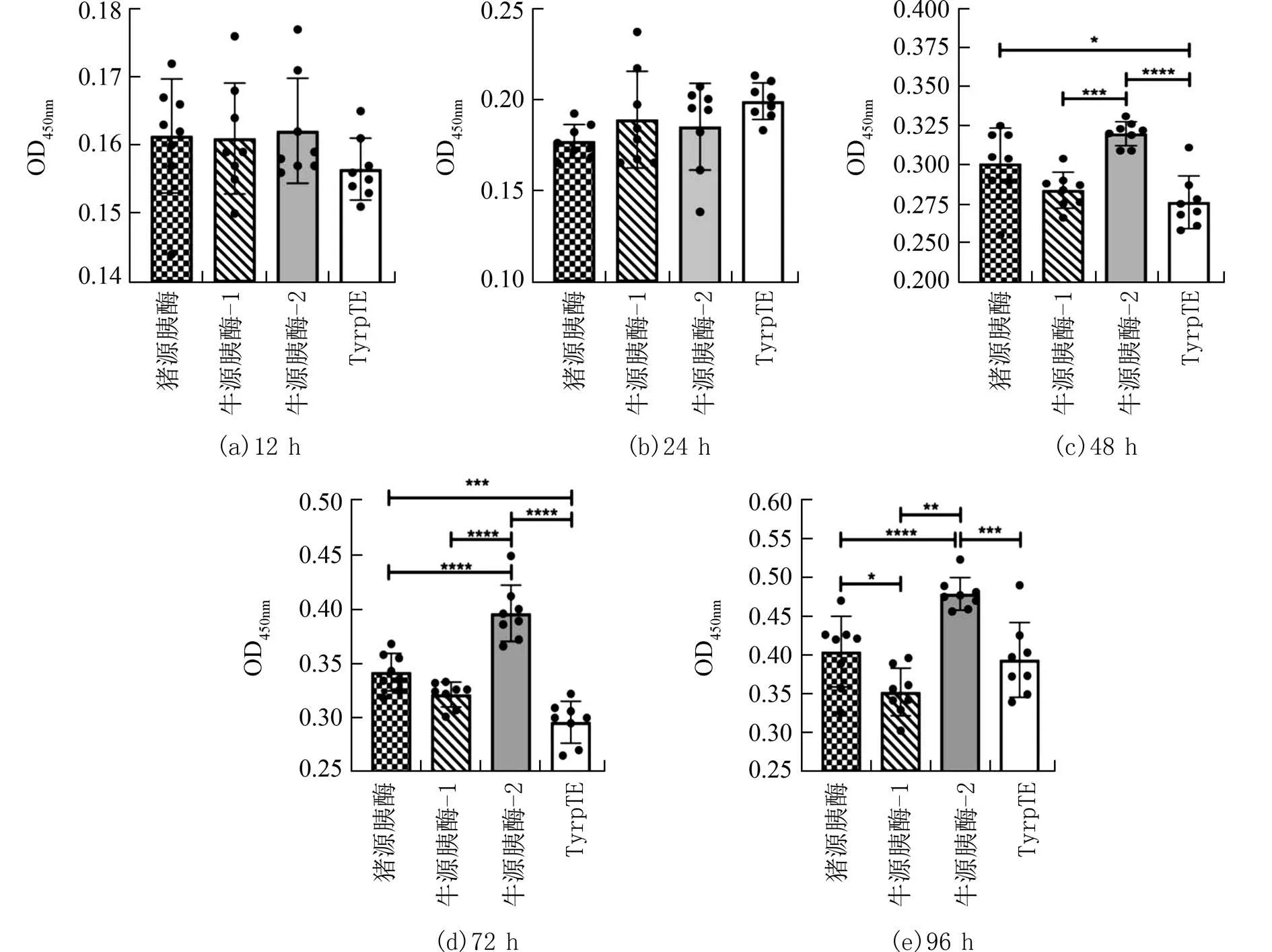
图3 不同种类消化酶消化KMB-17 细胞各阶段增殖活力对比(n=8)Fig.3 Comparison of the proliferation activity of KMB-17 cells in different stages of digestion with different digestive enzymes (n=8)
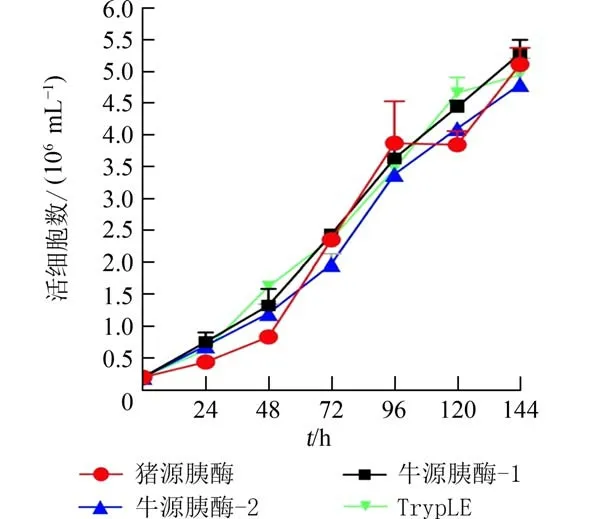
图4 不同胰蛋白酶消化传代后Vero 细胞生长动态(n=3)Fig.4 Growth dynamics of Vero cells after different trypsin digestion and passage(n=3)
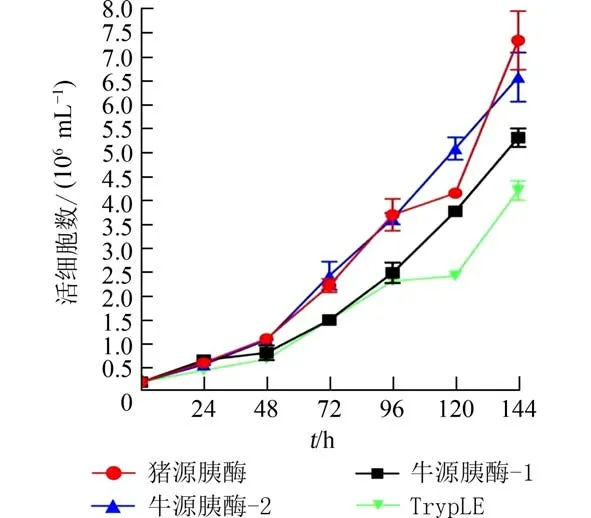
图5 不同胰蛋白酶消化传代后KMB-17 细胞生长动态(n=3)Fig.5 Growth dynamics of KMB-17 cells after different trypsin digestion and passage(n=3)
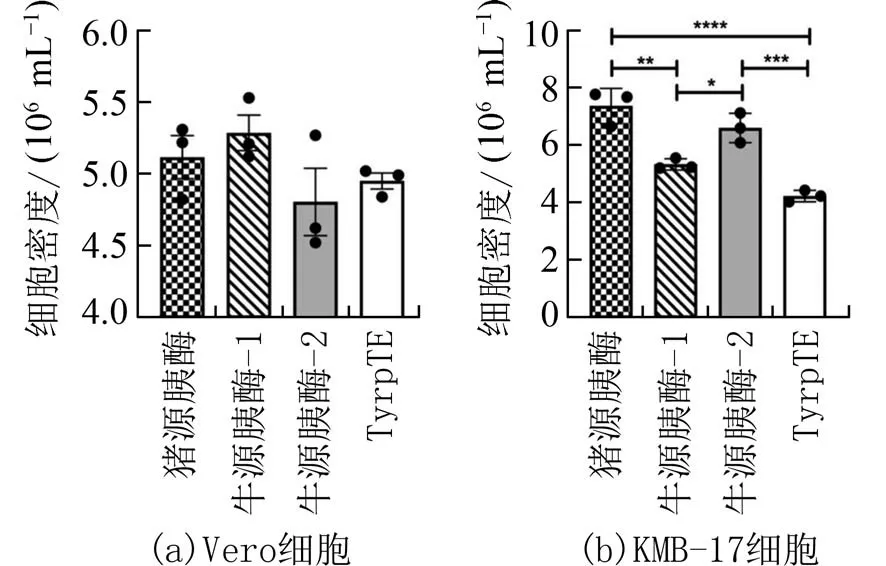
图6 不同胰蛋白酶消化Vero 细胞和KMB-17 细胞传代后144 h 活细胞密度对比Fig.6 Comparison of live cell density at 144 h after passage of Vero cells and KMB-17 cells digested by different trypsin
此外,如图7 和8 所示,细胞经不同的胰蛋白酶消化后不同时间进行显微镜拍照记录,肉眼没有发现明显的细胞形态差异.

图7 Vero 细胞消化后不同时间点细胞形态Fig.7 The morphology of Vero cells at different time points after digestion
2.4 重复性验证综上,对于Vero 细胞的消化可选择牛源胰酶-1、TrypLE;KMB-17 细胞可选择牛源胰酶-2 作为猪源胰酶的替代.10 次重复实验显示,Vero 细胞经猪源胰酶、牛源胰酶-1 和TrypLE消化培养96 h 后所获活细胞密度的CV 分别为1.08%、1.12%、1.22%(表2),表明使用猪源胰酶、牛源胰酶-1 和TrypLE 消化Vero 细胞重复性好.KMB-17 细胞经猪源胰酶和牛源胰酶-2 消化培养96 h 后所获活细胞密度的CV 分别为1.15%、1.04%(表2),表明使用猪源胰酶和牛源胰酶-2 消化KMB-17 细胞重复性较好.
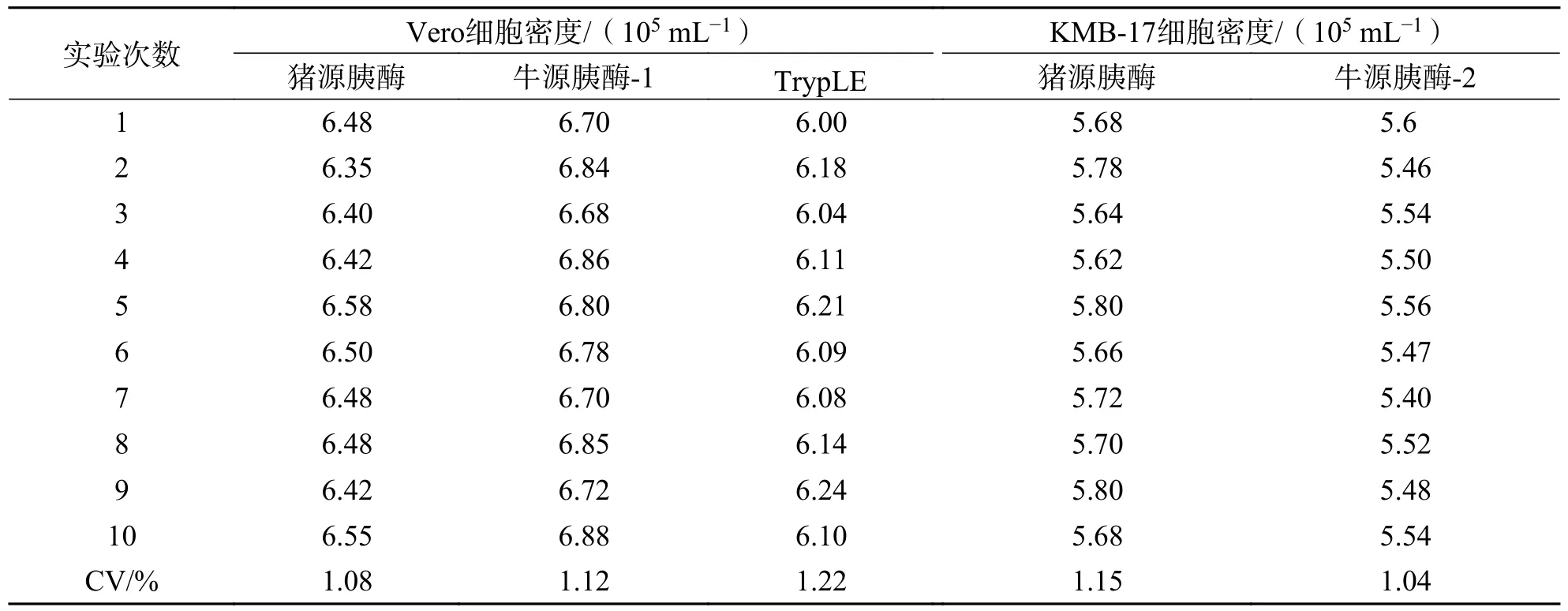
表2 消化传代Vero 细胞和KMB-17 细胞细胞密度重复性验证Tab.2 Validation of cell density repeatability of digestive passage Vero cells and KMB-17 cells
3 讨论
本研究比较了在相同活力单位下猪源胰酶、牛源胰酶-1、牛源胰酶-2 和TrypLE 消化Vero 细胞和KMB-17 细胞的差异.通过消化后传代培养,利用CCK-8 试剂检测细胞在不同阶段的增殖和毒性,并且利用Countstar 自动细胞荧光计数仪进行细胞数量和活率的检测,保证了数据的可靠性.
结果显示,在几乎相同的胰酶活力下(猪源胰酶活力为1 451.25 U/mL、牛源胰酶-1 活力为1 462.67 U/mL,牛源胰酶-2 活力为1 502 U/mL),4 种消化酶对Vero 细胞消化效果有显著差异,对KMB-17细胞无显著差异.Vero 细胞消化实验中,猪源胰酶对其他3 种消化酶的消化能力有显著差异.另外,4 种消化酶消化Vero 细胞和KMB-17 细胞的平均消化时间均存在显著差异,但消化时间与细胞活率之间并不直接相关,与不同胰酶作用位点的差异有关.经TrypLE 消化后的Vero 细胞活率较低,有研究显示,残留的TrypLE 损害了细胞附着与生长[7].同样地,Umegaki 等[8]研究了胰蛋白酶对人类角蛋白细胞生长的影响表明TrypLE 会诱导细胞密度下降,但不影响细胞活性,这与我们的结果一致.
其次,消化酶的种类对Vero 细胞和KMB-17细胞的增殖活力和细胞毒性是有影响的,且不同时间对不同细胞影响不同.4 种胰蛋白酶在消化后12 h对Vero 细胞表现出明显的细胞增殖和毒性差异,这种差异随着时间的延长越明显,说明胰蛋白酶会损害细胞的生长,与Rourou 等[7]研究结果一致.有意思的是,全合成胰酶TrypLE 虽然在消化Vero 细胞后细胞活率小于90%(88.4%),从10 次重复实验来看TrypLE 的确会降低细胞密度,但对Vero 细胞的增殖和毒性影响最小,与Umegaki 等[8]的研究结果一致.总的来说,牛源胰酶-2 对于Vero 细胞的增殖和毒性影响最大,TrypLE 影响最小.对于KMB-17细胞来说,4 种胰酶消化后24 h 内均未表现出明显的细胞增殖和毒性差异,48 h 之后就表现出了明显的差异,其中牛源胰酶-2 在48 h 之后相对于其他3 种胰酶来说对细胞增殖和毒性的影响最小.另外,不同胰蛋白酶消化传代后细胞生长动态结果也与增殖和毒性的结果相吻合.值得注意的是,使用不同胰酶消化细胞对细胞的影响表现为对细胞潜伏期的延长,推测是消化酶损伤了细胞表面的蛋白或其他,因此细胞需要更长的潜伏期来修复和进行复制物质的准备.
最后,经过10 次的重复实验,我们确定Vero细胞经猪源胰酶、牛源胰酶-1 和TrypLE 消化培养96 h 后所获活细胞密度的CV 分别为1.08%、1.12%、1.22%,重复性好;KMB-17 细胞经猪源胰酶和牛源胰酶-2 消化培养96 h 后所获活细胞密度的CV 分别为1.12%、1.14%,重复性好.为尊重全球伊斯兰国家及人群的信仰,药物的Halal(清真)状态可确保该产品不含猪肉或其他禁止的成分[9].与此类似的还有犹太教,也禁止食用猪肉和其他衍生物[10-11].因此,在以常规猪源胰蛋白酶消化细胞培养为基础的生物制品行业中,来源于猪的胰蛋白酶将不得使用[4-5].一方面,全球1/4 且不断增长的穆斯林人群对生物制品尤其是疫苗的需求量是极其巨大[5].另一方面,在生物制品行业潜在的利润丰厚的驱动下,许多制药公司和国家都试图提出清真疫苗和建立清真药品标准,例如诺华公司和马来西亚等.我们的结果表明,Halal(清真)验证中可使用牛源胰酶-1 和TrypLE 替代猪源胰酶消化Vero 细胞,消化KMB-17 可使用牛源胰酶-2 替代猪源胰酶.

图8 KMB-17 细胞消化后不同时间点细胞形态Fig.8 The morphology of KMB-17 cells at different time points after digestion
