急性肝胰腺坏死病病原菌毒力的初步研究
2022-09-21李吉云孟庆国万夕和冯艳琴李浩澜
李吉云,沈 辉,孟庆国,万夕和,蒋 葛,乔 毅,成 婕,冯艳琴,3,李浩澜
( 1.南京师范大学 海洋科学与工程学院,江苏 南京 210000;2.江苏省海洋水产研究所,江苏 南通 226007;3.江苏海洋大学 海洋科学与水产学院,江苏 连云港 222000 )
急性肝胰腺坏死病作为一种新兴虾类疾病,自2009年我国海南省暴发以来,至今仍对全球对虾养殖业产生严重影响[1]。2012年,亚太水产养殖联盟因病虾表现出独特的肝胰腺坏死症状,将该病命名为急性肝胰腺坏死病。起初,部分学者认为,该病的发生与黄头病毒[2]、对虾种质[3]、养殖环境恶化[4]等因素有关。2015年,Tran等[5]通过试验确定了该病的病原为一类特异的副溶血弧菌(Vibrioparahaemolyticus),这类特异的副溶血弧菌通过编码二元毒素pirA和pirB而具有致病性[6];Lee等[7]通过基因重组和敲除pirA和pirB毒力基因获得突变株进行试验,进一步证明这两种毒素蛋白是引起急性肝胰腺坏死病的主要致病因子。组织病理学显示,发生急性肝胰腺坏死病的病虾肝胰腺小管上皮细胞脱落,大量血细胞浸润其中[8]。此外,致病性副溶血弧菌还能感染三疣梭子蟹(Portunustrituberculatus)等甲壳类动物[9]。
迄今为止,研究发现被致病性副溶血弧菌感染的虾出现了不同死亡率。墨西哥株M1-1感染的虾呈现亚急性死亡,与其他2株泰国株3HP和5HP相比,死亡率较低[10],致病机理尚未明确。本实验室对江苏省不同地区暴发急性肝胰腺坏死病的养殖场调查后发现,发生此病的不同养殖对虾群体出现了急性和亚急性两种病程,分析认为,不同致病性副溶血弧菌菌株间可能存在毒力差异。因此,笔者通过攻毒试验验证不同致病性副溶血弧菌对凡纳滨对虾(Litopenaeusvannamei)的毒力强弱,并利用多位点序列分型技术对收集的菌株进行分型研究,为急性肝胰腺坏死病的积极防控提供实践基础。
1 材料与方法
1.1 试验材料
试验用急性肝胰腺坏死病致病性菌株分离源为2016—2017年江苏省发生急性肝胰腺坏死病的对虾样品(表1),按照SC/T 7103—2008《水生动物产地检疫采样技术规范》规定方法采集对虾样品。
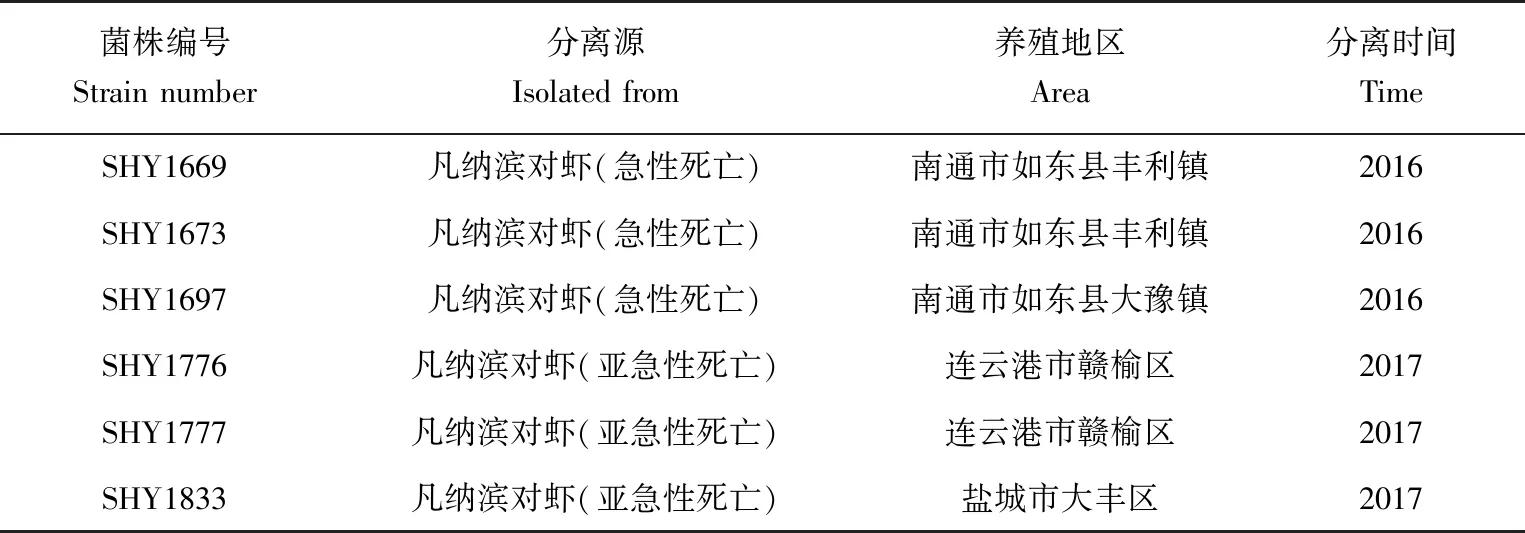
表1 致病性副溶血弧菌来源信息Tab.1 Information on pathogenic V. parahaemolyticus source
试验用凡纳滨对虾均取自南通市某养殖场,挑选健康、活跃、规格一致的凡纳滨对虾,体长(3.0±0.5) cm,体质量(2.79±0.50) g,未检出致病性副溶血弧菌特定病原。
1.2 试验设计
1.2.1 菌株培养与核酸提取
菌株接于硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基上,37 ℃培养20 h,挑取单菌落接种至LB固体培养基上继续37 ℃过夜培养。使用接种环挑取LB固体培养基单菌落于100 mL无菌双蒸水中,沸水煮浴10 min后,12 000 r/min离心(离心半径1 cm)5 min,取上清液为菌株DNA扩增模板。
1.2.2 菌株病原菌鉴定与确认
采用AP1、AP2上、下游引物进行PCR扩增,扩增引物序列见表2。其中AP1、AP2扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火1 min,70 ℃延伸1 min,30次循环;72 ℃延伸10 min。采用16S rRNA基因通用引物27 F/1492 R为上、下游引物,进行PCR扩增,引物序列见表2。扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,35次循环;72 ℃延伸10 min。分别取5 μL扩增产物用于2%琼脂糖凝胶电泳以便观察目标条带是否出现,余下产物16S rRNA送至生工生物工程(上海)股份有限公司测序,测序结果进行BLAST序列比对分析。
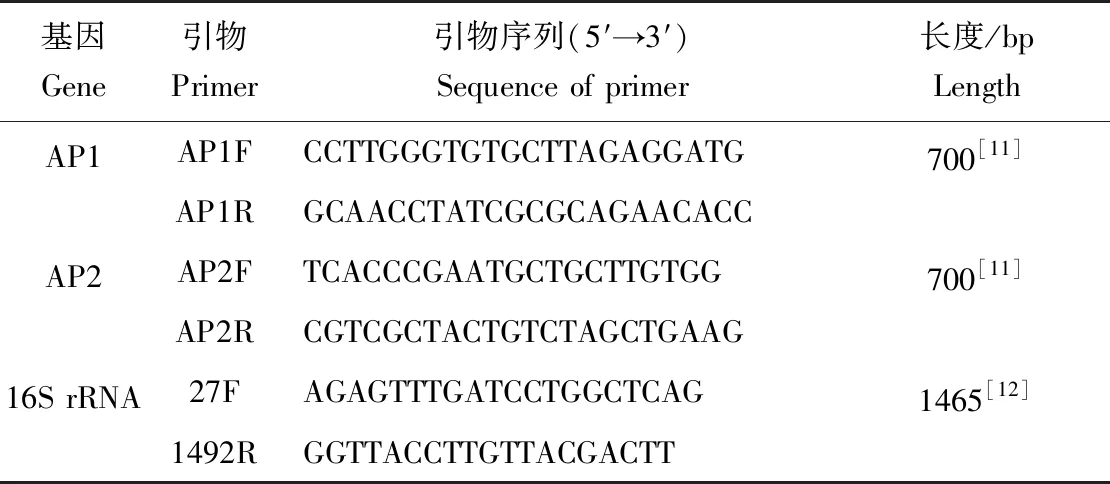
表2 PCR扩增片段及引物序列Tab.2 PCR amplification fragment and primer sequences
1.2.3 菌株攻毒回感试验
试验于50 L蓝色塑料水箱中进行,每个水箱放养凡纳滨对虾30尾,水量20 L,盐度6,水温24~26 ℃,正常充气,日投饵2次,暂养3 d后进行回感试验。为排除LB液体培养基对试验干扰,试验设置2个对照组,分别为海水对照组和添加LB液体培养基的海水对照组,对照组设置2个平行,处理组均设置3个平行。通过浸浴方式进行感染,致病性副溶血弧菌密度为1×107cfu/mL[13]。攻毒后,隔6 h捞出死亡虾,计数。死亡虾经液氮速冻处理后-80 ℃保存。
1.2.4 多位点序列分型目的基因的选择和引物合成
以1.2.1的上清液为菌株DNA扩增模板,通过PCR分别扩增致病性副溶血弧菌的recA、gyrB、dnaE、dtdS、pntA、pyrC和tnaA共7对管家基因,随后对PCR产物分别进行测序[14]。7对管家基因多位点序列分型引物合成参考PubMLST数据库(表3)。
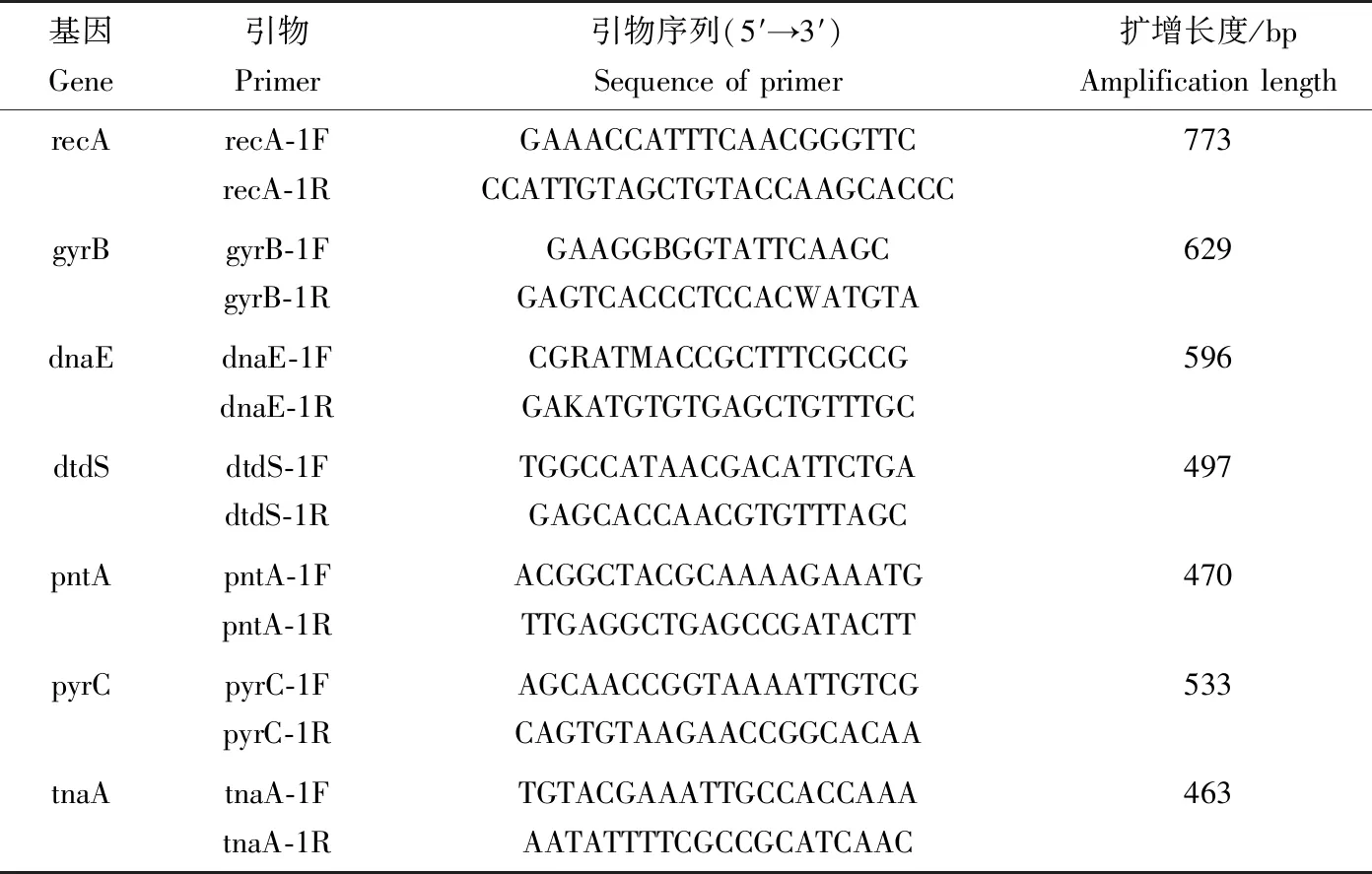
表3 致病性副溶血弧菌7对管家基因引物Tab.3 Seven primers of housekeeping genes in pathogenic V. parahaemolyticus
1.2.5 管家基因的扩增体系及条件
PCR反应体系(50 μL):2×Taq PCR Master Mix 25 μL,上、下游引物各2 μL,DNA模板2 μL,双蒸水19 μL。PCR反应条件:94 ℃预变性5 min;96 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min,30次循环;72 ℃延伸10 min。扩增产物进行2%琼脂糖凝胶电泳检测。
1.2.6 测序及数据分析
测序由生工生物工程(上海)股份有限公司完成,测序结果用BioEdit软件和DNAMAN软件处理后,上传至PubMLST副溶血弧菌数据库(https://pubmlst.org/vparahaemolyticus/)比对,获得各管家基因位点的等位基因数值,并形成相应的等位基因谱,提交多位点序列分型网站,确定致病性副溶血弧菌的序列型(ST)[15]。
1.2.7 多位点序列分型结果及序列型特征分析
在pubMLST副溶血弧菌数据库等位基因检索项(https://pubmlst.org/vparahaemolyticus/)中检索统计与新的序列型ST2355相近的序列型。统计比对各管家基因突变率[16],并与文献中报道的各个地区的致病性副溶血弧菌做进化关系分析。
1.2.8 系统发育分析
采用MEGA 7.0软件对不同致病性副溶血弧菌的序列型对应的7个管家基因拼接序列建立系统发育树,以此分析不同序列型菌株的相互关系[17]。为评估系统发育树中节点的稳定性,执行1000次重复自我检验。
1.3 数据处理
采用SPSS 26.0软件对试验数据进行单因素方差分析及LSD法多重比较,采用Excel绘制折线图。试验数据均用平均值±标准差表示。
2 结果与分析
2.1 菌株病原菌的鉴定结果
通过AP1、AP2引物扩增6株菌的AP1与AP2基因序列,琼脂糖凝胶电泳结果见图1。6株菌在700 bp大小处有明显条带,与目标条带大小一致。将测序结果与美国国家生物技术信息中心网站中已登记的16S rRNA基因序列进行比较分析,结果显示,6株菌与致病性副溶血弧菌的相似性最高,相似性均在99%以上,表明以上分离得到的6株菌均属于致病性副溶血弧菌。

图1 6株菌毒力基因PCR检测结果Fig.1 Dection of virulence genes of six strains by PCRa.AP1引物扩增;b.AP2引物扩增;M.DL1000 bp DNA标志物;1.SHY1669;2.SHY1673;3.SHY1697;4.SHY1776;5.SHY1777;6.SHY1833.a.amplification of primer AP1;b.amplification of primer AP2;M.DL100 DNA maker;1.SHY1669;2.SHY1673;3.SHY1697;4.SHY1776;5.SHY1777;6.SHY1833.
2.2 攻毒回感试验结果
攻毒6 h后,试验组凡纳滨对虾出现典型急性肝胰腺坏死病症状,如摄食缓慢、拖便、肝胰腺肿胀。死亡个体虾出现空肠空胃、肝胰腺颜色变淡,检测确认为致病性副溶血弧菌阳性。6株致病性副溶血弧菌感染凡纳滨对虾24 h后,对虾开始出现死亡现象(图2)。试验过程中,菌株SHY1673、SHY1697试验组致死速率较缓慢,攻毒96 h凡纳滨对虾总死亡率小于30%;反之,菌株SHY1669、SHY1776及SHY1777在12 h时致凡纳滨对虾出现死亡,表现出较高的死亡速率,24 h内对虾大量死亡,96 h死亡率达80%以上。对照组均未出现对虾死亡情况。将72 h内死亡率达到50%以上判定为急性死亡,未达到50%死亡率但出现死亡个体则判定为亚急性死亡。依据试验结果,将菌株SHY1673、SHY1697归类为亚急性菌株,将菌株SHY1669、SHY1776、SHY1777、SHY1833归类为急性菌株。
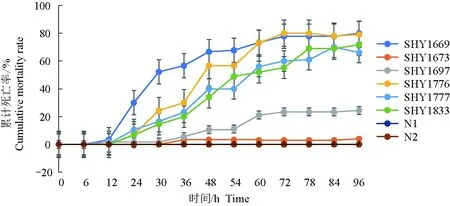
图2 不同致病性副溶血弧菌感染凡纳滨对虾96 h累计死亡率Fig.2 The 96-hour cumulative mortality of Pacific white shrimp L. vannamei infected by different VPAHPNDSN1.海水对照组;N2.添加LB液体培养基的海水对照组.N1.seawater control group;N2.seawater control with LB liquid medium.
2.3 致病性副溶血弧菌管家基因扩增结果
采用经过优化的退火温度分别扩增致病性副溶血弧菌7个管家基因位点,结果显示均可扩增(图3),电泳分析均出现目的条带,经检验各扩增产物核酸浓度及纯度符合测序要求,可用于多位点序列分型的后续分析研究。
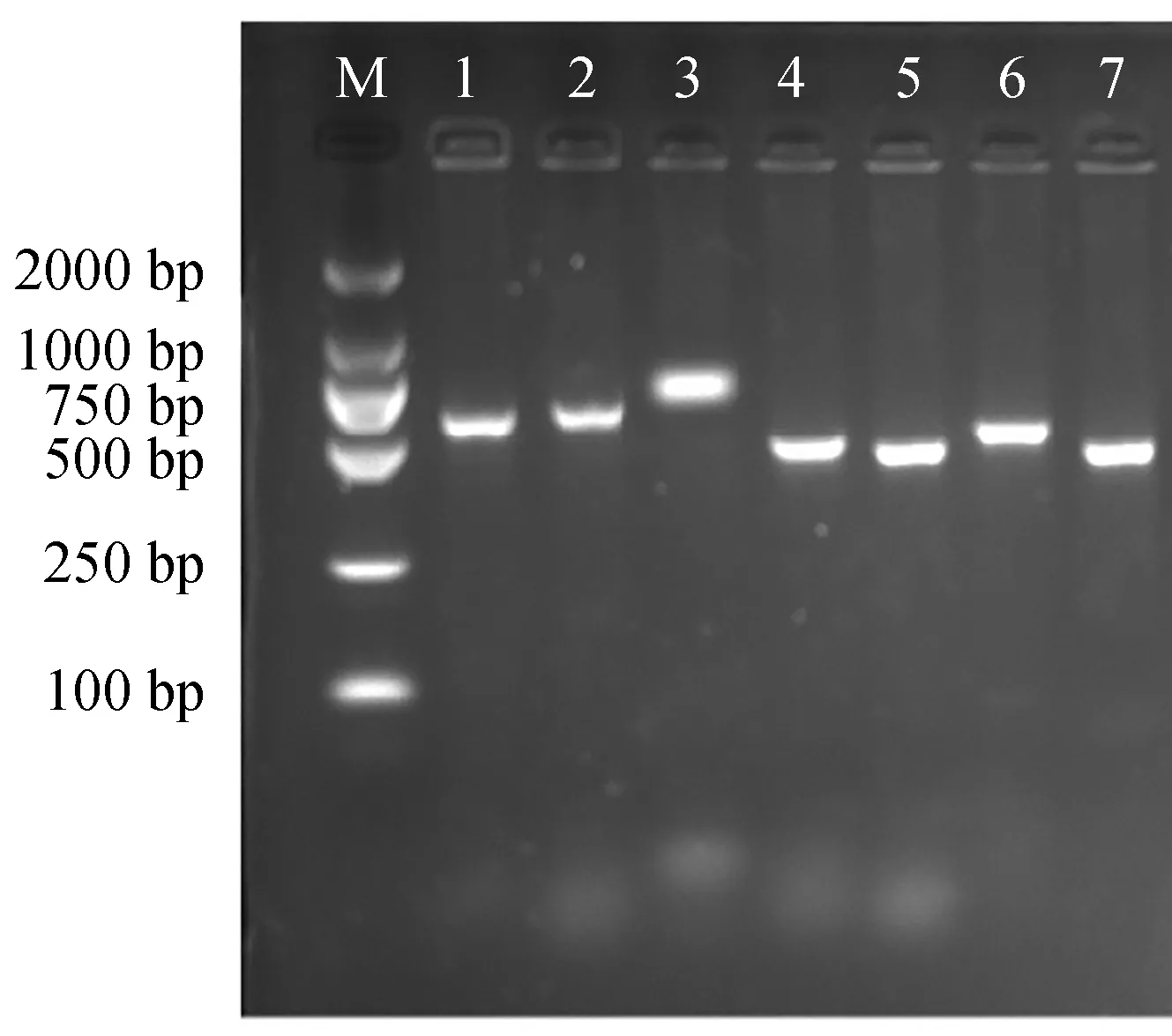
图3 致病性副溶血弧菌的MLST管家基因扩增结果Fig.3 MLST amplification results of pathogenic V. parahaemolyticusM.2000 bp DNA标志物;1.dnaE基因;2.gyrB基因;3.recA基因;4.dtdS基因;5.pntA基因.6:pyrC基因;7.tnaA基因.M.2000 bp Marker;1.dnaE gene;2.gyrB gene;3.recA gene;4.dtdS gene;5.pntA gene.6:pyrC gene;7.tnaA gene.
2.4 致病性副溶血弧菌多位点序列分型结果
将等位基因谱提交至pubMLST副溶血弧菌数据库,比对结果见表4。6株致病性副溶血弧菌中有5株菌为已知序列型,菌株SHY1833为新序列型,其各管家基因均为已知等位基因型,但按顺序拼接得到的等位基因组合在数据库中无已知的序列型,提交至数据库,现已将其收录,并确认新序列型ST2355。
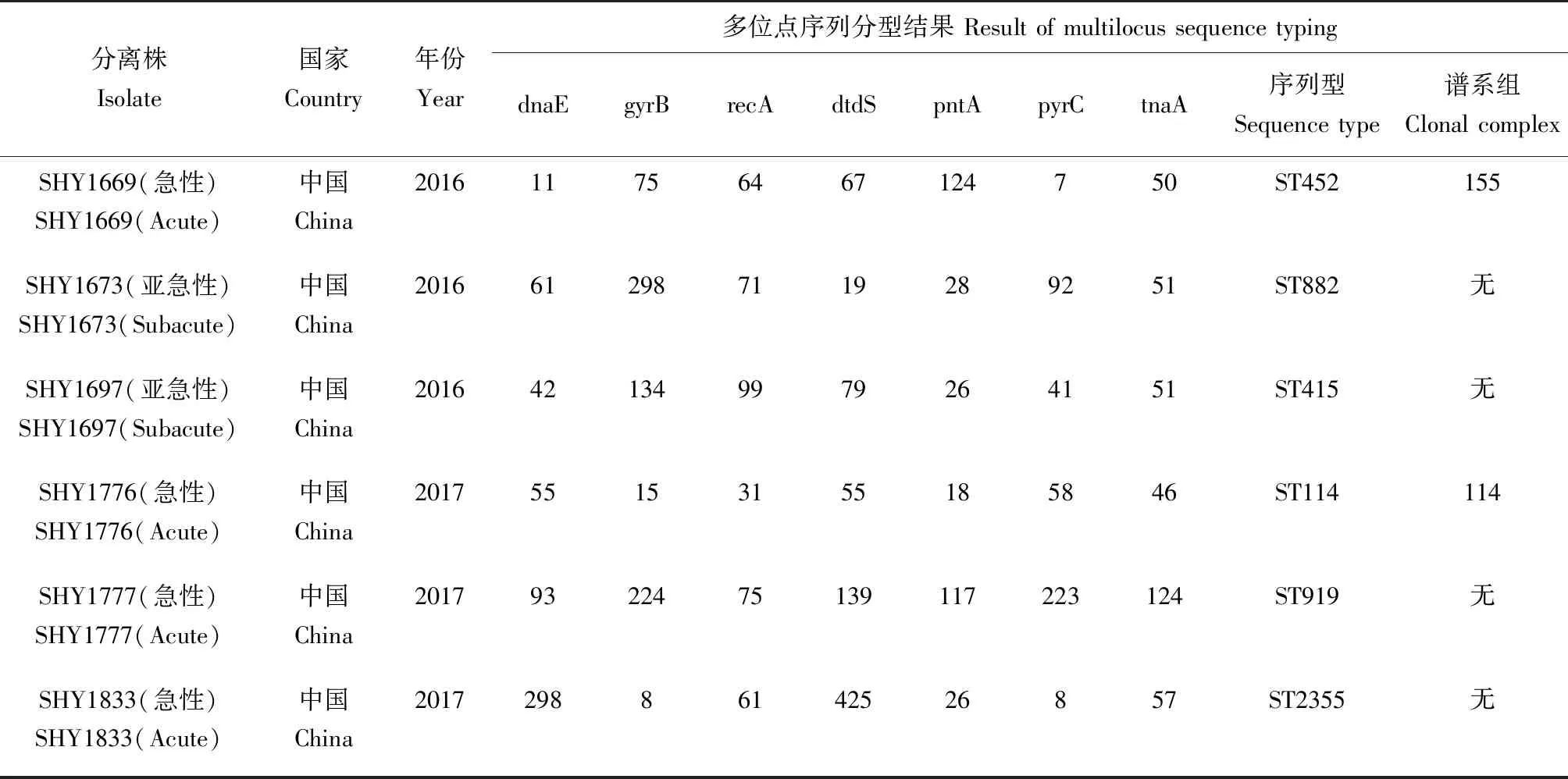
表4 6株致病性副溶血弧菌多位点序列分型结果Tab.4 Multilocus sequence typing(MLST) results of 6 strains of pathogenic V. parahaemolyticus
进一步研究分析新序列型ST2355的序列特异性,发现数据库中ST1743与ST2355相似度最高,仅与dnaE等位基因存在差异,且只有2个突变位点(表5),相似性高达99%。

表5 多位点新序列型ST2355等位基因突变位点信息(与ST1743比较)Tab.5 Genetic diversity at the seven loci examined of the new sequence type (comparied with ST1743)
将本试验6株致病性副溶血弧菌与文献中报道的各个地区的12株不同致病性副溶血弧菌用7个管家基因拼接序列生成进化树(图4)。结果显示,所选菌株均分离自凡纳滨对虾或土壤环境中,序列型分别为ST313、ST314、ST315、ST394、ST395、ST760、ST764、ST1394、ST1576。从进化关系可以发现,所选18株致病性副溶血弧菌序列型可分为3个类群(Ⅰ、Ⅱ和Ⅲ),其中有16株主要分布在Ⅰ和Ⅱ类群内。急性、亚急性2种序列型在3个类群中均有分布:亚急性序列型主要分布在中国、菲律宾等亚洲地区;急性菌株序列型则分布在美国、泰国、中国、菲律宾,分布范围由亚洲延伸至北美洲。
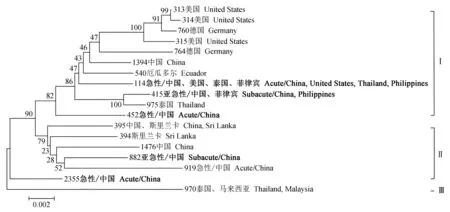
图4 多位点序列分型不同序列型进化关系Fig.4 The evolutionary relationship among the different sequence types加粗字体为本试验所用菌株序列型.Sequence type of the strain used in this study is shown in bold font.
3 讨 论
3.1 回感试验差异性分析
截至目前,已有许多致病性副溶血弧菌的序列及引起不同死亡率的研究被报道。Lai等[18]在2015年对致病性副溶血弧菌的致病机理进行研究时发现,泰国株(5HP)的毒力显著高于分离的越南株(M1-1、M2-36)。Phiwsaiya等[19]也报道了一株具有pVA1质粒,但致死率仅有50%的致病性副溶血弧菌。在本试验中,浸浴攻毒96 h后,菌株SHY1776致凡纳滨对虾死亡率可达100%,而菌株SHY1673死亡率低于5%,存在显著差异(P<0.05),由此表明,菌株存在急性致死型和亚急性致死型,也进一步验证了在中国各地的致病性副溶血弧菌中也存在不同毒力的现象。甄晓然等[20]发现,同一株拮抗菌对14株致病性副溶血弧菌的拮抗效果不同,这表明致病性副溶血弧菌株间差异明显。致病性副溶血弧菌通过水平基因转移重组,产生质粒编码的PirA、PirB毒力蛋白,获得毒力致病性[21]。对致病机制的深入研究发现,致病性副溶血弧菌(M2-36)菌株缺失pirB基因后不合成PirA及PirB毒素,也不具有致病性;致病性副溶血弧菌(M1-1)尽管具有pirA及pirB基因,也合成PirA及PirB毒素,但感染对虾后其基本定殖在胃中,很少定殖在肝胰腺中,其毒力引起的致死率也较低。Kumar等[10]对致病性副溶血弧菌M1-1菌株进行深入研究后发现,M1-1菌株在培养基中培养2~3周后,尽管其pVA1质粒还存在,但其pirA/B基因已经丢失,并通过基因组测序发现,M1-1菌株比典型的致病性副溶血弧菌(5HP)菌株多了一些额外的基因,包括DNA代谢、压力感应、噬菌体DNA复制蛋白等,但其毒力减弱的分子机制还需进一步探讨。笔者在此基础上进一步推测,致病性副溶血弧菌所表现出的广泛多样性可能归因于通过水平转移获得携带基因的质粒的能力。在同种养殖条件下,不同株型的菌株在毒力产生能力上存在强弱之分,可能是因为养殖范围流通,使得菌株在养殖条件中不断转化成为适应环境的亚急性毒株,而其中一些菌株进一步通过质粒转移,逐渐突变成生命力顽强、更适应环境的急性菌株。此因素导致急性菌株与亚急性菌株在不断地转化,而目前已有的淡水养虾模式与海水养虾模式促使不同盐度之间弧菌的交流转化,可能存在造成有毒种群的风险,对水产养殖和人类健康产生一定影响。
另外,相关研究发现,致病菌的毒力会因为质粒间插入成簇规律间隔短回文重复序列而减弱,因为质粒间插入成簇规律间隔短回文重复序列会形成原噬菌体等外源DNA侵入的防御屏障,从而降低其致病性[22-23]。Yu等[24]通过对不同毒力大小的致病性副溶血弧菌进行基因组分析,发现缺少质粒间插入成簇规律间隔短回文重复序列会为原噬菌体通过基因水平转移插入毒力基因从而增强致病性副溶血弧菌的毒力提供条件,以此推断原噬菌体和质粒间插入成簇规律间隔短回文重复序列之间关系可能与致病性副溶血弧菌的毒力变化有一定关系,质粒间插入成簇规律间隔短回文重复序列的存在可能使菌株的毒力降低或消失。
3.2 分型结果分析
目前致病性副溶血弧菌分布于多个国家,菌株材料收集范围较广,将不同地区菌株信息进行比较分析存在一定难度,并且通过全球范围的水产品贸易,副溶血弧菌污染和耐药情况严重[25-26]。多位点序列分型可以将多个管家基因序列拼接,并与不同地区的同种类型菌株流行病学以及亲缘进化关系分析比较,在分析生物学中具有一定的优越性。孙明玉等[16]对致病性副溶血弧菌进行多位点序列分型聚类分析,未发现全球不同地区的菌株在遗传亲缘关系上有明显的分类性;泰国学者基于多位点序列分型的研究表明,致病性副溶血弧菌分布较广,但非成群分布,具有遗传多样性[26],但在地域上未表现出明显的亲缘关系;Yu等[24]对34株致病性副溶血弧菌进行多位点序列分型分析,发现ST970作为优势菌株最为常见。本试验中,对6株菌以及不同地区致病性副溶血弧菌进行多位点序列分型研究,结果显示,江苏不同地区收集到的6株致病性副溶血弧菌中5株为已知序列型,分别为ST452、ST882、ST415、ST114、ST919,具有较高的分布多样性,且与ST970属于2个不同的集群,分布距离较远。笔者还发现,ST2355与数据库中ST1743同源性最高,相似性超过99%。由此推测这2株菌可能是来自于同一亚急性祖先或是由同一个亚急性菌株突变产生。本试验多位点序列分型聚类结果还显示,中国致病性副溶血弧菌的遗传多样性较高,多株与泰国、菲律宾、马来西亚等东南亚国家聚在一起,初步表明我国对虾养殖活动与东南亚国家交流紧密。Restrepo等[27]通过基因组测序也发现,南美洲致病性副溶血弧菌相比于墨西哥菌株,其基因相似性与东南亚菌株更高,由此也提出了急性肝胰腺坏死病防控的预警建议。
另外,由本试验多位点序列分型聚类分析结果可见,不同毒力的致病性副溶血弧菌并未从亲缘关系上显示出强弱差异聚类趋势。这一结果与Yu等[24]研究结果一致,在多位点序列分型分析中,致病性副溶血弧菌并未按毒力的强弱程度进行聚类,推测是因为致病性副溶血弧菌毒力强弱的差异是表现在质粒基因差异性上[18],而多位点序列分型系统发育树分析主要体现在菌株致病性副溶血弧菌不同地理种群的差异性上[24]。由此表明,多位点序列分型不能有效区分高度相关、不同血清型但遗传关系相近的菌株[28]。
另外,笔者仅选择江苏地区的6株致病性副溶血弧菌与其他各地的9株致病性副溶血弧菌进行比较,存在一定的局限性,不能完全反映不同类型致病性副溶血弧菌的遗传关系。在野外条件下引起菌株变异和差异的情况很多,如藻毒素的影响、环境的恶化均可导致对虾不同的死亡率,所以笔者选择在统一的试验条件下,验证凡纳滨对虾感染菌株后死亡率的差异性。本试验中的多位点序列分型提示,致病性副溶血弧菌并不是来自一个单一的遗传谱系,出现了1个新的序列型,丰富了数据库的信息。在今后的研究中,笔者会继续从比较基因组学、毒力因子和毒力蛋白等方面继续进行差异原因的探索,为致病性副溶血弧菌的致病机制研究提供思路,以便于后期急性肝胰腺坏死病的防控诊断。
4 结 论
本试验结果显示:不同致病性副溶血弧菌在感染凡纳滨对虾引起急性肝胰腺坏死病时,会由于毒力大小差异,出现急性与亚急性两种类型;多位点序列分型显示,毒力不同的菌株从亲缘关系上不能表现出强弱差异聚类趋势。
