超薄共形电极的设计及其在电生理信号采集的研究进展
2022-09-21陈敏祺宋忠乾李伟燕孔惠君
陈敏祺,宋忠乾,李伟燕,孔惠君,牛 利
(广州市传感材料与器件重点实验室,广州大学 分析科学技术研究中心 化学化工学院,广东 广州 510006)
柔性可穿戴电子设备的飞速发展,不断改变着人们的生活方式。可穿戴传感器作为可穿戴设备中的核心部件之一,可以实时监测与人体相关的物理与化学信号变化。超薄共形电极作为可穿戴传感模块中的组件之一,可以共形紧密贴附在人体皮肤、组织或器官表面,实现包括心电(Electrocardiology,ECG)、脑电(Electroencephalography,EEG)和肌电(Electromyography,EMG)等人体生理电信号的实时采集与监测(图1),为柔性可穿戴电子设备提供丰富的数据支撑,将促进健康管理、医学诊断和人机交互等领域的多样化发展[1-3]。

图1 超薄共形电极的材料组成、制备方法、关键参数及应用示意图Fig.1 Illustration of the ultra-thin conformal electrode,including the material,fabrication,key parameters and applications
1 超薄共形电极概述
超薄共形电极是一种超薄、轻质且可与人体皮肤和组织共形贴合以用于高保真度生命体征信号监测的电极装置。传统Ag/AgCl凝胶电极通过导电凝胶与皮肤的粘合可实现良好的接触,但导电凝胶会随着使用时间的延长逐渐失水,导致信号采集能力下降。同时,长期使用凝胶电极可能会引起皮肤的刺激排斥和过敏反应。超薄共形电极具有超薄、柔软、可拉伸、透水、透气和优异的生物相容性等优点,可实现对人体生物电信号的长期高保真实时监测,有望取代Ag/AgCl凝胶电极。一方面,超薄电极摆脱了传统凝胶电极所涉及的复杂电缆,在受试者佩戴过程中可以实现无感实时监测[4];另一方面,其轻薄特点以及与皮肤的高适形性,使超薄电极与皮肤间的界面阻抗(6~10 kΩ,1 Hz)与医用凝胶电极(100~1 000 kΩ,1 Hz)相当甚至更低,更易获得低噪声的电势信号,具有抗运动伪影、高灵敏度、长期稳定等优势。因此,超薄共形电极在运动监测、健康评估[5]、人机交互[6-8]等领域有着广泛的应用前景。同时,超薄共形电极还可实现对人体体温、脉搏、皮肤含水量等生理参数的监测[9-10],但本文重点集中在人体生物电信号的监测,对此将不再阐述。
2 超薄共形电极的组成与制备
超薄共形电极一般包括柔性聚合物和导电填料两个主要组成部分。柔性聚合物可以保证电极具有良好的可拉伸性和机械强度,同时提供与皮肤较强的相互作用力,以实现与皮肤的高保形性粘附;导电填料可以赋予电极良好的导电性,避免高阻抗带来电信号衰减。另外,采用牺牲基底或溶液转移的方法制备无衬底超薄共形电极逐渐得到了更多的关注,该方法更易实现纳米级超柔顺共形电极的制备。
2.1 材料组成
超薄共形电极根据其电极组成特点和状态分为纳米薄膜和离子凝胶两大类[11-12],两类电极均以柔性聚合物材料为基本组成,辅助其他填料添加赋予电极粘附、导电、自愈合等特点。其中聚合物组成包括非生物高分子聚合物,如聚乙烯醇(PVA)[13]、聚偏氟乙烯(PVDF)[14]、苯乙烯嵌段共聚物(SEBS)[15-16]、聚氨酯(PU)[11]、聚二甲基硅氧烷(PDMS)[17-19]、聚酰胺[20-21]等;或生物高分子聚合物,如:蚕丝[22-24]、丝蛋白[24-25]等。其中,由生物高分子聚合物为基础制成的柔性电极因有着更好的生物相容性,已成为超薄共形电极研究的一大热点。
超薄共形电极中的导电组成部分通常包括金属纳米填料、非金属纳米填料和导电聚合物三大类。金属纳米填料包含液态金属[26]、金(Au)[11]、银(Ag)[27]、铜(Cu)等纳米颗粒和纳米线;非金属纳米填料包括碳纳米管(CNTS)[28-29]、石墨烯[30-32]、二硫化钼(MoS2)[1]等;导电聚合物包括聚(3,4-乙烯二氧噻吩)(PEDOT)[33-34]、聚吡咯(PPy)[35]、聚苯胺(PANi)等。水凝胶类薄膜电极通常还会引入离子导体,如盐类电解质、离子液体等构成离子导电通路[36]。
无衬底超薄共形电极通常采用牺牲基底或溶液转移法直接在人体皮肤表面形成纳米级厚度的超薄共形电极,其材料组成包括石墨烯[37-38]、Au[39]和PEDOT[6]等具有优异导电性的材料。由于其独特的无衬底结构,电极可以实现对皮肤的超高共形贴附,通常表现出优异的透气性及信号高保真性的特点。
2.2 制备方法
超薄电极的制备方法通常涉及静电纺丝法[20-22]、旋涂法[17,40]、溶液涂膜法[26]等,采用辅助溅射蒸镀[11]、喷墨打印[41-42]、浸渍[22,26]等手段实现导电化。其中静电纺丝是制备具有优异透气性超薄电极的常用方法。由于该技术制得的薄膜轻薄透气、厚度可调,被广泛应用于超薄电极的制作[21-22,27,43-44]。东京大学Someya教授团队[43]是较早开展超薄电极研究的团队之一,2017年,其团队结合静电纺丝和真空蒸镀法制备了一种无炎症反应、透气、超轻且可拉伸的聚乙烯醇/金(PVA/Au)超薄电极,由于PVA充当Au转移过程中的牺牲层,所制备超薄电极属于无衬底电极,其电极厚度仅有几十纳米,实现了与皮肤的超高共形贴合,可用于超薄拉伸电路和人体表皮EMG信号的采集。基于此电极,实现了皮肤水气透过率的超高精度、连续和长期监测[13]。但由于PVA材料的可拉伸性较差(最大应变~20%),该团队[44]通过静电纺丝方法进一步制备了PU/PDMS/Au超薄电极,在保留电极较高透气性的同时,提高了电极的拉伸性、粘附性、耐水性和机械强度,实现了长达7 d的ECG信号的长期实时监测。静电纺丝法制备的电极较薄,与皮肤的保形性较高,可减少电极与皮肤之间的空气层,提高电极的抗伪影能力,降低界面阻抗,可作为制备超薄电极的首选方法。
相比而言,旋涂法或溶液涂膜法制得的超薄电极结构较为紧密,透气性较差,但制备过程简单,仪器设备要求较低,且更易实现复合与改性,赋予超薄电极的多功能化特点[45]。例如,为了克服拉伸性和导电性之间的固有矛盾,Kim等[46]采用溶液涂膜法实现了超长镀金-银纳米线与聚(苯乙烯-丁二烯)共聚物的复合,实现了最大72 600 S·cm-1和840%的导电性和拉伸率,所制备可拉伸电极同时具备高拉伸、高导电、优良的生物相容性和可植入等功能特点,可以共形贴附在人体皮肤和猪心脏表面实现EMG信号和ECG信号的高真度采集与监测。Ouyang等[47]利用溶液涂膜法将PEDOT∶PSS、水性聚氨酯和山梨糖醇复合成膜,所制备的超薄电极表现出较高的导电性(>390 S·cm-1)和高拉伸性(>43%),且与皮肤具有较强的粘附能力和较低的接触阻抗(82 kΩ·cm2@10 Hz),可实现在干、湿皮肤以及身体运动等复杂状况下ECG、EMG以及EEG等信号的高分辨监测。最近,Zhang等[48]提出了一种吹气鼓泡法结合银纳米线转移的溶液加工方法,制备了厚度仅有90 nm的超薄共形电极,并对皮肤表现出极高的粘附,实现了EMG信号的高保真采集,但该方法难以实现超薄电极的批量化制备。
虽然溶液涂膜法制备复合超薄电极较为有效,且易于实现多功能化,但难以实现厚度小于100 nm超薄电极的制备,相比之下,旋涂法可以弥补这一不足。2021年,北京师范大学刘楠教授团队[6]将旋涂法制备的PEDOT∶PSS超薄膜与单层化学气相沉积的Graphene复合,利用两者之间较强的π-π相互作用实现高效电荷转移,在保持极高电导率(4 142 S·cm-1)的前提下实现了厚度约为100 nm的超薄电极制备,在ECG和EMG信号的长期实时采集与监测方面表现出一定的优势。
另外,通过溅射蒸镀方法制作的超薄电极在进行数据监测过程中易发生开裂,抗拉伸性较差,通常采用预拉伸-后释放方法引入褶皱结构缓解拉伸过程中的应力[49]。而溶液浸渍法可以提高导电填料与聚合物之间的相互作用,缓解应力失稳现象[26]。2021年,Chen等[22]结合静电纺丝和浸渍PEDOT∶PSS溶液,制备了一种基于蚕丝蛋白的散热、透气且耐汗的超薄电极,其拉伸率超过250%。
具有高粘附性的离子导电凝胶因可以桥接离子传导的皮肤和电子传导的电极,成为近年研究的热点。Chen等[36]报告了一种带有LiCl(5%)的海藻酸盐-聚丙烯酰胺的导电水凝胶,其较强的粘附作用和低模量特点可实现在皮肤上的共形贴附,保证了较低的界面阻抗(20 kΩ@1 Hz),实现了无胶带固定情况下肌电信号的高信噪比采集。虽然离子凝胶可以实现对皮肤的高粘附,保证电极较好的抗伪影能力和较低的界面阻抗,但当前大多数离子凝胶的机械强度和韧性较低,难以实现超薄厚度电极的制备,同时电极的易失水、透气性差、水下粘附差等问题也限制了离子凝胶的发展[8,12,50]。
3 超薄电极当前存在的问题
3.1 界面粘附
由于人体表皮生物电势信号通常在毫伏级别,高质量生物电信号的采集除了要求超薄电极具备良好的拉伸性和导电性,电极与皮肤之间的粘附力也尤为重要。具有较强粘附力的超薄电极可消除电极与皮肤间的空气层,降低界面阻抗以增强表皮电势信号的传导,同时还可以防止电极滑动,提高电极的抗肌体干扰和抗运动伪影能力,保证采集信号的保真度。
超薄电极与皮肤之间的共形接触依赖于两者之间的界面能,由电极的弯曲能、皮肤的弹性能以及接触界面的粘附能三部分共同决定。其中,电极的弯曲能由电极的弹性模量决定,皮肤弹性能由皮肤纹理和模量决定,接触界面的粘附能依赖于电极与皮肤之间的界面相互作用[51-53]。因此,调控电极与皮肤间的范德华力、氢键相互作用和共价键接是实现超高界面粘附的关键。增加超薄电极与皮肤间的界面粘附最常用的两类手段是设计微观结构(如仿生结构[54-60]、机械连锁[11,61]等)和引入压敏粘合剂(曲拉通[17]、环糊精[45]、山梨糖醇[47]和蚕丝蛋白[62]等)。Stauffer等[63]受蚱蜢脚微结构的启发设计了一种具有较高自粘附能力的超薄电极(图2A),实现了在皮肤剧烈运动和变形下的高顺应性贴附,显著降低了噪声和运动伪影,在ECG和EEG信号的实时监测方面表现出极大的优势。相比微结构的设计,引入压敏粘合剂可实现更高的界面粘附作用。近期,Huang等[42]在超薄电极内部引入富含羟基和羧基的超分子结构,大大提升了PEDOT∶PSS电极的粘附力,在低噪声比EMG信号采集方面具有很高的应用价值。但电极与皮肤的分离可能会导致电极失效和角质层损伤,因此可逆粘附和分离可以保护受试者皮肤不受损伤,也有利于电极的多次重复利用[41,64-65]。虽然目前研究人员已经通过改变湿度[56]、温度[66]、光[67]、电压[68]等实现了电极粘附力的调控,但在保证电极较高拉伸性和离子导电性的同时,实现超薄电极的可逆粘附与分离仍存在一定的挑战,并将成为未来需重点研究的方向之一。
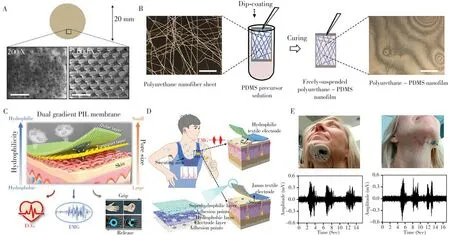
图2 受蚱蜢启发的微结构表面以改善电极对皮肤的粘附性(A)[63],PU/PDMS纳米膜的制备(B)[44],双梯度多层纳米纤维膜对汗液的定向运输(C)[69],多层全织物电极实现单向汗液渗透性(D)[70],超薄电极应用于头颈部肿瘤患者的吞咽治疗(E)[71]Fig.2 Soft electrode with grasshopper inspired microstructured surface for improved dry adhesion to the skin(A)[63],fabrication of free-standing PU/PDMS nanofilm(B)[44],dual-gradient multilayered nanofiber membrane for sweat conduction(C)[69],all-nanofiber-based Janus epidermal electrode with directional sweat permeability(D)[70],ultrathin electrode is applied to swallowing therapy for head and neck cancer patients(E)[71]
3.2 透气性
长时间使用过程中,由于超薄电极和皮肤的共形接触,两者间的水蒸气和汗液残留物需及时排出,以避免电极脱附或电极性能损伤,同时也避免给皮肤带来刺激。开发具有多孔透气特性的超薄电极是解决上述问题的最佳途径。其中静电纺丝是构建具有连续网络结构的多孔纳米纤维膜的高效且低成本方法,同时其纤维膜的纤维直径、孔隙率和电极厚度具有较好的可控性,因此近年来越来越多的研究者利用静电纺丝法构建高性能和多功能可透气超薄电极[20]。近期,Li等[22]利用静电纺丝法制备了一种基于蚕丝和PEDOT∶PSS的可拉伸、透气散热的超薄电极,显示了良好的耐汗特性。Wang等[44]利用静电纺丝得到的聚氨酯纤维膜蘸取PDMS前驱体溶液并固化,得到了仅有95 nm厚度的超薄、透气、隔水、自粘附且高拉伸强度的PU/PDMS纳米膜(图2B),表面沉积70 nm金后,可实现长达7 d的ECG信号的高信噪比监测。
聚合物的相分离过程也是一种简单、价廉且可批量化制备多孔透气薄膜的方法。近期,Xu等[15]通过相分离法制备了一种超柔软、防水、透气且可循环利用的多孔SEBS薄膜,薄膜厚度约100 μm,其透气率高达0.023 g·cm-2·h-1,结合喷印技术制备的SEBS/银纳米线电极可达100%拉伸率,可实现ECG、EMG信号和表皮含水量的监测。相比静电纺丝法,相分离法制备的超薄电极很难实现低于微米级的超薄透气膜,但其在制备电极的效率和批量化方面具有优势。
3.3 单向排汗
虽然通过改善电极透气性可有效地提高超薄电极的使用体验,但在人体高强度运动或炎热条件下的排汗很难仅通过排气实现水气的传导。因此,通过静电纺丝法调控薄膜的多孔结构和表面润湿性,利用毛细管驱动力实现汗液的单向运输,赋予超薄透气电极良好的水定向运输特性,可以很好地将汗液从皮肤表面导出,便于快速蒸发,是解决排汗问题的有效手段。近期,Yan等[69]通过对聚离子液体化学结构的设计和静电纺丝工艺参数的调节,制备了一种基于双梯度多层纳米纤维膜(图2C),利用润湿梯度和孔径梯度的设计,在保证透气性的同时,可实现对汗液的定向运输以及对连续跑步过程中心电信号的持续监测,相比传统凝胶电极表现出极高的稳定性和使用舒适度。Zhang等[70]受自然界非对称润湿性结构控制液体定向输送机制的启发,通过静电纺丝结合真空抽滤法制备了由银纳米线导电层、聚氨酯疏水层、聚丙烯腈超亲水层和医用胶粘附层组成的多层织物传感器(图2D),实现了单向汗液渗透性,并在ECG和EMG信号的连续监测方面表现出优异的性能。当前,关于超薄电极的排汗功能研究较少,研究人员应针对超薄电极的结构设计和单向排汗机制进行进一步的探究。
4 超薄电极在生命体征信号监测中的应用
皮肤作为最容易接触到的人体器官,可提供大量的电生理信号用于医学诊断、疾病治疗、健康监测和人机交互等研究领域,诸如ECG、EMG和EEG等电势信号。其中ECG信号是反应心脏健康的重要指标之一,被广泛应用于临床诊断。超薄共形电极因具有超薄、透气、共形粘附等特点,可以紧密贴附在皮肤表面建立低阻抗界面,实现ECG信号的高保真采集。虽然目前已经报道了大量的可用于ECG信号采集的超薄电极,并表现出比传统凝胶电极更优或者相当的性能,但针对较为恶劣环境下ECG信号的采集仍缺乏足够的研究,如超薄电极的耐汗及导汗性能、耐磨性、动态拉伸下的导电稳定性、可逆粘附与分离等。上述问题的攻克将进一步推动超薄电极的实际应用。
EMG信号广泛存在于人体皮肤表面,凡是涉及到皮下肌肉运动的人体表皮均可检测到EMG信号。研究表明,EMG信号可用于神经肌肉损伤识别、吞咽肌肉异常监测和运动员康复与训练等领域。例如,Rieger等[71]开发了一种用于头颈部癌症患者吞咽治疗的EMG信号监测贴片电极(图2E),具有与传统凝胶电极相当的EMG信号采集能力,在吞咽治疗方面表现出很好的潜力。相比于传统Ag/AgCl电极,超薄电极的超薄超轻特性可以最大化地削弱电极对肌肉正常运动的干扰,显著降低运动伪影的产生,并同时保持与Ag/AgCl电极相当乃至更高的保真度与信噪比。EMG信号还可以广泛应用于人机交互领域,并结合人工智能技术,实现对生命体征行为的准确判断和行为匹配的真实多模态数据融合应用[72]。
EEG信号源于大脑内神经元活动在头部产生的微小电位变化(核心频率0~50 Hz,幅值小于200 μV),超薄共形电极可以较高的时间分辨率(毫秒级精度)精确跟踪大脑内事件,所记录的EEG信号可用于癫痫诊断[73]、脑机接口和情绪监测[74]等领域。EEG信号监测的可靠性和稳定性是当前面临的最重要的问题。由于头皮毛发和头部分泌物的存在,导致电极与头皮之间的接触阻抗较大,因此,舒适、耐用且高保真采集EEG信号的难度较大。当前,采用导电凝胶辅助增强信号传导,或设计柱状结构增加表面粘附,是降低电极与头部接触阻抗的常用方法。Stauffer等[63]制备了一种带有表面柱状微结构的超柔软、自粘附电极,无需剃除毛发即可实现高保真ECG和EEG信号的采集和监测,电极与带有毛发的皮肤之间的粘附力高达0.1 N·cm-2,接触阻抗低至50 kΩ·cm2(10 Hz),电极良好的共形性和粘附性可显著降低噪音和运动伪影的产生,并实现和商用电极相当的监测结果。总的来说,EEG信号强度较弱、频率较低,易受肌电信号、眼电信号和环境噪音等干扰,降低电极厚度和界面接触阻抗,提高电极导电性和拉伸性,是提高EEG信号保真度和抗运动伪影能力的关键。
5 展望
本综述中,我们总结了超薄共形电极的组成,包括聚合物基质和导电填料的组成与分类;介绍了超薄共形电极的主要制备方法,其中静电纺丝法是制备超薄共形电极较为有效的方法之一;并针对当前超薄共形电极所面临的关键问题做了部分讨论;最后对超薄共形电极在ECG、EMG和EEG信号监测中的最新应用进展进行了总结。虽然近年来超薄共形电极得到了快速的发展,但仍然有一些亟待解决的问题尚未得到足够的重视:(1)当前急需建立一套统一的评价标准对超薄共形电极的信号保真度、透气性、舒适度等做出评价;(2)建立超薄电极的批量化和低成本制备方法,以消除手工制备电极重现性和批次均匀性引起的人为误差;(3)通过减薄或多孔结构设计虽实现了大量透气性优异的超薄电极制备,但具有自主单向排汗功能的超薄共形电极仍需引起更多的关注;(4)考虑到长期监测的稳定性和抗干扰能力,超薄电极的动态拉伸稳定性、导电性和耐磨性也尤为重要;(5)发展新材料和新结构实现超薄电极的动态可逆粘附与剥离,并深入探究其工作机制,可实现高保真信号的采集,同时消除电极去除过程中对患者带来的痛苦与不适。
