猕猴原代肾小球系膜细胞分离提取培养与鉴定
2022-09-21刘潇一张春梅蒋海峰董婷玉杨雪枝严尚学
刘潇一,张春梅,张 磊,许 振,魏 琦,蒋海峰,董婷玉,杨雪枝,严尚学,常 艳,魏 伟
作者单位:安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽医科大学类风湿关节炎研究中心,合肥 230032
有报道[1]认为,大约10.8%的人群会受到肾脏疾病的影响。肾脏疾病主要损害的病理部位是肾小球,肾小球是肾组织中主要起滤过作用的单位[2]。肾小球系膜细胞(glomerular mesangial cells,GMCs)过度增殖是肾小球疾病(如肾小球肾炎、狼疮性肾炎、糖尿病肾病等)的主要病理特征[3]。
肾小球主要由内皮细胞、上皮细胞和GMCs组成。原代肾组织中细胞提取培养中,与内皮细胞与上皮细胞相比,GMCs是较易生长的肾小球细胞,因为它们的生长需求最小,增殖能力较强[4]。目前已有对大鼠、小鼠、兔、人及猪的GMCs分离方法的报道[5],但尚未见对猕猴原代GMCs分离方法的报道。有文献[6]报道称,可以利用小鼠肾脏进行GMCs培养,但其操作步骤繁琐,利用50、100目和200目三道筛网才能筛出纯度较高的肾小球组织。肾小球位于肾脏肾皮质部位,小鼠肾皮质部位小,需要足够量的小鼠肾组织才能贴出GMCs[6]。人原代GMCs的提取方法也有报道[7],但是取材较为困难(一般为胎儿的肾)。与其他实验动物相比,猕猴与人类的遗传基因、生理病理状态以及免疫反应和新陈代谢具有高度的相似性,社会行为也与人类似,是基础研究和临床应用之间的一个理想转化模型[8]。该研究结合已有的文献报道,以及GMCs的生理特性和生长要求,成功建立了猕猴原代GMCs的分离培养方法,并对其进行鉴定和功能研究,为进一步研究提供实验材料与工具。
1 材料与方法
1.1 实验动物选取12只3~5岁普通级雄性实验猕猴,体质量为4~6 kg,饲养于安徽医科大学临床药理研究所实验动物中心。温度:20~26 ℃;日温差:≤4 ℃;相对湿度:40%~70%。昼夜交替满足猕猴作息时间,饲料、水不受限制,通过瓜果蔬菜补充营养,定时为猕猴播放音乐及视频,严格遵守动物福利标准。实验动物购自旌德县皖南猕猴驯养繁殖基地,生产许可证号:SCXK(皖)2020-001。实验动物使用许可证号:SYXK(皖)2020-001。该实验过程经安徽医科大学临床药理研究所动物伦理委员会批准(批准号:PT-2020-001)。
1.2 主要实验试剂及仪器注射用盐酸替来他明盐酸唑拉西泮(舒泰50)购自上海维克有限公司;DMEM基础培养基和胎牛血清(fatal bovine serum, FBS)购自以色列Biological Industries公司; 0.25%胰蛋白酶(含EDTA)购自上海碧云天生物技术研究所;小鼠肾小球系膜细胞系 SV40 MES 13 购自武汉普诺赛(Procell)生命科技有限公司;DAPI染色液和0.5%结晶紫水溶液购自北京索莱宝生物科技有限公司;CCK-8试剂盒购自合肥Biosharp公司;TNF-α购自美国 PeproTech公司;α-SMA(兔抗单克隆抗体,美国Proteintech公司)、GAPDH(兔抗单克隆抗体,美国Proteintech公司); Nephrin(兔多克隆抗体,美国affinity公司)抗体;Transwell小室均购自美国Corning公司;Ⅵ型胶原酶购自美国Sigma公司。DMi1型倒置生物显微镜:徕卡显微系统(上海)有限公司;BX 53正置显微镜:日本OLYMPUS公司;Image Xpress Micro4型高内涵细胞成像分析仪:美国Molecular Devcies公司; Infinite M1000 PRO多功能酶标仪:瑞士TECAN公司。
1.3 猕猴肾小球系膜细胞分离及培养方法
1.3.1动物麻醉与提取肾小球 猕猴在肌肉注射舒泰50(6 mg/kg)深度麻醉后,采取股动脉放血处死。猕猴处死后解剖,在超净台中沿腹部中线打开腹腔,无菌取出猕猴肾脏。利用预冷的无菌生理盐水冲洗肾脏,去除肾组织中的血块和血红细胞,之后转移至另一个空的无菌大皿中。利用无菌眼科剪、眼科镊去除多余肾组织(如:肾盂和肾包膜),利用无菌手术刀剖开肾脏,取一小块肾皮质。将肾皮质放入无菌1.5 ml离心管中,利用无菌眼科剪剪碎肾皮质,组织块大小≤1 mm3;加入少量混有高糖DMEM的无菌生理盐水混匀,利用巴氏吸管分次吸取剪碎的肾组织悬液放到重叠的2层纱网上(上100目,下200目),利用5 ml注射器轻碾组织块,同时利用无菌生理盐水冲洗,直至组织块发白;将200目纱网转移到无菌大皿中,巴氏吸管吸取无菌生理盐水反复反向冲洗200目纱网上碾碎的组织块,收集冲下的组织块,转移至无菌15 ml离心管中。离心管低速离心5 min ,转速1 000 r/min,之后弃去上清液,加入适量的无菌生理盐水构成肾小球悬液,整个过程尽量控制在2~3 h之内且保持无菌操作。
1.3.2肾小球活性鉴定及计数 取上述肾小球组织悬液90 μl,加入定量10 μl的0.4%台盼蓝溶液充分混匀,5 min后立即取10 μl滴于覆以盖玻片的细胞计数板上,5×物镜下观察提取肾小球的数量、染色情况及有无脱去布曼囊,并进行肾小球计数。肾小球活性及浓度的计算公式[9]如下

1.3.3猕猴肾小球消化与接种肾小球 在肾小球悬液中分别加入不同浓度的Ⅵ型胶原酶(0.1 mg/ml 及0.2 mg/ml)和0.02 mg/ml Dnasel,分别放入37 ℃恒温培养箱中震荡充分消化不同时间(10 min和15 min),之后加入2 ml 20%FBS-DMEM培养液终止消化,充分混匀。再迅速以1 000 r/min转速,离心5 min。尽量完全去除上清液,加入500 μl 20%FBS-DMEM培养液进行重悬。利用移液枪吸取适量重悬液至培养瓶中(尽量铺满瓶底),同时轻轻晃动培养瓶使上述肾小球悬液均匀铺在瓶底后,将培养瓶的培养面朝上放入37 ℃、5% CO2恒温培养箱中,使肾小球组织块贴壁,4~5 h后再缓慢将细胞瓶翻面培养,并加入3 ml 20%FBS-DMEM培养液,使完全培养液浸润,培养细胞。注意3 d内勿晃动培养瓶,4 d采用半定量换液,目的是给贴壁肾小球组织适应环境;8 d首次全量换液并观察肾小球细胞生长情况,之后每隔3 d全量换液1次,直至细胞铺满瓶底进行首次消化传代。
1.3.4原代系膜细胞的传代培养 往培养瓶内加入适量0.25%胰蛋白酶(含EDTA)消化肾小球细胞(细胞以铺满瓶底为度,同时消化液应提前在室温条件下进行复温),置于37 ℃、5% CO2恒温培养箱中1 min后拿出,在倒置显微镜下观察细胞形态变化(细胞回缩变圆)时加入完全培养液终止其消化。用移液枪吸取培养液,轻轻反复吹打培养瓶壁上的细胞,收集细胞悬液于15 ml离心管中,以 1 000 r/min 的转速,离心5 min,弃去上清液,使用适量20%FBS-DMEM培养液重悬细胞。细胞计数板计数后,稀释成适当密度接种于新的培养瓶中继续培养。
1.4 猕猴原代系膜细胞的鉴定
1.4.1形态学观察 倒置光学显微镜观察并拍照记录猕猴原代GMCs形态特征和生长状况。
1.4.2免疫荧光鉴定 选择状态良好的GMCs(3~4代)种在铺有无菌盖玻片的24孔板中培养24 h,利用SV40 MES 13(小鼠系膜细胞系)做阳性对照,细胞密度约为50%~60%。加入PBS轻轻晃动洗涤3 min×2 次;加入预冷的4%多聚甲醛固定20 min,弃去,加入PBS轻轻晃动洗涤3 min×3 次;加入含0.5%BSA的PBS,室温封闭30 min,弃去封闭液;分别在加入抗兔的Nephrin和α-SMA一抗(一抗浓度为1 ∶100),4 ℃过夜,加入PBS轻轻晃动洗涤3 min×3 次;加入594标记的山羊抗兔二抗(1 ∶1 000)37 ℃摇床赋予2 h,PBS轻轻晃动洗涤5 min ×3次;加入DAPI染细胞核,室温摇床赋予8 min,PBS轻轻晃动洗涤5 min×3 次;抠片加入抗荧光淬灭剂,封片;荧光显微镜下观察。
1.4.3Western blot法检测蛋白表达 利用配置好的细胞裂解液提取本方法获得的GMCs以及SV40 MES 13的蛋白,配制10%的SDS-PAGE凝胶,上样电泳,转移至PVDF膜上,利用TBST配制的5%脱脂牛奶37 ℃摇床封闭2 h,洗去牛奶后,用1 ∶1 000的兔抗Nephrin和α-SMA多克隆抗体或1 ∶1 000兔抗GAPDH抗体4 ℃ 条件下孵育过夜,1 ∶10 000兔二抗 37 ℃摇床孵育2 h,洗去二抗后,加入提前配置好的显影液曝光,采用 Image J图像分析软件进行条带灰度值分析,比较各组之间的差异。
1.5 猕猴肾小球原代系膜细胞功能实验
1.5.1高内涵检测细胞增殖能力 0.25%胰蛋白酶消化细胞,20%FBS-DMEM培养液终止消化,并制备细胞悬液。细胞计数,以0.4×104个细胞均匀铺入96孔板,利用10 ng/ml TNF-α刺激24 h[10]。96孔板用生理盐水洗3次,每次3 min。 4%多聚甲醛固定30 min,并用生理盐水清洗。加DAPI染核5~8 min,生理盐水洗3次,加入适量生理盐水,并用高内涵成像系统拍照。
1.5.2CCK-8法检测细胞生长活力 细胞制成悬液后,以0.4×104个/孔铺入96孔板,饥饿处理之后24 h加10 ng/ml TNF-α。37 ℃、5%CO2恒温培养箱培养24 h,生理盐水洗涤细胞。每孔加100 μl 20%FBS-DMEM完全培养液、10 μl CCK-8试剂继续培养1~2 h后,利用酶标仪检测其吸光度(λ=450 nm)。
1.5.3Transwell法检测猕猴肾小球系膜细胞迁移能力 细胞制成悬液后,接种于24孔板,10 ng/ml TNF-α刺激24 h。消化细胞并将Transwell小室放入24孔板,上室加细胞悬液,下室加20%FBS-DMEM培养液。37 ℃、5%CO2恒温培养箱中迁移24 h;将小室放入4%多聚甲醛固定30 min;并用生理盐水清洗;含0.1%结晶紫的生理盐水,染色20 min;显微镜下观察拍照,每组随机选取9个视野,统计迁移细胞数目。
1.5.4细胞划痕实验检测猕猴肾小球原代系膜细胞迁移能力 取原代GMCs,24 h后融合率达100%后,用200 μl无菌枪头垂直于孔板底部中央划痕,弃去培养基,无菌PBS冲洗脱落细胞,10 ng/ml TNF-α刺激24 h,分别于0、24 h进行拍照,观察划痕愈合情况,计算划痕愈合率。划痕愈合率(%)=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。

2 结果
2.1 肾小球提取条件的比较Ⅳ型胶原酶不同浓度和消化的时间,细胞最开始爬出的速度及状态不同。3 d观察0.1 mg/ml Ⅳ型胶原酶消化10 min的肾小球贴壁较多,0.2 mg/ml Ⅳ型胶原酶消化15 min的肾小球贴壁较少。7 d后0.2 mg/ml Ⅳ型胶原酶消化10 min,15 min和0.1 mg/ml Ⅳ型胶原酶消化15 min的肾小球细胞呈星形或纺锤形细胞数量较少,生长缓慢(图1A~D);0.1 mg/ml Ⅳ型胶原酶消化10 min的肾小球细胞生长状态较好(图1A)。21 d后0.2 mg/ml Ⅳ型胶原酶消化15 min的肾小球已无细胞生长,0.1 mg/ml Ⅳ型胶原酶消化15 min的肾小球细胞有较少的细胞生长;0.1 mg/ml Ⅳ型胶原酶消化10 min的肾小球细胞生长旺盛。
2.2 肾小球系膜细胞的形态学鉴定经2种不同目数的纱网提取的肾小球用0.4%台盼蓝染色后于倒置显微镜下观察显示: 大部分肾小球均脱去布曼囊(肾小球中有细胞散出,但又不破碎)且不着色(图2A)。原代培养的肾小球3 d后开始贴壁。应用倒置显微镜观察显示:培养7 d后肾小球周围已有细胞移出,肾小球组织周围出现梭形及星形或不规则形状的细胞,细胞胞体中央有一清晰的卵圆形核,胞质向外伸出数个长短不一的突起,处于指数增生期的细胞常呈放射状(图1A,图2B)。21~28 d原代GMCs生长进入旺盛时期,不少地方的细胞汇合,且呈堆叠状生长状态(图2C~D)。
2.3 原代肾小球系膜细胞Nephrin和α-SMA蛋白表达提取原代GMCs、SV40 MES 13蛋白,免疫荧光和Western blot法检测细胞中Nephrin(相对分子量为 135 ku)和α-SMA(相对分子量为 42 ku)蛋白表达。结果显示,分离培养得到的原代GMCs α-SMA表达水平与对照组SV40 MES 13 α-SMA蛋白表达相似;SV40 MES 13和原代GMCs均不表达Nephrin蛋白(图3、4) 。

图1 D7原代肾小球细胞生长情况 ×50

图2 原代GMCs形态学
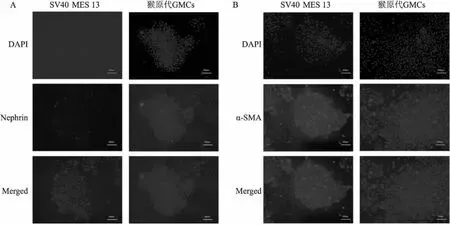
图3 免疫荧光鉴定原代GMCs Nephrin;α-SMA蛋白表达 ×50
2.4 猕猴肾小球原代系膜细胞功能实验
2.4.1TNF-α对猕猴原代肾小球系膜细胞活力以及增殖的影响 传代后的GMCs均匀铺在到96孔板中,10 ng/ml TNF-α刺激24 h后加CCK-8检测λ =450 nm处的吸光度,与Control组相比,10 ng/ml TNF-α刺激组GMCs活力提高(图5B)。图5C和5D显示高内涵成像系统法检测原代GMCs的增殖能力。根据细胞直径最小到最大范围和细胞荧光最弱到最强范围设定软件参数,减去背景荧光强度,统计分析所有细胞。导出的Excel表格,统计每组细胞的细胞总数,分析细胞的增殖能力。与Control组相比,原代GMCs经TNF-α刺激后增殖能力增强(图5A)。
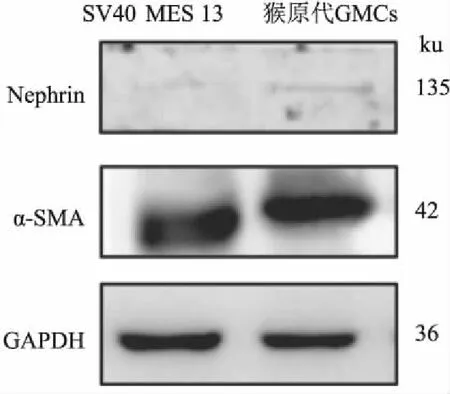
图4 Western blot法鉴定原代GMCs Nephrin、α-SMA蛋白表达
2.5 TNF-α对猕猴原代肾小球系膜细胞迁移的影响Transwell小室检测原代GMCs迁移功能,利用结晶紫染色后,利用显微镜进行拍照观察记录。与Control组相比,TNF-α刺激后原代GMCs迁移数量显著增多(图6A)。对细胞进行计数统计分析可知,TNF-α刺激后原代GMCs迁移能力增强(图6A)。划痕实验检测结果显示,与Control组相比,TNF-α刺激组划痕愈合率增加(图6B),且差异有统计学意义。
3 讨论
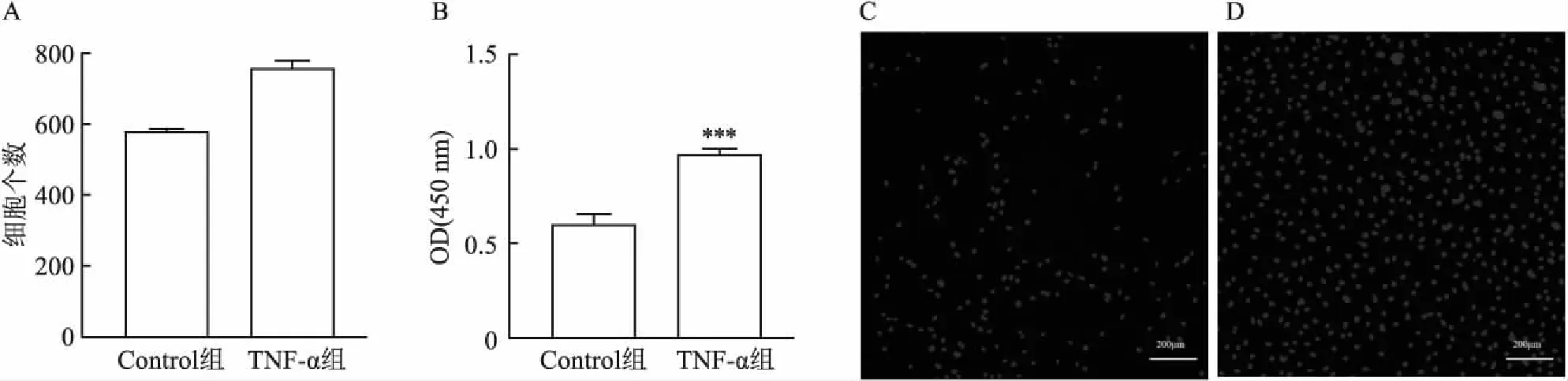
图5 TNF-α对原代GMCs活力以及增殖的影响 ×50
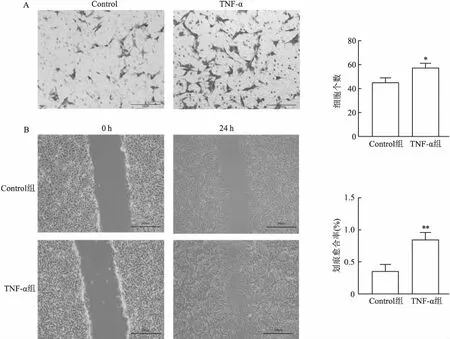
图6 TNF-α对猕猴原代肾小球系膜细胞迁移的影响 ×50
胶原酶法和组织黏附法是目前培养原代GMCs常用的方法。胶原酶消化法适用于大部分的实验动物,然而组织黏附法只适用于幼年时期的动物,这对实验动物的年龄有限制。本实验利用组织黏附法贴猕猴原代GMCs,但是未见原代GMCs移出,所以结合以上原因,采取了胶原酶消化法获取原代GMCs。由于不同动物适用的消化条件不同,所以课题组对比了几种不同的消化浓度和时间,根据肾小球活性、贴壁数量、GMCs贴出的时间和GMCs传代后的状态,选出最适合猕猴原代GMCs的消化条件(0.1 mg/ml Ⅳ型胶原酶消化10 min)。根据以上结果可知Ⅳ型胶原酶消化浓度过大或者消化时间过长会导致肾小球活性降低,不容易贴出细胞,贴出的细胞生长速度缓慢。0.1 mg/ml Ⅳ型胶原酶消化10 min细胞生长旺盛,这与已有文献报道的消化浓度相比较低,保持肾小球活性。之前小鼠提取肾小球过程中,需要利用三层筛网才能提取出较纯的肾小球,但是本实验采用了两层筛网便提取出较纯肾小球。在培养过程中,翻转培养瓶的时间很重要,一般为4~5 h,若时间过短肾小球则未贴壁;过长则导致肾小球组织活性丧失。首次换液时间一般为3~4 d且为半定量换液,之后每天观察GMCs的移出情况。由于适宜上皮细胞生长的血清浓度为5%,培养内皮细胞通常需要额外加生长因子,体外培养要求条件与GMCs不同,且原代上皮细胞和内皮细胞培养一般需要5~7 d传代,而GMCs则需要21~30 d[11]。经过以上条件筛选和形态学观察,以及利用免疫荧光和Western blot法检测特异性蛋白表达鉴定提取的GMCs符合实验要求。本次实验显示,系膜细胞传5~6代形态和功能便开始变化,不能支持后续实验。
TNF-α是一种促炎细胞因子,主要由多种免疫细胞(如活化的巨噬细胞、T淋巴细胞和自然杀伤细胞)产生[12],生理条件下,它具有显著的抗病毒效应,维持机体稳态的作用[13]。炎症状态下,TNF-α可以通过NF-κB通路导致GMCs功能发生改变[14]。所以本实验选用TNF-α为刺激剂,检测猕猴原代GMCs功能的变化,经刺激后原代GMCs的增殖和迁移能力显著增强,这提示猕猴原代GMCs提取成功。
GMCs是体外研究肾小球疾病的一个很好的实验模型,它存在于肾小球毛细血管袢中,能维持肾小球滤过屏障功能。人类疾病的动物模型对于了解疾病的发生发展机制和治疗干预方式至关重要。人类与非人类灵长类动物各个系统发育具有密切的联系,并且与它们的生理有许多相似之处,例如高度相似的免疫系统以及相似的组织结构等[15]。之前无论是小鼠、大鼠、兔等动物原代GMCs,都难以完整体现人原代GMCs的生理病理功能。本研究以猕猴为实验动物成功探索出非人灵长类动物GMCs的分离方法,并对GMCs的功能进行了鉴定,为研究肾脏相关疾病提供了一个体外细胞模型。
