HER-2阳性晚期胃癌免疫治疗临床分析*
2022-09-20张鑫鑫李帅吴晨侯新芳
张鑫鑫 李帅 吴晨 侯新芳
据全球2020年数据统计,胃癌发病率第5 位,癌症死亡第4 位,中国胃癌统计发病率及死亡率第2 位,其发病隐匿及早期缺乏特异性症状,约80%患者确诊时已是中晚期[1-2]。胃癌是一种异质性较强疾病,4 种分子亚型与其特定基因组及预后相关,约10%~22%胃癌组织中观察到HER-2 过表达。晚期胃癌一线标准治疗铂类联合氟嘧啶类生存期难以突破1年,HER-2 表达阳性者标准治疗联合曲妥珠单抗中位无进展生存期(median progression-free survival,mPFS)达6.7个月,整体生存期可延长至13.8 个月[3]。
多项临床前癌症模型显示免疫联合曲妥珠单抗具有一定协同效应[4-5],研究发现曲妥珠单抗通过机体免疫反应激活和刺激IFN-γ 分泌上调HER-2 过表达肿瘤细胞中的程序性细胞死亡配体1(programmed cell death-ligand 1,PD-L1)水平。最初在PANACEA 研究[6]中,曲妥珠单抗耐药晚期HER-2 阳性乳腺癌采用免疫联合曲妥珠单抗治疗中观察到持久临床效益及良好安全性。因此,免疫联合曲妥珠单抗及化疗在一线HER-2 阳性晚期胃癌中展开研究,本研究分析程序性死亡受体1(programmed cell death protein 1,PD-1)单抗联合曲妥珠单抗标准治疗在一线HER-2阳性晚期胃癌中临床疗效及不良反应,旨在为HER-2阳性晚期胃癌者早期治疗提供更多治疗经验。
1 材料与方法
1.1 临床资料
选取2019年6月至2021年6月河南省肿瘤医院HER-2 表达阳性晚期胃癌患者临床资料110 例,其中男性86 例,女性24 例,中位随访时间14.2 个月,中位年龄63 岁。纳入标准:1)年龄18~80 岁,性别不限;2)病理组织学确诊为腺癌;3)HER-2 阳性定义为免疫组织化学(immunohistochemistry,IHC) IHC3+或2+(原位杂交,ISH 阳性);4)美国东部肿瘤协作组(ECOG)评分 0~2 分,预计生存期≥3 个月;5)至少接受2 个周期联合治疗,且疗效可评估;6)治疗方案获得患者或家属知情同意并签字。排除标准:1)既往接受过免疫治疗;2)近6 个月出现过心脏不良病史,左室射血分数(left ventricular ejection fractions,LVEF)<40%;3)其他严重内脏器官功能障碍或严重免疫系统性疾病;4)合并其他原发性肿瘤。本研究通过本院伦理委员会批准(批号:2021-119-001)。
1.2 方法
1.2.1 治疗方法 根据治疗方法分为研究组(免疫组,48 例)和对照组(化疗组,62 例),比较两组临床疗效及安全性。研究组:静脉给予帕博利珠单抗2 mg/kg d1 或卡瑞利珠单抗200 mg d1 或信迪利单抗 200 mg d1 和曲妥珠单抗6 mg/kg d1 联合标准铂类治疗方案(XELOX/SOX/顺铂+白蛋白结合型紫杉醇)。对照组:曲妥珠单抗6 mg/kg d1 联合标准铂类治疗方案(XELOX/SOX/顺铂+紫杉烷类)。两组21 d为1 个周期,至少治疗2 个周期,疗效可评估,联合治疗4~6 个周期后根据患者情况行维持治疗或者进展后线治疗。
1.2.2 疗效评价及不良反应 采用RECIST 1.1 标准评估治疗效果,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。近期疗效采用客观缓解率(overall response rate,ORR)=(CR+PR)/总例数×100%、疾病控制率 (disease control rate,DCR)=(CR+PR+SD)/总例数×100% 。远期疗效采用PFS 定义为首次使用治疗方案直到确认PD、死亡或末次随访的时间。不良事件采用CTCAE 5.0标准进行不良反应评价分级。
1.2.3 随访 通过查阅住院系统、门诊系统、电话及短信等随访患者或家属了解病情及复查情况。随访日期截至2021年12月。
1.3 统计学分析
采用SPSS 26.0 软件进行统计学分析。计数资料采用χ2检验或Fisher 确切概率法,生存分析采用Kaplan-Meier 法和Log-rank 检验生存曲线比较,采用Cox 回归模型分析影响因素。GraphPad 8.0.2 软件绘制生存曲线。以P<0.05 为差异具有统计学意义。
2 结果
2.1 临床特征
研究组共48 例,其中IHC3+者29 例(60.4%),IHC2+(ISH 阳性)者19 例(39.6%),PD-L1 表达(CPS≥1%)22 例(45.8%);联合帕博利珠单抗13 例(27.1%),卡瑞利珠单抗17 例(35.4%),信迪利单抗18 例(37.5%);化疗方案选择XELOX 者30 例(62.5%),SOX 者12 例(25.0%),顺铂+白蛋白结合型紫杉醇者6 例(12.5%)。对照组共62 例,其中IHC3+者41 例(66.1%),IHC2+(ISH 阳性)者21 例(33.9%),PD-L1表达(CPS≥1%)25 例(40.3%);化疗方案选择XELOX者27 例(43.5%),SOX 者30 例(48.4%),顺铂+紫杉烷类者5 例(8.1%)(表1)。
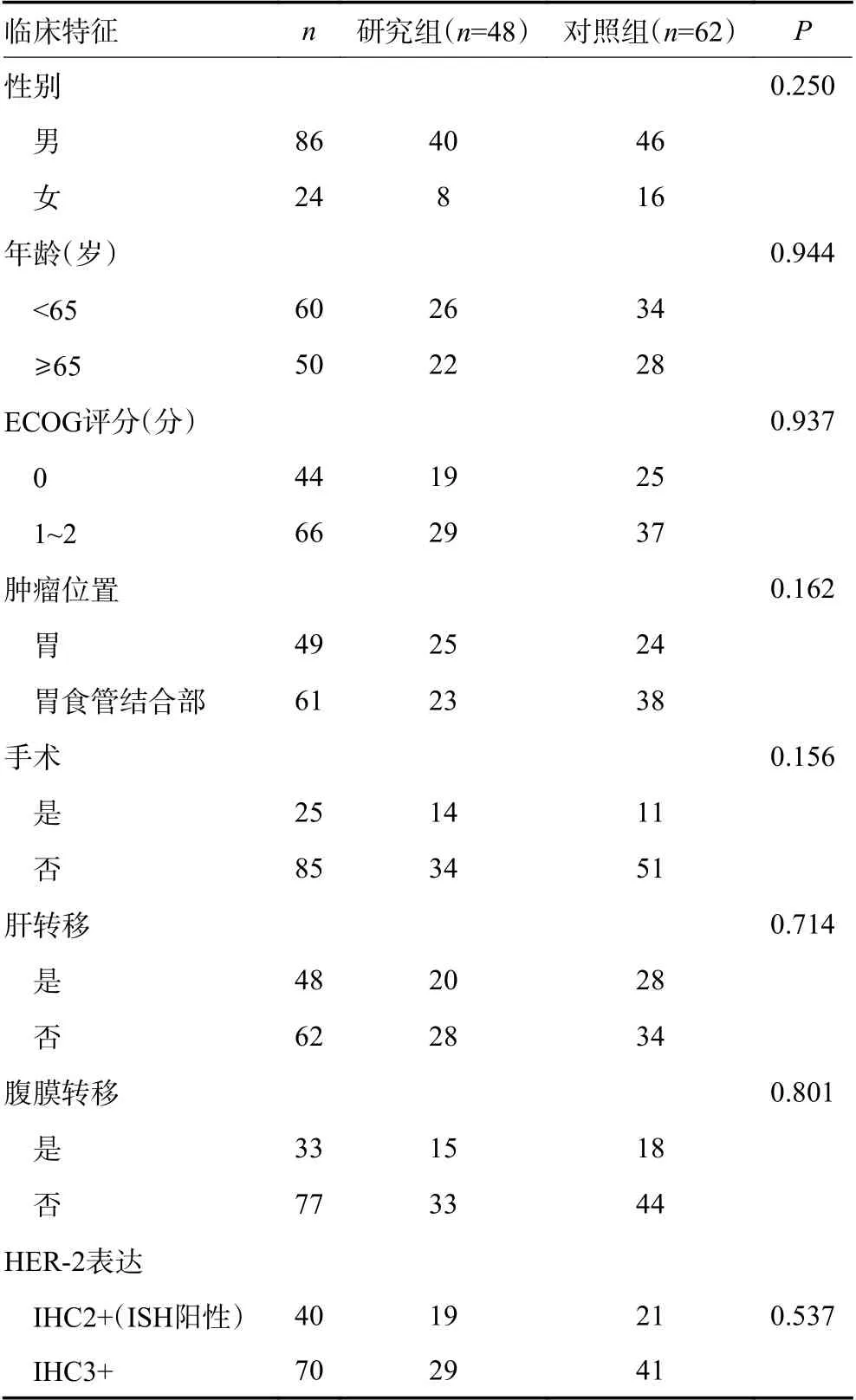
表1 两组患者基本临床特征 例
2.2 疗效评价
研究组中,CR 1 例(术后病理分级:TRG 0 级),PR 19 例,SD 22 例,PD 6 例。对照组中,无CR 者,PR 23 例,SD 27 例,PD 12 例。研究组和对照组ORR 分别为41.7% 和37.1%,DCR 分别为87.5%和80.6%。两组患者IHC3+中ORR 分别为44.8%和34.1%,DCR 分别为93.1% 和80.5%;IHC2+(ISH 阳性)中ORR 分别为36.8% 和42.9%,DCR 分别为78.9%和81.0%。研究组和对照组中,PD-L1 表达阳性者ORR 分别为31.8%和48.0%,DCR 分别为81.8%和96.0%。研究组中,采用帕博利珠单抗、卡瑞利珠单抗及信迪利单抗联合治疗患者的ORR 分别为76.9%、35.3%和22.2%,DCR 分别为100.0%、82.4%和83.3%。上述临床治疗缓解率之间对比分析差异均无统计学意义(均P>0.05)。
2.3 生存分析
研究组和对照组mPFS 分别为9.2 个月和6.8 个月(HR=0.624,95%CI:0.396~0.981;P=0.046,图1)。两组IHC3+的mPFS 分别为11.6 个月和6.8 个月(HR=0.461,95%CI:0.260~0.817;P=0.012,图2);IHC2+(ISH 阳性)mPFS 分别为7.8 个月和7.5 个月(P=0.863)。其中在研究组IHC3+和IHC2+(ISH 阳性)的mPFS 分别为11.6 个月和7.8 个月(HR=0.486,95%CI:0.215~1.097;P=0.051,图3)。PD-L1 表达阳性研究组和对照组的mPFS 分别为9.2 个月和6.7 个月(P=0.399),其中研究组PD-L1 表达阳性(CPS≥1%)和阴性(CPS<1%)的mPFS 分别为9.2 个月和4.9 个月(HR=0.370,95%CI: 0.104~1.322;P=0.033,图4)。研究组中,采用帕博利珠单抗、卡瑞利珠单抗及信迪利单抗的mPFS 分别为未达到、8.7 个月和6.3 个月(P=0.039)。研究组和对照组中1年无疾病进展率分别为22.9%和12.9%。
2.4 安全性
两组不良反应主要为1~2 级,研究组不良反应为83.3%,对照组为83.9%,仅甲状腺功能减退的差异具有统计学意义(P=0.034)。3~4 级不良事件发生均多见于骨髓功能抑制,发生率分别为33.3% 和38.7%,仅中性粒细胞减少差异具有统计学意义(P=0.046)。两组治疗过程中所有患者均未出现左室射血分数(left ventricular ejection fractions,LVEF)<50%,研 究组LVEF 为54%~72%,对照组为LVEF 为60%~74%。各项不良反应事件通过对症处理得到良好控制,所有患者未出现因严重不良反应导致相关死亡,见表2。

表2 研究组和对照组不良反应发生率比较 例
2.5 预后
单因素变量分析,ECOG 评分(P=0.006)、腹膜转移(P<0.001)及治疗方案(P=0.050)是影响患者PFS的因素,进一步Cox 多因素变量分析,结果仍显示ECOG 评 分(HR=2.002,95%CI:1.229~3.259;P=0.005)、腹膜转移(HR=3.763,95%CI:2.253~6.287;P<0.001)及治疗方案(HR=1.728,95%CI:1.076~2.774 ;P=0.024)是影响患者PFS 独立因素,见表3。

表3 HER-2 阳性晚期胃癌mPFS 单因素及多因素分析
3 讨论
胃癌的发生发展是由不同基因组改变及多条分子途径的异常激活,其中HER-2 过度表达在胃癌治疗中取得重大进展。HER-2 是ERBB2 编码的原癌基因,其阳性定义为IHC 检测为3+或2+同时ISH 检测阳性。目前分子靶向药物研究仅曲妥珠单抗一线联合治疗改善了晚期胃癌患者总体生存期[3],但进一步研究发现曲妥珠单抗在疾病进展后继续使用并未显示出明确临床获益。
由于免疫治疗在晚期胃癌中的临床疗效可观及持久获益,已被推荐一线及三线治疗,另多项研究显示抗HER-2 阳性药物联合免疫治疗存在一定协同抗肿瘤效应[4-5]。最初在晚期乳腺癌PANACEA 试验[6]中,帕博利珠单抗联合曲妥珠单抗治疗具有持久临床效益,提示PD-1 单抗联合曲妥珠单抗可能为HER-2 阳性晚期胃癌患者提供更有前景治疗方案。在回顾性ATTRACTION-2 研究[7]对既往是否采用曲妥珠单抗治疗分组,Tmab(+)和Tmab(-)的纳武利尤单抗治疗中ORR 分别为16.9% 和7.7%,中位总生存期分别为8.3 个月和4.8 个月。一项Ⅱ期研究[8]HER-2 阳性晚期胃癌一线帕博利珠单抗联合治疗显示ORR 为91%,mPFS 为13.0 个月,中位总生存期为27.2 个月。近期Keynote-811 研究[9]帕博利珠单抗组患者中PD-L1≥1%占84.8%,IHC3+占82.9%,微卫星高度不稳定者2 例,中期研究显示其CR 达11%,ORR 为74.4%,DCR 为96.2%,客观缓解率提高了22.7%,且两组3~5 级不良事件发生率相似,帕博利珠单抗组为57.1%,安慰剂组57.4%,其总生存期有待进一步随访。根据此结果美国食品药品监督管理局加速批准帕博利珠单抗联合曲妥珠单抗及化疗用于HER-2 阳性晚期胃癌一线治疗。本研究中PD-1 单抗联合治疗组PDL1 阳性占45.8%,IHC3+占60.4%,无微卫星高度不稳定者,结果显示CR 为2.1%,ORR 为41.7%,DCR为87.5%,mPFS 为9.2 个月,1年PFS 率为22.9%,此结果与临床试验结果相比较差,可能与本研究中样本量较少、PD-L1 阳性率、IHC3+占比、PD-1 单抗选择及化疗方案未能完全统一有关,但真实反映目前国内临床诊疗过程中临床医师和患者共同选择治疗的结果。
针对曲妥珠单抗治疗HER-2 阳性胃癌进展后一系列相关研究截至目前未达终点,可能与HER-2 蛋白在胃癌中表达异质性较强有关,其他靶点FGFR、MSI-H、MET 扩增、NTRK 及CLDN18.2 尚在临床研究中。一项Ⅰb2 期研究的[10]Margetuximab 联合帕博利珠单抗治疗既往接受过曲妥珠单抗的晚期胃癌HER-2 表达高低分析显示,IHC3+与IHC2+(ISH 阳性)中位ORR 分别为24.0%和0,DCR 分别为62.0%和24.0%。在GATSBY[11]和TyTAN[12]研究同样观察到HER-2 高表达临床数据疗效优于低表达者。本研究组IHC3+和IHC2+(ISH 阳性)表达中DCR 分别为89.7%和79.8%,mPFS 分别为11.6 个月和7.8 个月(P=0.051),同样提示HER-2 高表达者免疫治疗获益明显。此外,本研究组和对照组在IHC3+mPFS 分别为11.6 个月和6.8 个月(P=0.012),显示PD-1 单抗联合曲妥珠单抗标准治疗获益更明显。上述相关研究提示,HER-2 表达IHC3+者免疫联合治疗数据较IHC2+(ISH 阳性)表达者疗效更好,但相关研究总体样本量较少,尚需进一步扩大样本量探究。
晚期胃癌免疫治疗标志物选择中检测PD-L1 高表达、MSI-H 表达、EB 病毒感染、IHC3+、CLAUDIN18.2 表达或TMB 高负荷胃癌人群可能从免疫联合曲妥珠单抗治疗中获益更高。在HER-2 阳性乳腺癌中获得成功小分子药物拉帕替尼、大分子药物帕妥珠单抗及ADC 药物T-DM1 在胃癌研究中均遭遇失败,导致HER-2 阳性胃癌后线药物治疗选择有限。HER-2 阳性胃癌原发或转移部位中HER-2 表达的异质性是抗HER-2 治疗失败的一个关键原因,在抗HER-2治疗期间HER-2 过表达的丧失是导致抗HER-2 治疗失败的另一个原因,研究显示曲妥珠单抗耐药可能与HER-2 结构的改变、HER-2 下游信号效应器的失调(PIK3CA 突变或PTEN 失活)及HER-2 与其他膜受体之间相互作用相关,其中PI3K/AKT 信号通路是HER-2 的主要下游信号通路之一[13-14]。RC48-ADC 研究[15]显示mPFS 为4.1 个月,中位总生存期为7.6 个月,其中IHC3+和IHC2+中ORR 分别为26.6%和23.0%,观察到无论HER-2 表达高低均可从RC48-ADC 治疗中获益,因此维迪西妥单抗获批对至少接受过两种系统性治疗HER-2阳性晚期胃癌患者进行治疗。DS-8 201 研究[16]中,T-DXd 组和化疗组mPFS 分别为5.6 个月和3.5 个月,中位总生存期分别为12.5个月和8.4 个月,其中IHC3+和IHC2+中ORR 分别为58.0% 和29.0%,此研究为HER-2 阳性晚期胃癌二线治疗提供新型药物。未来可将这些药物进一步推进二线甚至一线进行探索,希望能为HER-2 阳性晚期胃癌患者提供更精准的全程管理治疗。
综上所述,免疫联合治疗在一线HER-2 阳性晚期胃癌中观察到良好疗效,但未来仍有许多问题需要解决,包括免疫治疗与曲妥珠单抗标准治疗剂量强度及治疗顺序问题、免疫联合治疗适宜人群、HER-2 高低表达时药物选择、一线耐药后线治疗选择等。本研究为小样本回顾性研究,可能存在一定选择性偏倚,研究组中位生存期尚未达到,尚需继续随访,研究中相关结果仍需大样本数据验证,期待大型临床数据研究为HER-2 阳性晚期胃癌免疫治疗进一步提供有力证据。
