《大学化学》教学中应用启发式教学的设计与实践*
2022-09-19钱建刚崔志民
钱建刚,崔志民,朱 英
(北京航空航天大学化学学院,北京 100191)
《大学化学》课程是我校实行大类招生后工科试验类(航空航天类)本科生进入大学后所接触到的一门基础课程,是工科大类非化学类专业学生系统学习化学知识的平台[1]。传统的直接讲授法能让学生直接和快速地掌握知识点,但缺点是学生处于被动接受知识的状态,学生主观能动性没有得到发挥,掌握的知识也易遗忘,而且学生的能力和思维没有得到锻炼。大学教育除了传授知识以外,更重要是的要培养学生的各种能力和科学思维,以满足现代社会对高层次、创新型人才的需求[2]。
早在两千多年前教育家孔子就提出“不愤不启,不悱不发”的启发式教学思想[3]。在启发式教学中,教师作为学习的启发者、引导者,学生是学习的主体[4]。从广义上来说,启发式教学不仅可以活跃课堂气氛,能够激发学生学习兴趣,充分调动学生学习思考的积极性和主动性,让学生在思考、辩论、总结过程中掌握知识、突破难点,也能够对教师教学活动的各个步骤进行启发,从而使“教”和“学”两个方面同时受益[5]。在教学过程中教师按照课本上的知识点对学生进行启发式的提问,引导学生进行讨论与思考,学会发现问题、分析问题和解决问题,在这个过程中学生加深了对理论知识的理解,也学会了从多个角度对问题进行分析,最终使问题得到解决[6-7]。
基于这样的教育理念,本文在《大学化学》教学过程中以反应的“标准摩尔焓变”的计算为实例,阐述启发式教学方法在《大学化学》教学中的应用。
1 启发式教学过程
“焓”是《大学化学》课程中化学热力学一个很重要的函数概念,由于没有明确的物理意义,因此对于刚进入大学的大学生来说理解它就比较困难。“焓”没有明确的物理意义,那为什么还要引进这个函数概念呢?引进这个“焓”函数概念,完全是为了实用的需要。有了“焓”这个函数概念,在处理热化学问题时就方便多了。虽然体系的“焓”的绝对值目前还无法知道,但在一定条件下可以从体系和环境之间的热量的传递来衡量体系的“焓”的变化值。即在只做体积功的条件下,体系在等压过程中所吸收的热量全部用于使“焓”增加[8]。如果能通过理论计算得到某“反应的焓变”,也就能从理论上知道该反应所吸收或放出的热量,而反应的热量变化值具有重要的实用价值。那么,某个反应的“焓变”又是如何来通过理论计算得到的呢?

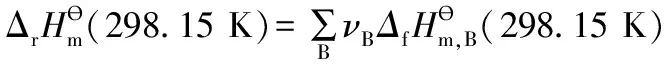
如果根据教材中这种写法来进行直接讲授的话,好处是简单,不足是学生无法真正理解为什么要定义 “标准摩尔生成焓”的概念?以及物质的“标准摩尔生成焓”和反应的“标准摩尔焓变”之间的关系。
作者在讲授这部分内容时,有别于教材的写法,而是采用了通过一个具体反应的实例来讲授反应的“标准摩尔焓变”的计算过程,在讲授反应的“标准摩尔焓变”计算过程中巧妙引入“标准摩尔生成焓”的概念,在整个讲授过程中,采用启发式教学,引导学生步步思考,最终学到为何要定义“标准摩尔生成焓”的概念?它的科学价值何在?物质的“标准摩尔生成焓”和反应的“标准摩尔焓变”之间的关系?
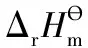
SO2(g)+NO2(g)=SO3(g)+NO(g)
为例来讲授如何来求解该反应在298.15 K时反应的“标准摩尔焓变”。
第一步启发学生进行大胆设想,如果反应物可以从理论上分解为由稳定单质组成 (之所以要规定分解产物为稳定单质,是因为这样能确保分解反应是惟一的;为什么要将反应物分解后面再来说明),如上述反应物之一的SO2(g) 可以从理论上分解为由稳定单质S (正交)和O2(g)组成
SO2(g)=S (正交)+O2(g)
(1)
同样,反应物之二的NO2(g) 也可从理论上分解为由稳定单质N2(g)和O2(g)组成
NO2(g)=1/2N2(g)+O2(g)
(2)
那么,经过这样的大胆设想后,原来的反应物[SO2(g)+NO2(g)]就可转化(分解)为由稳定单质[S (正交)+O2(g)+1/2N2(g)+O2(g)]组成。
第二步将由稳定单质组成的分解产物进行重新组合,由[S(正交)+O2(g)+1/2N2(g)+O2(g)]重新组合成[S (正交)+ 3/2O2(g)+1/2N2(g)+ 1/2O2(g)],此组合过程没有发生化学变化,也就没有焓变。
第三步再次启发学生进行大胆设想,如果由稳定单质组成的分解产物可以从理论上化合为生成物,如将分解产物[S(正交)+3/2O2(g)]化合为SO3(g),分解产物[1/2N2(g)+ 1/2O2(g)]化合为NO (g)。
S(正交)+3/2O2(g)=SO3(g)
(3)
1/2N2(g)+ 1/2O2(g)=NO(g)
(4)
那么,通过这样大胆设想后,原来由反应物直接反应为生成物的反应就可以转化为由反应物先分解为中间产物(即稳定单质),再由中间产物化合为生成物的过程。
反应中的反应物或生成物都涉及到化合物分解为单质反应或者单质化合的反应,把反应中所有的反应物或生成物“串”起来的是稳定单质。经过两步大胆设想后的结果是:千变万化的化学反应(数量是无限的)便可归结于同一类化合物分解为稳定单质或者稳定单质化合的化学反应(数量是有限的),把数量无限的化学反应转化为数量有限的化学反应的大胆设想过程是具有开创性意义的,这也就回答了为什么要将反应物分解为稳定单质的本质原因。
反应物[SO2(g)+NO2(g)]可看作为始态,生成物[SO3(g)+NO (g)]可看作为终态。由于焓H是状态函数,其数值大小仅与始、终态有关,而与变化的途径无关,因此经过前面三步的转化,结合盖斯定律,再假设所有反应均在标准条件和298.15 K时进行,则总反应[SO2(g)+NO2(g)=SO3(g)+NO(g)]的“标准摩尔焓变”就等于反应(1)、反应(2)、反应(3)和反应(4) 四个反应的“标准摩尔焓变”之和,即:
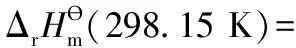
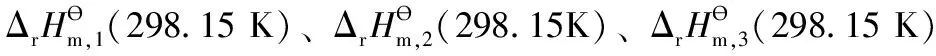
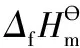

此时抛出关键性的第三个问题让学生进行思考:反应[SO2(g)+NO2(g)=SO3(g)+NO (g)]的“标准摩尔焓变”同样也可以直接通过实验测量来获得,启发学生思考为什么要费尽周折先通过测量反应(1)、反应(2)、反应(3)和反应(4)的四个反应的“标准摩尔焓变”然后再来计算呢?思考讨论后得到:
(1)有了“标准摩尔生成焓”的定义或概念,就可以用实验的方法来测量常见化合物(数量是有限)的“标准摩尔生成焓”值,如上述例子中SO2(g)、NO2(g)、SO3(g)和NO(g)四种物质的“标准摩尔生成焓”值。再根据常见化合物的“标准摩尔生成焓”值就可以计算出千千万万个不同化学反应(数量是无限)的“标准摩尔焓变”值,如上述例子中反应[SO2(g)+NO2(g)=SO3(g)+NO(g)]的“标准摩尔焓变”值。实验测得的常见化合物的“标准摩尔生成焓”值相当于用实验的方法制造出了“标准零件”,“标准摩尔生成焓”的定义相当于是制造“标准零件”的标准,而化学反应的“标准摩尔焓变”值相当于“产品”,不同的“产品”即不同化学反应的“标准摩尔焓变”值均可通过不同的“标准零件”即不同物质的“标准摩尔生成焓”组装而得,如“产品”即反应[SO2(g)+NO2(g)=SO3(g)+NO(g)]的“标准摩尔焓变”值可分别由四个不同的“标准零件”即SO2(g)的“标准摩尔生成焓”、NO2(g)的“标准摩尔生成焓”、SO3(g)的“标准摩尔生成焓”和NO(g)的“标准摩尔生成焓”组装而得。
(2)自然界时时刻刻都在发生千千万万个化学反应,而且这些反应的数量是无限的,没必要也不可能对每个反应的“标准摩尔焓变”值都通过实验方法来获得,更何况有些反应的“标准摩尔焓变”值是不可能直接通过实验方法测量而获得的,如反应C (石墨)+1/2O2(g)=CO(g)。
(3)定义“标准摩尔生成焓”的科学价值就在于根据这个定义(“标准”)可用实验的方法来测量 (“制造”) 获得少量的(有限的)常见化合物的“标准摩尔生成焓”(“标准零件”),再由这些“标准摩尔生成焓”(“标准零件”) 来计算 (“组装”) 获得大量的(无限的)化学反应的“标准摩尔焓变”(“产品”)。在此过程中,测量(“制造”) 得到常见化合物的“标准摩尔生成焓”(“标准零件”) 是首要任务,而要测量(“制造”) 常见化合物的“标准摩尔生成焓”(“标准零件”) 所依据的“标准摩尔生成焓”的定义(“标准”) 是关键。
(4)在“标准摩尔生成焓”的定义中,稳定单质通常是指为选定温度和标准压力时的最稳定单质。但有例外,磷虽然在热力学上最稳定单质是红磷,但在“标准摩尔生成焓”的定义中磷的稳定单质指的却是白磷。因此,为了严谨把例外也包括进来,在“标准摩尔生成焓”的定义中,将“稳定单质”改为“指定单质”。
(5)物质的“标准摩尔生成焓”和反应的“标准摩尔焓变”两者之间既有区别也有联系。区别是:“标准摩尔生成焓”指的是某种物质的;而“标准摩尔焓变”指的是某个反应的。联系是:特定反应的“标准摩尔焓变”就是特定反应生成物的“标准摩尔生成焓”,如在标准条件下反应[S(正交)+O2(g)=SO2(g)]的“标准摩尔焓变”就是该反应生成物SO2(g)的“标准摩尔生成焓”。
2 结 语
通过上述采用启发式教学方式对反应“标准摩尔焓变”计算过程的讲解,可以使学生从传统的被动接受知识到主动参与到课堂教学过程中。让学习由被动转变为主动,有助于激发学生学习的主观能动性和学习兴趣,有利于培养学生发现问题、分析问题和解决问题的能力,既能体现“授之以鱼”,又能体现“授之以渔”,有效提高了教学的质量和教学的效果。
