醉鱼草内生细菌ZJ1发酵条件优化及其抑菌物质稳定性分析
2022-09-19姚福田刘晓峰赵晓军周建波殷辉任璐
姚福田,刘晓峰,赵晓军,周建波,殷辉,任璐
(山西农业大学 植物保护学院,山西 太谷 030801)
植物内生细菌作为一类丰富的微生物资源,在经济作物种植、环境保护、生物医疗等方面都发挥着重要的作用。对植物内生菌的生物学效应[1]研究发现,部分植物内生菌可以定殖[2]在植物体内,对宿主植物的生长产生促进作用[3-4],还可以增强植物的抗逆能力,例如,可以促进植物的耐盐性[4]以及帮助植物修复环境中的有机物污染[5],此外,还可以抑制病原真菌[6-8]和细菌[9]侵染,从而防治各种植物病害[10-12]。
有研究表明,进行发酵条件优化可以显著提高发酵产物的抑菌活性,且发酵条件优化后可提高抑菌物质的产量。朱永明等[13]对1株贝莱斯芽孢杆菌T-70-1进行发酵条件优化后发现,菌株发酵产生抗菌肽的能力显著提高;贺玉广[14]对加利利链霉菌(Streptomyces galilaeus)AF1添加表面活性剂组合进行优化筛选,结果表明,发酵条件优化以后可以使该菌株发酵产物中的抑菌活性物质的生物合成量明显提高。发酵菌液的稳定性有利于工业化大量生产,施用于田间能达到良好的防治效果。丁芮涵等[15]对蓝莓溃疡病生防链霉菌CX3的发酵产物的稳定性进行研究,结果显示,发酵产物理化性质稳定,可投入大规模生产,开发成新的生物菌剂用来防治蓝莓溃疡病。
醉鱼草(Buddleja lindleyanaFortune)属马钱科多年生小灌木,主要成分包括黄酮类、三萜类、环烯醚萜苷类等,具有抗菌杀虫、抗氧化等生物活性[16]。试验前期从醉鱼草茎中筛选出的1株对多种植物病原真菌具有良好抑菌作用的内生细菌ZJ1。本研究以此菌株作为研究材料,优化其发酵条件,对其发酵物的稳定性进行研究,旨在为微生物源农药的研发和应用提供参考。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株植物内生细菌ZJ1从醉鱼草茎部组织分离获得,初步鉴定为贝莱斯芽孢杆菌(Bacillus velezensis);以核果链核盘菌(Monilinia laxa)为指示病菌,均由山西农业大学植物化学保护实验室保存。
1.1.2 供试培养基牛肉膏蛋白胨培养基(NA):蛋白胨10 g、牛肉膏3 g、NaCl 5 g、琼脂20 g、蒸馏水1 000 mL,pH值为7.0;马铃薯葡萄糖培养基(PDA):土豆200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL;BPY培养基:蛋白胨10 g、牛肉浸膏5 g、酵母粉5 g、葡萄糖5 g、NaCl 5 g、蒸馏水1 000 mL,pH值为7.0;CM培养基:蛋白胨10 g、牛肉浸膏5 g、蒸馏水1 000 mL,pH值为7.0;LB培养基:蛋白胨10 g、酵母粉5 g、NaCl 10 g、蒸馏水1 000 mL,pH值为7.0;NB培养基:蛋白胨10 g、牛肉膏3 g、NaCl 5 g、蒸馏水1 000 mL,pH值为7.0;NYBD培养基:酵母浸膏5 g、牛肉浸膏8 g、葡萄糖10 g、蒸馏水1 000 mL,pH值为7.0;YSP培养基:蛋白胨10 g、蔗糖20 g、酵母浸膏5 g、蒸馏水1 000 mL,pH值为7.0。
1.2 内生细菌ZJ1发酵条件优化
1.2.1 种子液的制备将保存的菌株ZJ1接种在NA平板上,26℃活化36 h,接种于LB培养液中,28℃、160 r/min振荡培养24 h,备用。
1.2.2 发酵滤液的制备将ZJ1种子液按1%(V/V)的接种量接入LB培养液中,160 r/min,28℃振荡72 h,4℃、12 000 r/min离心12 min,去除菌体,将所得上清液经0.22μm微孔滤膜过滤,即为菌株ZJ1发酵滤液。
1.2.3 发酵液菌体生长量测定测定发酵菌液在第24、48、72小时的OD600值,对照组为未加种子液的空白培养基,设置3个重复。
1.2.4 发酵滤液抑菌物质积累量测定采用生长速率法,以Monilinia laxa为指示菌,空白无菌培养基为对照,每个处理设置3个重复,采用十字交叉法测定病原菌直径,计算抑菌率。
1.2.5 菌株生长曲线测定将ZJ1发酵滤液按1%(V/V)的接种量接入300 mL LB培养基中,于160 r/min、28℃振荡培养72 h,期间每隔4 h测定一次OD600值,对照为不接菌的空白培养基,试验设置3个重复。
1.2.6 基础培养基筛选将ZJ1发酵滤液按1%(V/V)的接种量接入BPY、CM、LB、NB、NYBD和YSP等6种基础培养基内,160 r/min、28℃振荡培养72 h,在培养24、36、72 h测定菌体生长量以及发酵终止后最终抑菌物质积累量,对照为不接菌的空白培养基,试验设置3个重复。分析确定最佳营养培养基。
1.2.7 最佳碳源筛选将1.2.6筛选出的基础培养基分别用等量的乳糖、甘露醇、麦芽糖、蔗糖、可溶性淀粉、葡萄糖替换碳源,其他成分保持不变,按照1%的接种量将菌株ZJ1发酵滤液分别接种到上述培养液中,以1.2.6的方法确定最佳碳源。
1.2.8 最佳氮源筛选将1.2.6筛选出的基础培养基中的碳源以1.2.7中的最佳碳源固定,分别用牛肉膏+胰蛋白胨、蛋白胨、牛肉膏+酵母粉、蛋白胨+酵母粉、胰蛋白胨+酵母粉、牛肉膏+蛋白胨、牛肉膏+酵母粉+蛋白胨替换氮源,其他成分保持不变,按照1%的接种量将内生细菌ZJ1发酵滤液分别接种到上述培养基中,以1.2.6的方法确定最佳氮源。
1.2.9 最佳发酵温度筛选以1.2.6、1.2.7、1.2.8筛选出的最佳碳氮源配制培养基,按照1%的接种量将内生细菌ZJ1发酵滤液分别接种到培养基中,分别置于26、28、30、35℃下培养,以1.2.6的方法确定最佳发酵温度。
1.2.1 0发酵条件正交优化选用上述所筛选出的最佳基础培养基、碳源、氮源制备培养基,选择pH、装液量、接种量、转速、发酵时间5个因素设置正交试验表L16(45)(表1),温度为筛选出的最佳温度,每个处理设置3个重复。

表1 发酵条件正交试验设计Tab.1 Orthogonal experiment design of fermentation conditions
1.3 内生细菌ZJ1发酵液稳定性测定
1.3.1 热稳定性测定分别将10 mL制备好的ZJ1发酵滤液置于20、40、60、80、100、121℃水浴处理30 min,待冷却至室温后与PDA按1∶9(V/V)比例混匀制备平板,以Monilinia laxa为靶标菌采用生长速率法检测抑菌活性,对照组未经水浴处理,每个处理设置3个重复。
1.3.2 酸碱稳定性测定用HCl和NaOH标准溶液分别将10 mL制备好的ZJ1种子发酵液pH值调至1.0、3.0、5.0、7.0、9.0、11.0、13.0,室温静置2 h后调回自然pH值,以上述方法检测抑菌活性,对照组未经pH处理,每个处理设置3个重复。
1.3.3 紫外辐射稳定性测定分别取10 mL制备好的ZJ1发酵滤液置于7个试管中,垂直放置于18 W紫外灯下20 cm处照射12 h,每隔2 h及时取样制备平板检测抑菌活性,对照组未经紫外照射处理,每个处理设置3个重复。
1.3.4 对光的稳定性测定分别取10 mL制备好的ZJ1发酵滤液置于5个试管中,垂直放置于18 W白炽灯下20 cm照射48 h,分别在6、12、24、36、48 h及时取样制备平板检测抑菌活性,对照组未经白炽灯照射处理,每个处理设置3个重复。
1.3.5 贮存时间稳定性测定将10 mL制备好的ZJ1发酵滤液分别黑暗保存于4℃冰箱和室温,在7、15、30、60 d及时取样制备平板检测抑菌活性,以新鲜制备的发酵滤液作为对照,每个处理设置3个重复。
1.4 数据处理
利用Microsoft Excel 2010进行试验数据平均值和标准差分析并绘制图表;采用SPSS Statistics 26.0软件进行Duncan's新复极差法检验数据差异显著性(P<0.05)。
2 结果与分析
2.1 内生细菌ZJ1发酵条件优化
2.1.1 菌株ZJ1生长曲线的测定菌株ZJ1的生长曲线如图1所示,0~4 h菌株生长缓慢;4~28 h菌株增长极快;28~52 h菌株生长量稳定增加;52 h时细菌数量达到顶峰,之后菌株生长平稳。
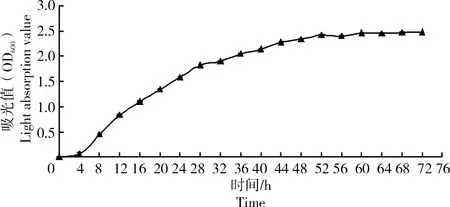
图1 菌株ZJ1生长曲线Fig.1 Growth curve of ZJ1 strain
2.1.2 菌株ZJ1基础培养基的筛选由图2可知,根据Duncan's新复极差法分析,菌株ZJ1在6种不同培养基中培养24 h菌体生长量(OD600)在NYBD中显著高于其他培养基(P<0.05),48 h在YSP中菌体生长量显著高于其他培养基(P<0.05),72 h后,菌体生长量(OD600)由大到小依次为LB(2.18)>YSP(2.13)>BPY(2.11)>CM(2.09)>NYBD(1.99)>NB(1.89),LB培养基菌体生长量显著高于其他培养基(P<0.05)。72 h后测得菌株ZJ1对Monilinia laxa的抑菌率从大到小依次为NYB(84.02%)>YSP(83.46%)>BPY(81.21%)>NB(74.99%)>LB(67.82%)>CM(63%),在NYBD培养基中的发酵滤液抑菌率显著高于CM培养基、LB培养基、NB培养基和BPY培养基(P<0.05),但与YSP培养基无显著性差异(P>0.05)。综上,结合72 h后菌体生长量及抑菌活性,选定YSP培养基为菌株ZJ1的最佳基础培养基。

图2 不同基础培养基对菌株ZJ1菌体生长量及发酵液抑菌活性的影响Fig.2 Effects of different basic culture medium on bacteria growth and bacteriostatic activity of fermentation broth of ZJ1 strain
2.1.3 菌株ZJ1最佳碳源的筛选由图3可知,菌株ZJ1在不同碳源下培养24 h后,在以蔗糖为碳源的培养基中生长量显著高于其他碳源(P<0.05),培养48、72 h后,在以麦芽糖为碳源的菌体生长量显著高于其他碳源(P<0.05),72 h后菌体生长量由大到小依次为麦芽糖(2.54)>乳糖(2.51)>果糖(2.38)>蔗糖(2.35)>甘露醇(2.30)>葡萄糖(2.28)>可溶性淀粉(1.89),表明菌株在以麦芽糖为碳源的培养基中生长最好,其次是乳糖(P<0.05)。菌株代谢产物对Monilinia laxa的抑菌活性由大到小依次为乳糖(89.80%)>可溶性淀粉(88.32%)>甘露醇(88.3%)>葡萄糖(88.24%)>麦芽糖(87.56%)>果糖(87.35%)>蔗糖(85.43%),表明以乳糖为碳源的发酵滤液的抑菌率显著高于其他碳源(P<0.05)。综上,选定乳糖作为最佳碳源。
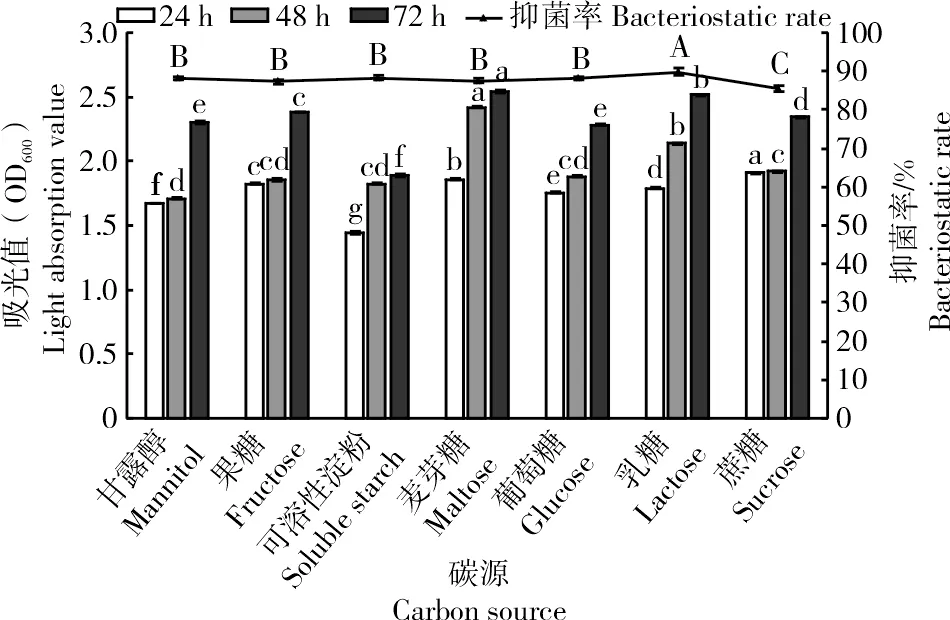
图3 不同碳源培养基对菌株ZJ1菌体生长量及发酵液抑菌活性的影响Fig.3 Effects of different carbon source culture medium on bacteria growth and bacteriostatic activity of fermentation broth of ZJ1 strain
2.1.4 菌株ZJ1最佳氮源的筛选菌株ZJ1在不同氮源条件下培养24、48 h后,菌体生长量在牛肉膏+胰蛋白胨中显著高于其他氮源(P<0.05),72 h后菌体生长量由大到小依次为牛肉膏+酵母粉+蛋白胨(2.56)>牛肉膏+胰蛋白胨(2.55)>蛋白胨(2.52)>牛肉膏+蛋白胨(2.50)>蛋白胨+酵母粉(2.48)>胰蛋白胨+酵母粉(2.42)>牛肉膏+酵母粉(2.31),在以牛肉膏+酵母粉+蛋白胨混配为氮源时显著高于其他氮源(P<0.05)。代谢产物对Monilinia laxa抑菌率由大到小依次为牛肉膏+蛋白胨(90.73%)>胰蛋白胨+酵母粉(88.83%)>牛肉膏+酵母粉+蛋白胨(88.79%)>蛋白胨(88.54%)>牛肉膏+酵母粉(86.57%)>蛋白胨+酵母粉(86.53%)>牛肉膏+胰蛋白胨(84.44%),以牛肉膏+蛋白胨混配为氮源的发酵滤液的抑菌率显著高于其他培养基(P<0.05),以胰蛋白胨+酵母粉、牛肉膏+酵母粉+蛋白胨和蛋白胨为氮源的发酵滤液的抑菌率之间无显著差异(P>0.05)(图4)。综上,选定牛肉膏+酵母粉+蛋白胨为最佳氮源。
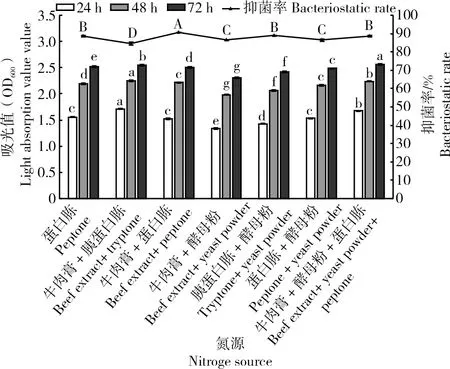
图4 不同氮源培养基对菌株ZJ1菌体生长量及发酵液抑菌活性的影响Fig.4 Effects of different nitrogen source culture medium on bacteria growth and bacteriostatic activity of fermentation broth of ZJ1 strain
2.1.5 菌株ZJ1最佳发酵温度的筛选菌株ZJ1在不同温度下培养24、48、72 h后菌体生长量在30℃时都显著高于其他温度(P<0.05),72 h后,菌体生长量由大到小依次为30℃(2.56)>35℃(2.14)>28℃(2.08)>26℃(1.95)。菌株对Monilinia laxa抑菌率由大到小依次为28℃(92.71%)>30℃(79.09%)>26℃(73.70%)>35℃(72.46%),发酵滤液的抑菌率在温度为28℃时显著高于其他温度(P<0.05)。由图5可知,在同一温度下,不同时间发酵过程中菌株ZJ1随着时间延长菌体生长量持续增加;同一时间不同温度下,菌株ZJ1随着温度的增加菌体生长量有明显不同。综上分析,28~30℃为菌株ZJ1的最佳发酵温度。

图5 不同发酵温度对菌株ZJ1菌体生长量及发酵液抑菌活性的影响Fig.5 Effects of different fermentation temperature on bacteria growth and bacteriostatic activity of fermentation broth of ZJ1 strain
2.1.6 菌株ZJ1发酵条件的优化由表2极差分析可知,所选因素对ZJ1生长量(OD600)的影响程度大小依次为pH(A)>接种量(C)>转速(D)>发酵时间(E)>装液量(B),最优水平组合为A3B1C1D4E3,即内生细菌ZJ1最佳培养条件为pH值3.0、装液量100 mL/500 mL、接种量1%、转速190 r/min、发酵时间72 h。
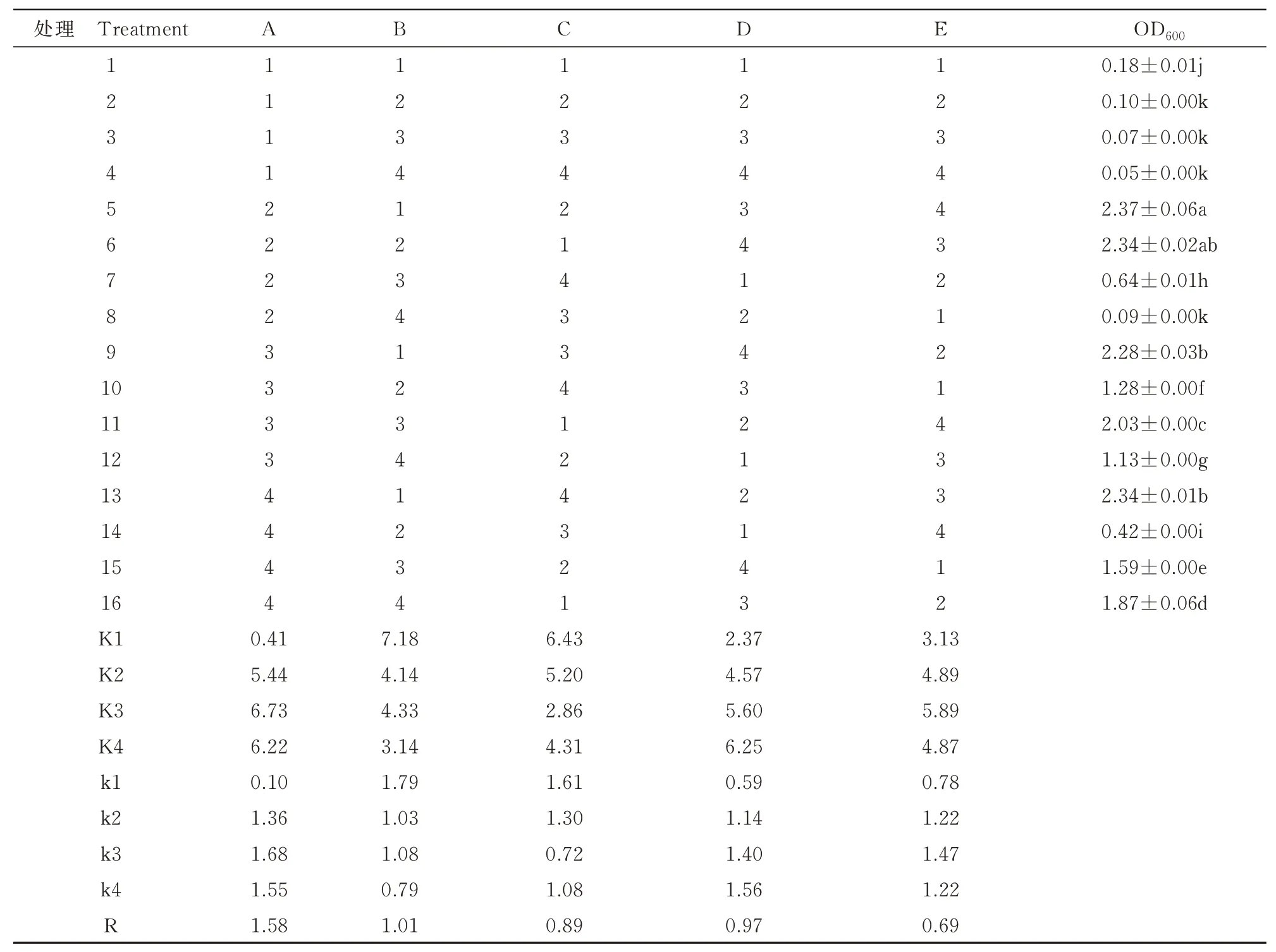
表2 菌株ZJ1发酵条件优化正交试验分析(OD600)Tab.2 Orthogonal experiment analysis of optimization of fermentation conditions of ZJ1 strain
表3所选因素对Monilinia laxa的抑制率影响程度大小依次为pH(A)>装液量(B)>发酵时间(E)>接种量(C)>转速(D),最优水平组合为A4B1C1D1E4,即内生细菌ZJ1最佳培养条件为pH值9.0、装液量100 mL/500 mL、接种量1%、转速100 r/min、发酵时间96 h。

表3 菌株ZJ1发酵条件优化正交试验分析(抑菌率)Tab.3 Orthogonal experiment analysis of optimization of fermentation conditions of ZJ1 strain(Bacteriostatic rate)
综合方差分析和成本分析,选择pH 7.0,装液量100 mL/500 mL,接种量1%,转速190 r/min,发酵时间72 h为正交试验优化后菌株ZJ1的最佳发酵条件。
2.2 内生细菌ZJ1发酵液稳定性测定
2.2.1 热稳定性测定菌株ZJ1发酵液经6个不同温度处理30 min后对Monilinia laxa抑菌活性进行测定,结果显示(图6),发酵液的抑菌率在20、40℃时显著高于其他温度(P<0.05),其抑菌率达到86.55%;随温度的升高至60℃时,抑菌作用略有下降,但抑菌率仍保持在80%以上;当温度达到80℃以上后,抑菌作用明显减弱,抑菌率最低降至55.72%。

不同小写字母表示抑菌率在不同温度下差异显著(P<0.05)。下图同Different lowercase letters indicated significance of the difference in the bacteriostatic rate at different temperatures(P<0.05).The same as below图6温度对菌株ZJ1发酵液抑菌活性的影响Fig.6 Effect of temperature on the bacteriostatic activity of fermentation filtrate of ZJ1 strain
2.2.2 酸碱稳定性测定菌株ZJ1发酵液在不同酸碱度下对Monilinia laxa抑菌活性进行测定,结果发现(图7),发酵液的抑菌率在pH值为7.0时显著高于其他pH值(P<0.05),抑菌率为86.28%,当酸碱性发生变化后,抑菌率出现明显差异,但仍高于65%。
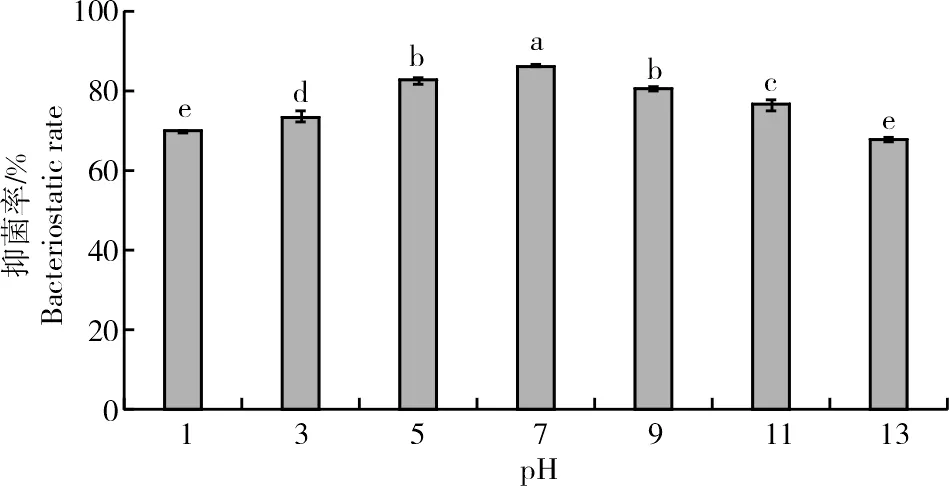
图7 酸碱度对菌株ZJ1发酵液抑菌活性的影响Fig.7 Effect of different pH values on the bacteriostatic activity of fermentation filtrate of ZJ1 strain
2.2.3 紫外辐射稳定性测定从图8可以看出,菌株ZJ1发酵液在不同时长的紫外灯照射后对Monilinia laxa仍有一定抑菌活性,随着时间的增加,其抑菌作用略有下降,但是紫外辐射12 h后抑菌率仍然保持在70%以上,且与6 h无显著差异(P>0.05),表明菌株ZJ1抑菌活性物质在紫外灯照射下稳定性较强。
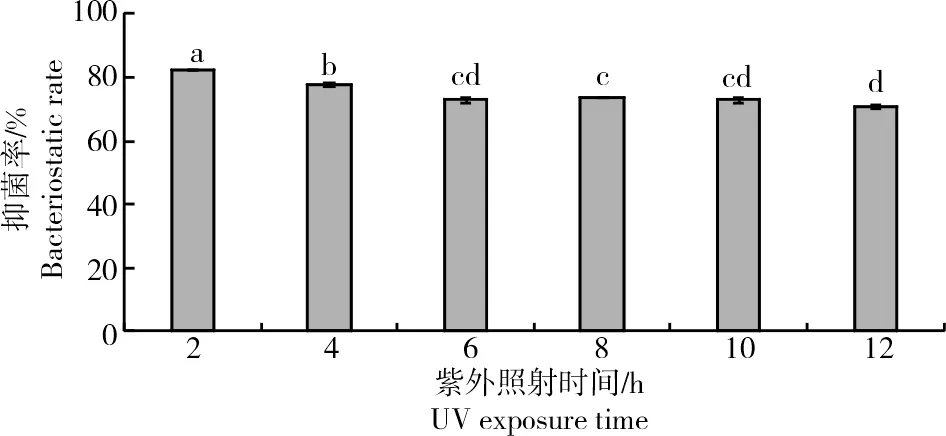
图8 紫外线照射对菌株ZJ1发酵液抑菌活性的影响Fig.8 Effect of UV radiation on the bacteriostatic activity of fermentation filtrate of ZJ1 strain
2.2.4 光稳定性测定由图9可知,菌株ZJ1发酵液经不同时长的白炽灯光照后对Monilinia laxa的抑菌活性没有大幅波动,其抑菌率总体保持在85%左右,发酵液的抑菌率在光照时间长短下均无显著性差异(P>0.05)。
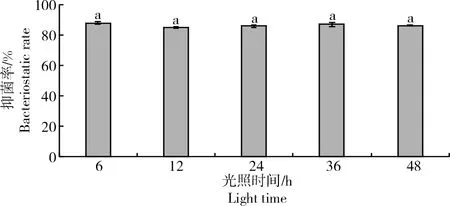
图9 光照对菌株ZJ1发酵液抑菌活性的影响Fig.9 Effect of light radiation on the bacteriostatic activity of fermentation filtrate of ZJ1 strain
2.2.5 贮存时间稳定性测定由图10可知,菌株ZJ1发酵液分别在室温、4℃冷藏的环境下,经不同时长保存后对Monilinia laxa的抑菌率保持在80%以上,随保存时间增加,抑菌作用无显著差异(P>0.05),但在相同时间点室温比4℃条件的抑菌作用略有下降。因此,冷藏有利于菌株ZJ1的保存。

图10 贮存时间对菌株ZJ1发酵液抑菌活性的影响Fig.10 Effect of storage time on the bacteriostatic activity of fermentation filtrate of ZJ1 strain
3 结论与讨论
微生物发酵受不同因素影响,是动态的生物学过程。本试验筛选出菌株ZJ1的最佳发酵条件为:YSP基础培养基为最佳基础培养基,乳糖为最佳C源,牛肉膏+酵母粉+蛋白胨为最佳N源,28~30℃为最佳发酵温度,发酵时间72 h,装液量100 mL/500 mL,接种量1%,转速190 r/min,pH值7.0。
对菌株ZJ1的发酵液进行测定时发现,其吸光值高低与菌株生长量呈正相关,且该发酵滤液的抑菌活性与滤液中抑菌物质积累量呈正相关。通过对菌株ZJ1在LB培养液中培养72 h菌体生长曲线变化的研究表明,其与何艺琴等[5]对小麦内生细菌XG-7对赤霉病菌生物学特性研究中菌体产量趋势相符合,最初为迟缓期所需时间较少,菌株在适应新环境避免死亡,并且为后续增值合成、积累充足的酶与能量,生长缓慢;接着进入对数期,稳定而极快地大量繁殖;最后由于培养基中代谢产物的蓄积、营养物质消耗等环境的改变,死菌数增加,新繁殖的活菌数减少,二者逐渐平衡进入稳定期。微生物通过发酵可以大量积累代谢产物,适宜的培养条件与产量密切相关。刘京兰等[17]对内生解淀粉芽孢杆菌CC09产Iturin A摇瓶发酵条件优化的研究表明,发酵条件优化后可提高抗菌脂肽Iturin A的产量;戴蓬博等[18]对极长链霉菌SL01菌株抑菌活性物质的发酵条件优化和稳定性研究表明,通过培养基优化,可以显著提高SL01发酵产物的抑菌活性,在中性环境以及40℃下菌株抑菌活性较稳定,对光和紫外线不敏感。
本试验中,菌株ZJ1的发酵条件与蒋晶晶等[19]对贝莱斯芽孢杆菌X1-6-1发酵条件的优化,杨可[20]对贝莱斯芽孢杆菌TCS001发酵条件优化以及杨胜清[21]对贝莱斯芽孢杆菌S6发酵条件的优化结果及稳定性研究有一定差异:发酵所需的pH值基本都是7,菌株ZJ1与贝莱斯芽孢杆菌X1-6-1的发酵时间相同为72 h,与贝莱斯芽孢杆菌TCS001发酵所需的N源相同;菌株ZJ1的装液量和接种量较上述3种菌株少,最佳发酵温度不同;菌株ZJ1与蓝莓溃疡病生防链霉菌CX3及极长链霉菌SL01都对光和紫外线不敏感,但蓝莓溃疡病生防链霉菌CX3较为耐碱,分析其差异可能是由菌株来源及其宿主植物不同、菌株结构不同所引起的。由于田间很少出现强酸强碱以及超高温环境,相对于常规贝莱斯芽孢杆菌来说,田间环境适宜菌株ZJ1的发酵,且该菌株对温度耐受性较好,可长时间贮存。本研究结果可为菌株ZJ1开发成生物菌剂并应用于田间奠定理论基础。
