双重血浆分子吸附系统模式人工肝治疗中低血压发生的影响因素分析
2022-09-19胡东燕李文渊江守伟
胡东燕, 王 红, 李文渊, 宁 玲, 韩 华, 沈 强, 江守伟, 李 磊
中国科学技术大学附属第一医院 感染病科, 合肥 230001
低血压是重症肝病患者行人工肝治疗过程中常见的并发症之一,科学预判,及时处理对于保证患者安全、改善预后具有重要意义。研究[1]表明,血液透析中低血压的发生率占透析患者的20%~30%。低血压的发生影响到正常诊疗过程并存在加重病情的可能,同时也是预后不良的危险因素[2]。人工肝支持系统作为重症肝病治疗的必要手段,在重症肝病救治中起到不可替代的作用。双重血浆分子吸附系统(dual plasma molecular adsorption system,DPMAS)模式为我国自主研发的人工肝模式,具有治疗效果确切、对血浆依赖性小的优势,应用广泛。关于人工肝治疗过程中低血压[3]发生相关危险因素的研究不多,现有相关研究[4-5]显示高龄、女性、低蛋白血症、贫血、BMI、超滤率等与治疗过程中低血压的发生相关。本研究对发生术中低血压(intraoperative hypotension,IOH)的患者的临床资料进行了分析,以期为临床针对性地预防和干预手段提供循证医学依据支持。
1 资料与方法
1.1 研究对象 选取2017年10月1日—2020年12月31日在本院行DPMAS治疗的重症肝病或肝衰竭患者,诊疗和操作参照《肝衰竭诊治指南(2018年版)》[6]和《非生物型人工肝治疗肝衰竭指南(2016年版)》[7]。
1.2 测量血压方法及分组方法 患者静息平卧,术前半小时开始心电血压血氧饱和度监护,所有患者使用同一台监护仪(UT4000A监护仪为GOLDWAY公司产品,由合肥市计量测试研究院检验,每半年检测一次均合格,有效期至2022年11月4日)、同侧上臂,测量肱动脉血压,每5 min自动测量血压1次。依据是否出现IOH分为两组(IOH组和非IOH组),对患者相关资料进行分析。低血压的诊断参照Sands等[8]血液透析患者操作过程中低血压诊断标准:动脉收缩压数值下降≥30 mmHg且动脉收缩压最低<90 mmHg,即纳入IOH组;未达到前述标准者纳入非IOH组。在进行DPMAS治疗中,第1次出现低血压即诊断IOH,并收集治疗前相关实验室数据。未出现低血压患者收集第1次人工肝治疗前实验室数据。
1.3 人工肝治疗方式和低血压处理 患者接受人工肝治疗次数一般为3~5次,单次治疗时间为3~4 h。血液泵流速100~120 mL/min,分浆比0.25~0.3,分浆泵流速25~36 mL/min,采用全身肝素抗凝法,根据血小板、凝血情况予以调整。采用DPMAS模式和DPMAS续贯半量血浆置换组合模式。人工肝治疗过程中所使用仪器、耗材为:DX-10血液净化机(珠海健帆公司)、Plasauto∑血液净化机(日本旭化成公司)、血液净化管路(哈娜好的透析型人工肾一次性使用血液回路导管,预冲容量200 mL),一次性使用血浆胆红素吸附器BS 330[血浆容量(135±10)mL]和一次性使用血液灌流器HA 330-Ⅱ[血浆容量(185±5)mL](珠海健帆公司),以及OP-08W血浆分离器(日本旭化成公司)。总体外循环的血液和血浆总量约600 mL。
监测治疗中患者收缩压,出现IOH立即暂停分浆泵,调慢血液泵70~80 mL/min,静脉输注适量胶体溶液(白蛋白、血浆、代血浆等),以及平衡液等晶体溶液。待患者收缩压回升90 mmHg以上,继续人工肝治疗,控制血液泵流速90~100 mL/min、分浆比0.2~0.25、分浆泵流速20~25 mL/min,待血压恢复到术前状态,适当加大血液泵流速至100~120 mL/min,分浆泵流速30~36 mL/min,以控制总治疗时长,提高患者耐受度,以预防和减少低血压的发生。此外,IOH患者治疗结束后给予血压监测,根据情况适度补充液体。
1.4 观察指标 收集患者性别、年龄、BMI、心血管病史等一般资料,及相关实验室检查项目:血红蛋白、白蛋白、总胆红素、凝血酶原活动度、血钠、肌酐、血糖等。本研究中使用的BMI,其体质量均以干体质量计。计算方法为:根据临床判断的腹水严重程度[9]减去一定量体质量进行矫正,其中少量5%,中量10%,大量15%;如患者存在外周水肿再减5%[10]。

2 结果
2.1 一般资料 共纳入重症肝病或肝衰竭患者181例,其中男142例,女39例,年龄(48.39±12.21)岁。IOH组70例,非IOH组111例,两组间性别、年龄、BMI、血红蛋白、血钠比较差异均有统计学意义(P值均<0.05)(表1)。

表1 IOH组和非IOH组患者的一般临床资料Table 1 General information of patients in IOH and non-IOH groups
2.2 IOH发生情况 IOH组70例共计发生118次IOH。所有IOH均发生在DPMAS模式治疗时段。70例IOH患者时间分布为25(17.5~30)min,其中67例(95.7%)发生在人工肝治疗开始的40 min内(图1)。70例中37例(52.86%)为一过性低血压,30 min内血压恢复正常,13例(18.57%)1 h内血压恢复正常,20例(28.57%)在人工肝治疗后次日晨血压恢复正常。181例患者中180例完成DPMAS或组合模式人工肝治疗,1例患者因治疗不耐受提前下机,未完成治疗。
2.3 IOH发生伴随症状 70例发生IOH患者中有36例(51.4%)有伴随症状,其中:恶心8例(11.4%),呕吐3例(4.3%),胃部不适5例(7.1%),心慌12例(17.1%),胸闷6例(8.6%),头晕8例(11.4%),腹胀3例(4.3%),躁动2例(2.9%),神志模糊3例(4.3%),麻木感2例(2.9%),畏寒6例(8.6%),出汗2例(2.9%),饥饿感2例(2.9%),视物模糊2例(2.9%)。
2.4 IOH相关危险因素 结合临床并通过对年龄(<50岁 vs ≥50岁)、性别、BMI(≤24 kg/m2vs>24 kg/m2)、是否贫血、是否伴有低钠血症、肌酐(≤81 μmol/L vs>81 μmol/L)、总胆红素(<420 μmol/L vs≥420 μmol/L)、白蛋白(<30 g/L vs 30~35 g/L vs>35 g/L)、血糖(<3.9 mmol/L vs 3.9~6.1 mmol/L vs >6.1 mmol/L)、凝血酶原活动度(<20% vs 20~40% vs >40%)、人工肝治疗总次数(1~3次 vs ≥4次)进行单因素Logistic回归分析发现,女性、年龄≥50岁、正常及低BMI者发生IOH的风险更高(P值均<0.05)(表2)。进一步多因素分析显示,正常及低BMI(≤24 m2/kg)、女性是患者发生低血压的危险因素(P值均<0.05)(表3)。
2.5 ROC曲线分析 将独立危险因素BMI进行ROC曲线分析,计算得出cut-off值为23.623,基本与本研究的BMI分组接近。BMI预测IOH的AUC为0.603(P<0.05),进一步以BMI=24kg/m2作为界值进行BMI二分类ROC曲线分析,其预测IOH的AUC为0.601(P<0.05),与初始连续变量接近(图2a)。将两个独立危险因素[女性+BMI≤24 kg/m2(无=0,有=1)]联合进行ROC曲线分析,结果显示,女性+BMI≤24 kg/m2预测IOH的AUC为0.639(P=0.002)(图2b)。

图1 在DPMAS治疗中IOH发生的时间分布Figure 1 The time distribution of the occurrence of IOH in DPMAS therapy

表2 IOH发生的单因素Logistic回归分析Table 2 Univariate Logistic regression analysis of IOH ocurrence

表3 IOH发生的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of IOH ocurrence
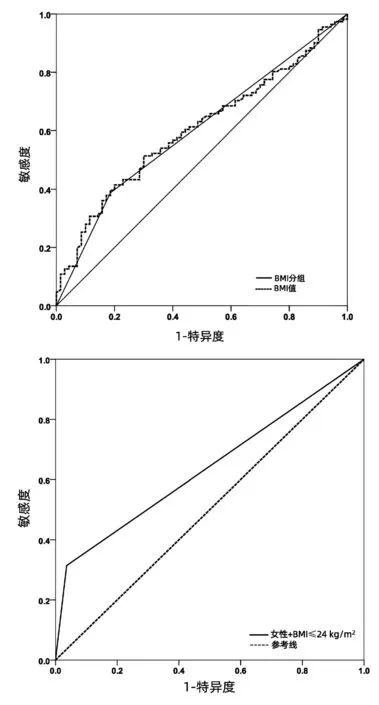
图2 独立危险因素预测IOH的ROC曲线
2.6 IOH和非IOH组患者的生存预后比较 70例患者发生IOH后,经过调整分浆速度,适度补充液体,血压均在24 h内得到纠正,提示IOH发生与否对患者即时生存情况无明显影响。通过电话和门诊随访患者的生存情况,观察DPMAS人工肝治疗后12周和24周两个时间节点的患者生存情况。181例患者失访31例,共150例患者纳入研究,其中非IOH组98例,IOH组52例,2组间12周(76.53% vs 55.77%,χ2=6.887,P=0.009)和24周(74.49% vs 50.00%,χ2=9.080,P=0.003)的生存率差异均有统计学意义。
3 讨论
IOH是DPMAS治疗期间常见的并发症之一,发生率高,常导致人工肝治疗暂停或终止,影响治疗的耐受性和毒素清除的充分性。有研究[11-15]证实,IOH可导致短时间各个脏器的血流较少,可能引起肾脏、心血管等并发症,影响患者预后和生存质量。IOH发生的相关危险因素较多,常见的影响因素主要分为患者自身因素及人工肝操作相关因素,如血容量下降、发生生物不相容性、过敏、自主神经功能紊乱、心脏储备功能下降、女性、BMI等[16]。
有效血容量减少是导致低血压最常见的原因之一。人工肝治疗开始40 min内,体外循环建立,部分血液引流至机器管路和血浆分离器中,有效循环容量减少,造成再灌注不足致血压降低,这是发生IOH的主要原因,因此大多数IOH发生在DPMAS治疗的早期。如果患者是女性,同时BMI正常或者低,建议在DPMAS人工肝治疗前,静脉输入适量白蛋白、血浆等胶体溶液,同时体外循环开始的40 min内,血泵速度100~120 mL/min,分浆速度25~30 mL/min,预防IOH发生。
本研究表明,女性、BMI正常及偏低是发生IOH的独立危险因素,与国外研究[17-20]结果相符合。我国一项大样本调查研究[21]显示,性别、BMI与低血压的患病情况之间存在相关性,女性低血压患病率是男性的2倍(OR=2.39),随着BMI升高,低血压患病率也呈下降趋势(OR=0.46),与本研究结果相一致。女性IOH发生率较高,可能与雌激素对血管平滑肌的扩张作用,静止肌肉交感神经活动低,外周阻力低等有关[22]。
通过单因素及多因素分析结果显示,BMI正常和偏低是患者DPMAS人工肝过程中发生IOH的危险因素,其发生概率是超重患者的3.29倍。Tian等[23]研究血液透析患者身体成分与透析过程中低血压发生的关系发现,低肌肉组织指数和高脂肪组织指数的预测能力优于BMI,与低血压相关性更大。正常及偏低BMI患者更易发生IOH,可能与肌肉组织指数低营养不良有关。营养不良和感染、腹水、肝性脑病等并发症的发生密切相关,是终末期肝病患者死亡的独立危险因素[24]。终末期肝病患者营养评估筛查[25]手段主要包括: BMI、营养风险筛查工具(nutritional risk screening 2002,NRS 2002)、营养优先工具(the royal free hospital-nutritional prioritizing tool, RFH-NPT)等。营养不良的评定指标主要包括:人体成分评定(BMI、第三腰椎骨骼肌指数、人体成分分析等)、能量代谢检测(代谢车等)、综合评分工具及膳食摄入评定等。由于肝衰竭等重症肝病患者常存在体液潴留情况,导致BMI在评估营养状态的准确性方面受到较大的影响,采用干体质量BMI可以有效矫正体液潴留导致的评估偏差,预测价值良好。NRS 2002、RFH-NPT也受到体液潴留影响,且操作相对复杂。第三腰椎骨骼肌指数、人体成分分析较为客观,可重复性强,但对于设备要求较高。因此,相对而言,干体质量BMI具有简单、易操作、评价效能较好的特点,更适于基层医护人员使用。
另外,本研究中IOH组患者12周、24周时的病死率均高于非IOH组,提示IOH与患者的远期生存预后不良相关。关于两者之间的关系研究尚少。目前认为两者均与肝病患者营养不良高度相关。研究[26]证实营养不良是影响终末期肝病患者存活率的独立危险因素,正常及偏低BMI患者更易发生IOH,可能与患者的肌肉组织指数低,暨以肌少症为主要表现的营养不良有关。国内学者使用第三腰椎骨骼肌指数评价患者营养状态,有助于合理安排肝移植等待优先顺序[27],且对慢加急性肝衰竭患者长期生存预后的预测效能良好[28]。因此,简单、客观、有效地评估重症肝病患者的营养风险和状态,及时给予营养支持,改善营养状态,可减少并发症的发生,降低病死率。对于有肝移植指征且营养不良的患者应优先列入肝移植名单,以更好地改善患者生存预后。
本研究尚存在一定局限性,如样本量相对偏小,系单中心研究,未纳入心功能评估指标等。今后应进一步扩大观察病例数量,联合开展多中心观察,并增加肌肉组织指数、人体成分分析等营养评估指标,以期提供更为可靠的循证医学证据。
伦理学声明:本研究方案由中国科学技术大学附属第一医院伦理委员会审批,批号为2022-RE-044,所有患者在人工肝术前均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:李磊、江守伟对研究的思路或设计有关键贡献;胡东燕、王红、李文渊、宁玲、韩华、沈强参与了研究数据的获取分析解释过程;胡东燕、王红、江守伟参与了论文的撰写及修改。
