EMS处理对黄花美冠兰原球茎生长及分化的影响
2022-09-19邓小果
邓小果
(海南开放大学农业农村学院,海南 海口 570208)
黄花美冠兰(Eulophia flava(lindley)Hookerf.)是一种观赏价值很高的野生兰科植物,其花葶侧生,粗壮,高可达1m;总状花序直立,长28~32cm,疏生10余朵花;单花轮生,每节着生3朵小花,节间距1.5cm左右;花大,黄色,直径达4cm以上;花期5—6月。早在1987年,中国热带农业科学院在海南岛花卉种质资源考察中,就将黄花美冠兰列为重点推荐的野生兰种类[1],引入海南热带植物园驯化栽培。黄花美冠兰的组织培养[2]、核型分析[3]、切花保鲜[4]都有相关的研究。
化学诱变育种是用化学诱变剂处理植物材料,以诱发遗传物质的突变,从而引起形态特征的变异,然后根据育种目标,对这些变异进行鉴定、培育和选择,最终育成新品种,成本低、操作简单,能够产生常规育种方法难以获得的新基因和新性状[5,6]。目前化学诱变主要应用于对农作物的处理,再通过多世代对突变体进行选择和鉴定,直接或间接地培育成生产上能利用的农作物品种[7-9]。
观赏植物在化学诱变中大多采用秋水仙素诱导多倍体[10-13],蝴蝶兰[14]、文心兰[15]EMS离体化学诱变技术有相关报道,黄花美冠兰EMS的离体化学诱变研究尚未见报道。本试验采用组织培养与化学诱变技术相结合,通过液体浸泡法将不同浓度的EMS对黄花美冠兰原球茎作不同时间处理,经EMS处理后的原球茎再分化成苗。与传统杂交育种选育,大大减轻了工作量,加快了选育进程,拓宽了黄花美冠兰新品种选育的思路。
1 材料与方法
1.1 材料
试验材料为海南大学提供的健壮的黄花美冠兰原球茎。
1.2 诱变剂及培养基
1.2.1 诱变剂
EMS(甲基磺酸乙酯)为瑞士生产,将带有刻度的烧杯和无菌水在121℃(1.1kg·cm-1)下灭菌30min,在超净工作台上用过滤灭菌器将EMS原液配成浓度分别为0.2%、0.4%、0.6%、0.8%、1.0% 5种浓度的溶液,随用随配。
1.2.2 培养基
增殖培养基:MS加BA 3.0mg·L-1加NAA 0.1mg·L-1加10%CM加AC 1g·L-1加蔗糖30g·L-1加琼脂6g·L-1;分化培养基:MS加BA 3.0mg·L-1加NAA 0.1mg·L-1加土豆50g·L-1加AC 1g·L-1加蔗糖30g·L-1加琼脂6g·L-1。
1.3 方法
1.3.1 EMS处理
选取生长旺盛,大小基本均匀的黄花美冠兰原球茎,在超净工作台上用镊子将其单个剥离,用不同浓度EMS的进行处理。EMS处理浓度为0.2%、0.4%、0.6%、0.8%、1.0%。处理时间为4h、6h、8h,处理后用无菌水冲液冲洗3~5次;以无菌水处理作为对照。
1.3.2 处理材料的培养
将处理后的原球茎接到增殖培养基中,每个处理接种40个原球茎,每个处理重复3次,所有材料均在同一条件下培养。培养温度26±1℃,每天光照12h,30d后统计死亡率。培养过程中观察原球茎的生长情况。
死亡率(%)=死亡原球茎数/接种原球茎数×100%
1.3.3 原球茎分化
将继代后存活的原球茎继续转入分化培养基中,培养温度26±1℃,每天光照12h,30d后观察生长情况并统计分化率。
分化率(%)=分化成芽原球茎数/接种原球茎数×100%
1.3.4 EMS对黄花美冠兰微核的影响
1.3.4.1 试验方法
浓度分别为0.2%、0.4%、0.6%、0.8%、1.0%的EMS溶液;时间为4h、8h。对照(CK)不含EMS。
取接种3d后正处于生长旺盛期的原球茎,于4℃冰箱中,用卡诺氏固定剂(无水乙醇∶冰醋酸=3∶1v/v)固定24h。置70%乙醇中保存。
1.3.4.2 染色制片
在室温中用改良石灰酸品红染液染色,常规压片法制片。统计微核率。
MCN(%)=观察到的MCN数/观察的细胞总数×100
2 结果与分析
2.1 EMS对黄花美冠兰原球茎生长的影响
将原球茎放入0.2%、0.4%、0.6%、0.8%、1.0%不同浓度的EMS浓度中浸泡4h、6h、8h后,接种到增殖培养基中,结果如表1。
各处理所得的原球茎死亡率在经过反正弦角度代换在SAS系统上进行邓肯比较。得出,F=442.86,P<0.01,表明处理间的差异达极显著。由表1可知,不同EMS浓度及处理时间对原球茎的存活有很大的影响。在EMS处理黄花美冠兰原球茎过程中,随着EMS处理浓度增大,处理的材料生理损伤较大,材料出现褐化,白化现象。经过EMS处理的原球茎早期生长缓慢,14d后部分原球茎逐渐出现白化或褐化现象,并逐渐死亡。对照原球茎无白化现象,经EMS诱变后的死亡率明显高于对照组,在相同的处理时间内,随EMS浓度升高原球茎的死亡率升高明显。相同浓度的长时间处理,死亡率明显增加。在浓度为1.0%,处理时间为8h时,原球茎全部死亡。高浓度需要较短处理时间就可使原球茎致死,低浓度需要较长处理时间。
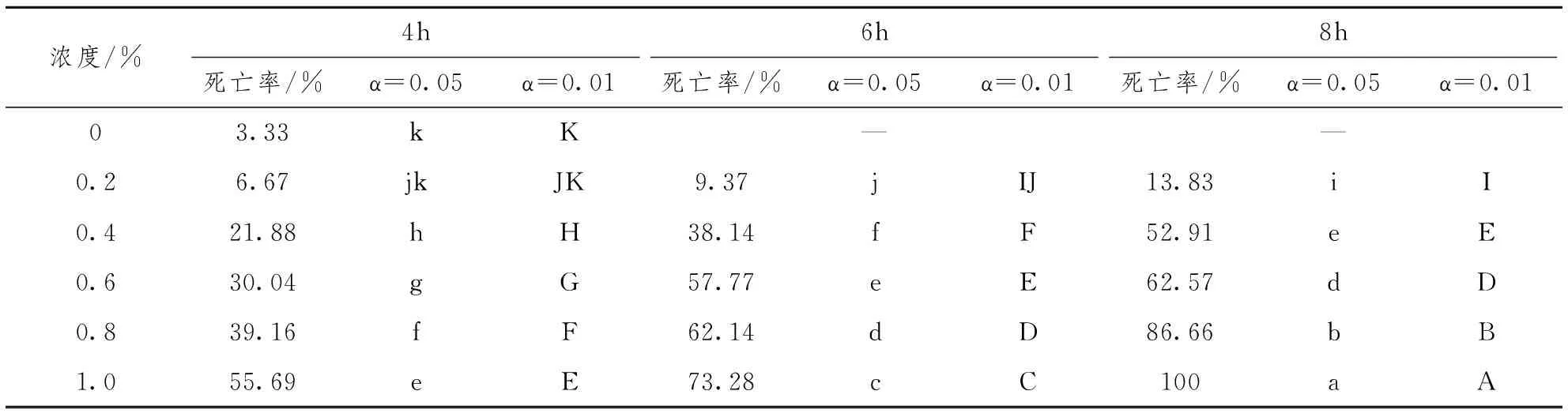
表1 黄花美冠兰经EMS处理后死亡率的方差分析

图1 经EMS处理后受损伤的原球茎
2.2 EMS处理对原球茎芽的分化的影响
将EMS处理过的原球茎转接到分化培养基中继续培养,15d后,原球茎分化出芽,EMS对芽的诱导产生较大的影响。各处理所得的原球茎分化率在经过反正弦角度代换在SAS系统上进行邓肯比较。得出,F=669.24,P<0.01,表明处理间的差异达极显著。
由表2可知,处理时间长的分化率低于处理时间短的分化率。在相同的处理时间内,随着EMS浓度的增加,原球茎的分化率普遍呈现下降趋势。在EMS处理相同的浓度下,所有处理组合的原球茎分化率都是随着EMS处理时间的升高而降低。除了在处理浓度为0.4%时,时间为4h和6h下的原球茎分化率比EMS浓度为0.2%时的高。

表2 黄花美冠兰原球茎经EMS处理后分化率的方差分析
2.3 EMS处理原球茎后对细胞核的影响
EMS诱发黄花美冠兰原球茎的细胞微核率及其统计结果如表3。各组所得微核百分率在经过反正弦角度代换在SAS系统上进行邓肯比较。得出F=165.55,P<0.01。处理间的差异达到极显著。从表3可以看出,对照没有出现微核,用EMS处理过的原球茎都能产生微核,当处理时间相同时,在0%~1.0%范围内,随着浓度升高,原球茎细胞微核率提高,当浓度相同时,随着时间的延长,原球茎细胞微核率也提高,最高微核率出现在浓度为0.8%,处理时间为8h中,最低微核率出现在对照组中。本试验中观察到的微核主要以单微核居多,也出现双微核。微核的出现是由于上次有丝分裂过程中染色体受损形成的断片或染色体活动异常而造成的。

表3 EMS对黄花美冠兰原球茎细胞微核数的诱变效应
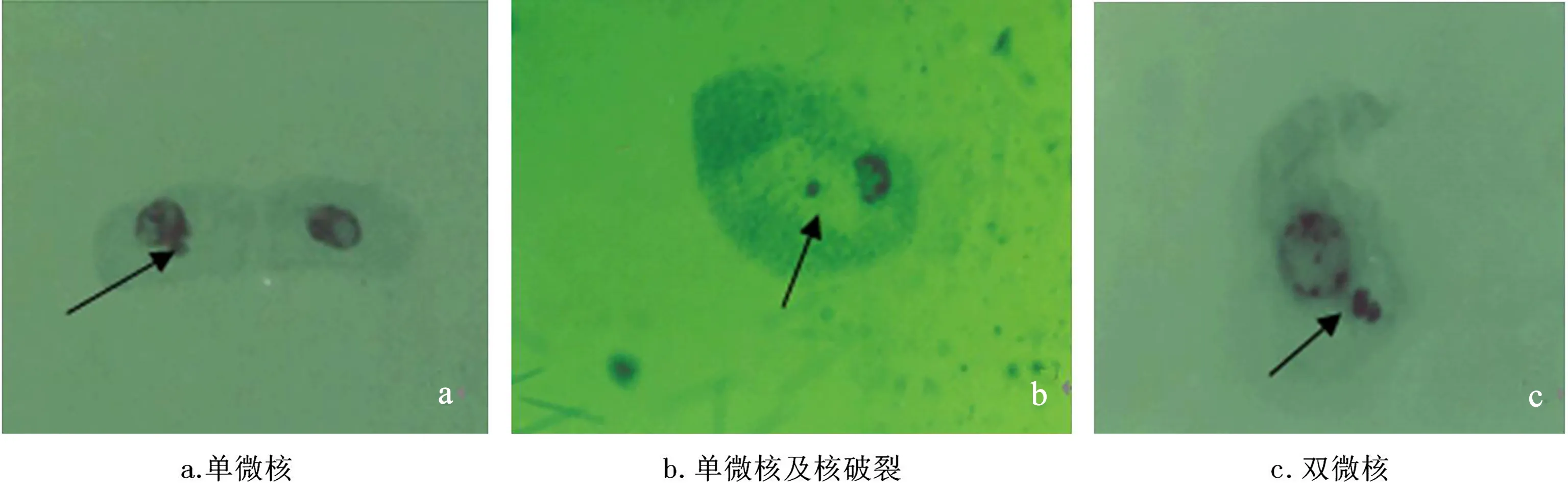
图2 EMS处理原球茎后产生的细胞微核
3 讨论与结论
本试验将原球茎放入0.2%、0.4%、0.6%、0.8%、1.0%等不同浓度的EMS浓度中浸泡4h、6h、8h后,接种到增殖培养基中,观察原球茎的生长情况和分化率。在培养过程中,原球茎的死亡率随着浓度和时间的增加而增加,在浓度为0.4%处理时间为4h、6h,原球茎的分化率较好,说明原球茎在受损伤后,又恢复生长,其中可能包含较多的突变细胞。浓度为0.4%处理时间为8h和浓度为0.6%处理时间为6h时,原球茎的死亡率分别为52.91%和57.77%,约为对照50%,可作为创造黄花美冠兰PLB突变体的参考浓度。通过对处理过的原球茎进行细胞学上的观察,发现处理后的细胞都出现了微核。
目前诱变的主要目的是获得变异体,对于组培诱变体系的控制方向和定性、定量研究方面,目前开展的试验较少;变异性状是否有利尚有待于后期的检验和鉴定,变异体有效鉴定方法的研究也有待于进一步研究和完善。因此,如何控制诱变方式和技巧以实现变异性状的定向控制还需要深层次的研究。
