寄生曲霉快速分子检测方法的研究
2022-09-19王欢薛健
王欢 薛健
(吉林农业科技学院生物与制药工程学院,吉林 吉林 132101)
前言
黄曲霉毒素(Aflatoxins,AFT)主要由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)等多种真菌代谢产生,能够污染谷物、坚果、干果及中药材等,在自然条件下性质非常稳定[1,2]。AFT属于二呋喃香豆素衍生物,其基本结构中均含有二呋喃环和氧杂萘邻酮(香豆素),在紫外光照射下可产生荧光。其中,黄曲霉毒素B1(AFB1)的毒性最强。AFB1具有极高的致突变性、毒性和致癌性[3],其致癌性是氰化钾的10倍,毒性是砒霜的68倍,是诱发原发性肝癌的最主要的原因,同时也会对胰脏、脾脏等器官有轻微的影响,造成机体免疫力下降,生长迟缓[4]。
在产AFT真菌中,寄生曲霉是常见的产毒曲霉之一,对人类的生产、生活造成了极大的危害。能够产生AFT的黄曲霉菌株有30%~60%,而几乎所有的寄生曲霉菌株均产生AFT,而且寄生曲霉嗜干燥,在适宜生长条件下可快速繁殖。寄生曲霉除能够产生AFT外,还能产生肾脏毒素—曲酸(Kojic acid)[5],不仅会感染动物,使动物致病致死,还会导致人体发生急性肝中毒、慢性肝中毒、慢性肾脏损伤,甚至致癌、致畸、致突变。
目前寄生曲霉污染的检测主要集中在对黄曲霉毒素含量的检测上,且常用的方法有薄层色谱法、高效液相色谱法和ELISA法[6]。而这些方法不能从源头上对寄生曲霉的污染进行防治,且存在仪器复杂、样品处理繁琐及价格昂贵等缺点。为此,本研究针对寄生曲霉合成黄曲霉毒素的关键基因柄曲霉素转甲氧基酶基因Omt-1、调节基因aflR[7],建立一种改良的溶菌酶-CTAB法进行黄曲霉的快速、灵敏、高效的分子检测方法。该方法简单便捷,大大节省了检测时间,可作为防控AFT污染的有效方式。
1 材料与方法
1.1 材料与仪器
1.1.1 供试菌株
黑曲霉、米曲霉、产黄青霉和酿酒酵母是本实验室保藏,寄生曲霉(AS 3.4407)购自北京微生物研究所。
1.1.2 试剂与仪器
察氏培养基:硝酸钠0.3%、磷酸氢二钾0.1%、硫酸镁0.05%、氯化钾0.05%、硫酸亚铁0.001%、蔗糖3%、琼脂粉2%,pH自然,121℃、灭菌25min。
溶菌酶、Taq DNA聚合酶、dNTPs,生工生物工程(上海)股份有限公司,其他试剂均为国产分析纯。
DHP-9052恒温培养箱(南京卓鼎干燥设备厂);R404A离心机(德国 Eppendorf);TP600 PCR(大连Takara公司);JY600PJ电泳仪(北京君意东方电泳有限公司);LAS500凝胶成像系统(美国GE公司);Biospec-nano核酸浓度测定仪(日本SHIMADZU公司)。
1.2 方法
1.2.1 寄生曲霉基因组DNA的提取
使用溶菌酶-CTAB法提取寄生曲霉基因组DNA。刮取活化后的菌丝于1mL无菌生理盐水中,10000rpm、离心5min,漂洗2次。弃上清,称取100mg沉淀,加入100μL 1M Tris-HCL,20μL 1M EDTA,5mg·mL-1溶菌酶,混匀。30℃温育30min。再加入1mL CTAB裂解液60℃温育30min,每隔10min振荡1次。12000rpm离心10min,向上清中加入等体积24∶1的氯仿和异戊醇混合液,旋涡振荡后静置5min,12000rpm、4℃离心5min,重复2次。取上清,加入等体积预冷的异丙醇,轻轻混匀,于4℃静置5min,12000rpm、离心5min,弃上清。用0.5mL 70%乙醇洗涤沉淀后,12000rpm、离心10min,弃上清,自然风干2~3min。使用30μL TE溶解沉淀,于4℃储存备用。
1.2.2 引物设计
选择寄生曲霉参与黄曲霉毒素合成的关键基因作为PCR检测的靶基因,包括柄曲霉素转甲氧基酶基因Omt-1、产黄曲霉毒素调节基因aflR[8-10],使用Premier Primer 5.0设计引物,2对引物序列分别为Omt-F:GTGGACGGACCTAGTCCGACATCAC,Omt-R:GTCGGCGCCACGCACTGGGTTGGGG;aflR-F:AGAAT AGCTTCGCAGGGTGGT,aflR-R:AGTCTGGGAGGAA CGGATCG。由吉林库美生物有限公司合成引物。
1.2.3 PCR反应体系与检测条件
本研究所需的PCR反应体系包括DNA模板3μL,Taq酶1μL,上、下游引物各0.5μL,dNTPs 1μL,10×PCR buffer 2.5μL,ddH2O 16.5μL,反应总体积为25μL。反应前将PCR管置于冰上,依次加入各组分后轻轻混匀,短暂离心后进行PCR。PCR反应条件:95℃预变性5min后,95℃30s、55℃30s、72℃30s,30个循环,72℃延伸10min,4℃保存。反应结束后通过1%琼脂糖凝胶电泳对结果进行检测。
1.2.4 灵敏度检测
将提取的寄生曲霉基因组DNA依次按照10-1、10-2、10-3、10-4、10-5进行梯度稀释后作为模板进行PCR扩增。再通过1%琼脂糖凝胶电泳对PCR结果进行检测。
1.2.5 特异性检测
为考察寄生曲霉Omt-1与aflR作为检测靶基因的特异性,按照1.2.1的方法提取各对照菌的基因组DNA,然后进行PCR扩增,使用1%琼脂糖凝胶电泳检测结果。
2 结果与分析
2.1 基因组的PCR扩增结果
经溶菌酶-CTAB法提取的基因组作为模板,进行PCR扩增与1%琼脂糖凝胶电泳检测后,如图1,Omt-1的扩增产物(泳道1)和aflR(泳道2)的扩增产物均清晰可见,且亮度较高,大小分别位于750bp和500bp附近,与预期的Omt-1与aflR片段长度795bp和516bp一致,表明上述基因组提取方法可以有效用于寄生曲霉的检测。
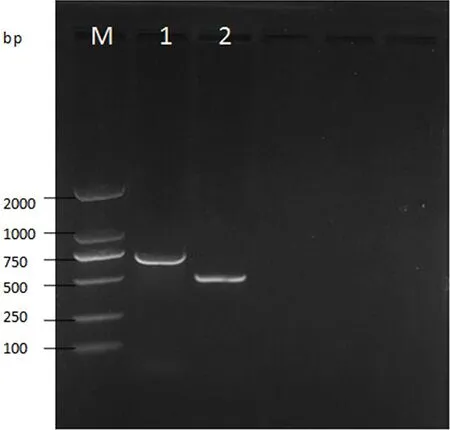
图1 PCR扩增目的片段电泳图M.Marker DL2000bp;1.柄曲霉素转甲氧基酶基因Omt-1;2.aflR基因启动子
2.2 灵敏度检测结果
经可见光扫描分光光度计检测,寄生曲霉DNA模板的核酸浓度为138.71ng·μL-1,分别对2种引物进行PCR灵敏度检测,由图2可得,当DNA浓度最低至1ng·μL-1,可见清晰的Omt-1扩增基因条带,由图3可得,当DNA浓度最低至100pg·μL-1,可见清晰的aflR扩增基因条带。寄生曲霉1个孢子中的DNA质量为103pg[11],所以若以Omt-1作为靶基因,灵敏度下限为10个孢子;若以aflR作为靶基因,灵敏度下限为1个孢子,表明aflR的检测灵敏度优于Omt-1。

图2 寄生曲霉Omt-1灵敏度电泳结果M.Marker DL2000bp;1.稀释10-1倍的基因组DNA;2.稀释10-2倍的模板基因组DNA;3.稀释10-3倍的基因组DNA;4.稀释10-4倍的基因组DNA;5.稀释10-5倍的基因组DNA

图3 寄生曲霉aflR灵敏度电泳结果M.Marker DL2000bp;1.稀释10-1倍的基因组DNA;2.稀释10-2倍的基因组DNA;3.稀释10-3倍的基因组DNA;4.稀释10-4倍的基因组DNA;5.稀释10-5倍的基因组DNA
2.3 特异性检测结果
分别使用2对引物对米曲霉、寄生曲霉、黑曲霉、产黄青霉和酿酒酵母进行了PCR检测,根据图4,米曲霉和寄生曲霉均能扩增出Omt-1目的产物;而图5只有寄生曲霉能扩增aflR目的产物。上述结果表明以aflR作为靶基因的特异性更强。
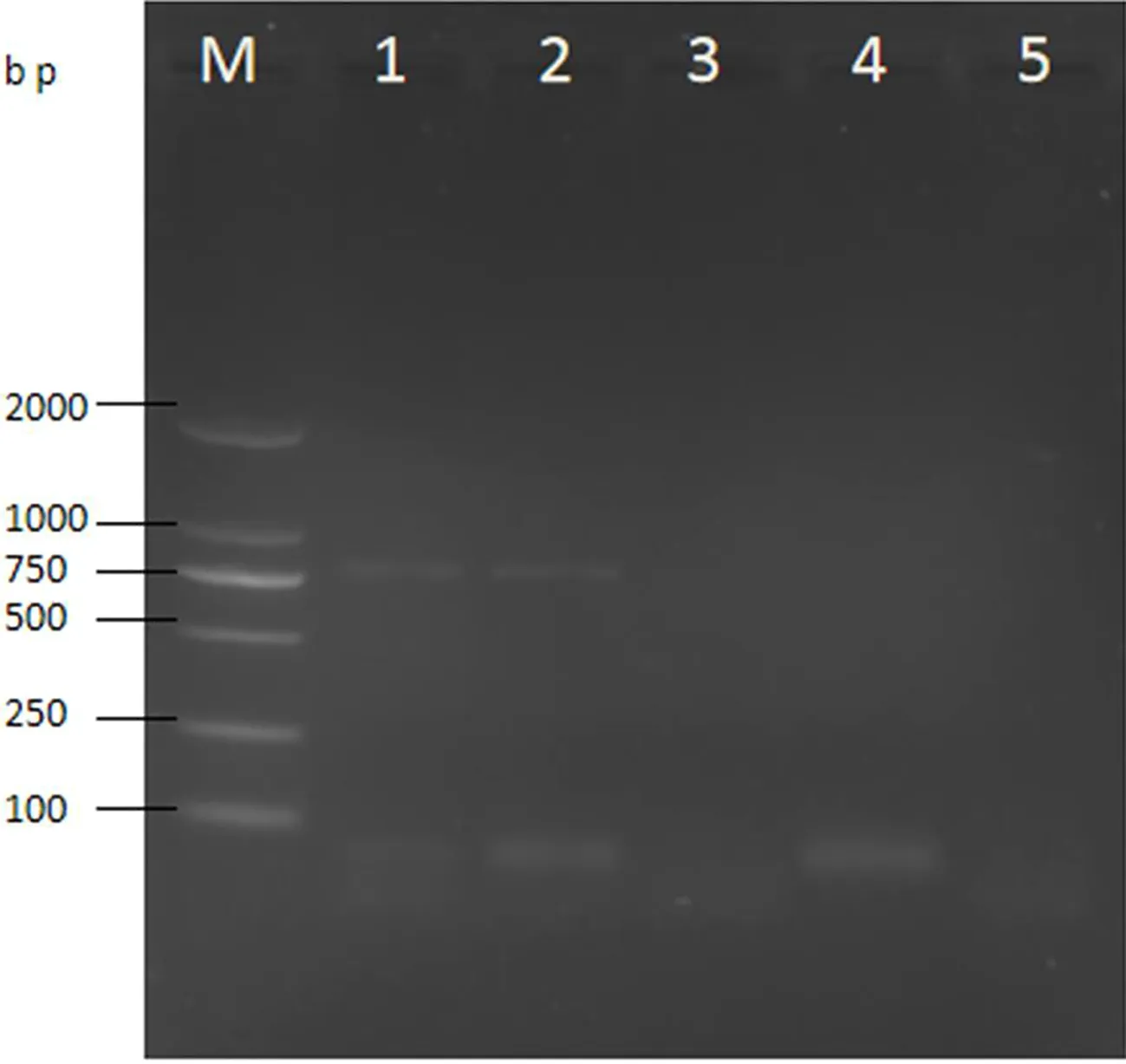
图4 Omt-1特异性电泳结果M.Marker DL2000bp;1.米曲霉;2.寄生曲霉;3.黑曲霉;4.产黄青霉;5.酿酒酵母

图5 aflR特异性电泳结果M.Marker DL2000bp;1.米曲霉;2.寄生曲霉;3.黑曲霉;4.产黄青霉;5.酿酒酵母
3 讨论
目前寄生曲霉污染的检测与防控主要集中在对黄曲霉毒素的检测[6],主要方法包括色谱法和免疫法,其中薄层色谱法(TLC)法灵敏度低,稳定性差,现已很少使用;高效液相色谱法(HPLC)法成本较高,操作复杂,对操作人员的专业性要求较高,不适用于普通实验室,不能用于现场快速检测;酶联免疫法(ELISA)由于灵敏度低常导致假阳性的出现,并且这些方法只能在AFT污染后进行检测。
利用分子生物学方法检测产毒真菌具有特异性好、灵敏度高、准确、便捷等优点,可对真菌污染进行提早防控。李慧[8]等以黄曲霉基因组DNA为模板构建的多重PCR检测方法中,其aflR靶基因的灵敏度下限为100pg。晏丽等[11]通过荧光定量PCR特异性针黄曲霉的nor-1基因进行检测,灵敏度最低至10个孢子,从提取菌株DNA到荧光定量PCR全过程在6h内。蒋丹[12]等建立了液氮研磨-CTAB法制备产毒曲霉菌DNA及其aflR基因PCR检测的方法。本研究中灵敏度指标与李慧等的研究结果一致,aflR基因的检测灵敏度最低可1个孢子,优于晏丽等研究结果。与蒋丹等研究相比,本研究中的溶菌酶-CTAB基因组提取方法更加简单、便捷,但由于真菌DNA的提取时间较长,今后可以针对该方法进行优化,以期进一步缩短检测时间。
4 结论
本文采用溶菌酶-CTAB法制备寄生曲霉基因组DNA,针对寄生曲霉的黄曲霉毒素合成关键基因aflR与Omt-1进行PCR检测,该方法对aflR具有较高的灵敏度和较强的特异性、简单快捷并且成本较低,能够在早期对寄生曲霉的污染进行有效防控。
