针刺调控胃运动的神经机制研究
2022-09-16周涛谭俊珍蔡青李春深郭义
周涛,谭俊珍,蔡青,李春深,郭义
(天津中医药大学,天津 301617)
消化道平滑肌维持正常的舒缩活动,才能保证正常的消化吸收功能。胃运动包括消化间期运动和消化期运动两种形式,它们均受到神经、体液以及本身肌电活动等诸多因素的影响,其中神经系统的作用尤为明显。目前研究证实,针剌对消化间期、消化期胃运动均具有良好调控效应,并被广泛应用于胃动力障碍疾病的治疗[1-3]。针刺对胃运动的良性调节作用有赖于神经系统结构的完整和功能的协调。本文将对针刺调控胃运动的效应的感觉传入、中枢整合和自主传出的神经机制进行综述,探讨针刺调控胃运动的神经机制。
1 感觉传入神经在介导针刺调节胃运动效应中的作用
兴奋不同类型的外周传入纤维可引起不同的躯体-内脏反射。针刺兴奋传入神经的类别均随针刺手法及其兴奋的感受器而异。穴位强刺激易产生交感兴奋效应,而穴位弱刺激易产生交感抑制或副交感效应[4]。朱兵团队通过设置不同强度的电针,证实 Aδ和 C类传入神经是电针调节胃运动的主要躯体感觉传入通路[5];进一步采用模式动物(TRPV1基因敲除小鼠),发现TRPV1通道在体表热灸调节胃运动的外周传入神经通路中发挥重要作用[6-7]。徐斌团队采用注射TRPV1拮抗剂(capsazepine)和TRPV1基因敲除小鼠的方法,也证实TRPV1通道部分参与了电针介导的胃运动调节[1]。
2 自主神经系统在介导针刺调节胃运动传出效应中的作用
研究表明针刺对胃运动的良性调节作用与自主神经系统的调节有关,交感和副交感神经是该效应的主要传出通路。已有研究采用心率变异性、迷走神经/内脏大神经放电、迷走神经/内脏大神经横断、迷走神经背核复合体(dorsal vagal complex, DVC)核团神经放电等方法评估自主神经的活动,结合胃排空率、胃肌电图、应力传感器或胃内置入球囊记录胃运动曲线等方法评估胃运动的变化,证实针刺远节段穴位(例如四肢部曲池、足三里等)通过脊髓上反射途径可激活迷走神经,增加胃肌电活动,从而促进胃运动、改善胃动力不足引起的症状,且其效应依赖于外周感觉传入经脑与迷走神经通路间的完整性[5,8-14];而针刺同节段穴位(例如腹背部中脘、天枢等)通过脊髓反射途径可激活交感神经,从而导致相反效果,且其效应依赖于交感神经通路与脊髓节段功能的完整性[5,9,11,15-16]。也有研究采用神经电生理的方法,发现左、右侧天枢穴对内脏的调节效应可能因内脏大神经响应的不同而存在差异,但针刺双侧天枢穴对迷走神经放电的影响不明显[17]。
也有研究探讨了自主神经系统参与针刺调节胃运动效应的受体机制。徐斌团队发现,敲除M2/M3受体可轻度延缓中脘抑制胃运动的效应,这提示M受体(相对β受体)在中脘调节胃运动的受体机制中更为重要[18-20];敲除M2/M3受体可扭转足三里的效应方向,表现为抑制效应,这提示足三里调节胃运动的受体机制中,除了M2/M3受体,可能还有其他受体机制[18-20];敲除β1/β2受体可削弱中脘抑制胃运动的效应,这提示除了β1/β2受体,电针中脘抑制胃运动的效应可能还有其他受体机制[18-19];β1/β2受体敲除后,电针足三里调节胃运动的兴奋效应体现出快速起效的特点,这提示β1/β2受体可能是足三里延迟起效的受体机制[18-20]。朱兵团队发现敲除M2/M3受体可明显削弱上巨虚、曲池对胃运动的促进作用,这提示M2/M3受体是介导异神经节段穴位对胃运动促进效应的重要受体。敲除β1/β2受体可明显削弱天枢、大肠俞对胃运动的抑制效应,提示β1/β2受体是构成同神经节段穴位对胃运动抑制效应的重要受体[7,16]。
3 中枢神经系统在介导针刺调节胃运动效应中的作用
3.1 中枢神经系统调节胃运动的机制
从中枢机制探讨针刺作用机理及其规律,一直是学者们所重视的方向。胃内机械或化学性刺激可激活胃黏膜层和肌层的一些特殊慢适应感受器,其信息经迷走神经传入纤维上行投射至延髓孤束核(nucleus of the solitary tract, NTS),在NTS换元后发出CCK能神经纤维投射到迷走神经背运动核(dorsal motor nucleus of vagus, DMV),二者与脑极后区共同构成DVC。DVC可发出神经投射与其他脑区发生突触联系,包括延髓腹外侧区(ventrolateral medulla,VLM)、中缝核、中脑导水管周围灰质(periaqueductal gray, PAG)、臂旁核(parabrachial nucleus, PB)、蓝斑核、杏仁核、小脑顶核、前庭内侧核、下丘脑等[21]。DVC在整合其他中枢的信息后,将调控信息通过迷走神经传出纤维传送到肠神经系统或直接作用于胃肠效应细胞,从而引起胃的感觉、运动和分泌活动的变化。也有文献报道,交感神经(主要是内脏大神经)也参与胃内感觉、运动、分泌等活动的调控,内脏大神经在脊髓 T6~T10水平进入脊髓灰质的外侧角,换元后发出二级神经元向高位中枢投射,包括NTS、VLM、PB、中央杏仁核(central amygdaloid nucleus, CeA)、PAG、下丘脑等[21](详见图1)。
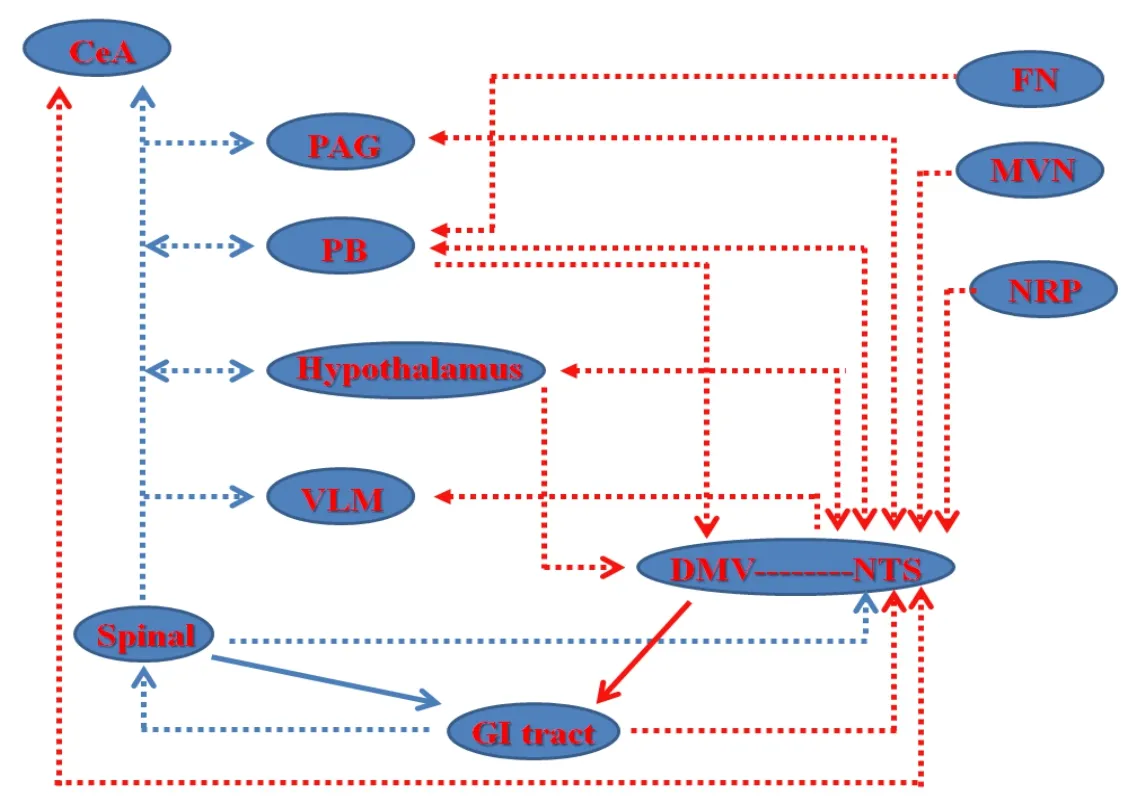
图1 参与胃运动调控的相关中枢核团之间的神经解剖学联系
胃扩张刺激可引起中枢不同水平神经元的放电活动发生变化,可分为胃扩张兴奋性和胃扩张抑制性神经元两种。这种现象多报道于DVC[22-23],但在其他脑区也有发现,例如下丘脑的弓状核[24]、室旁核(paraventricular nucleus, PVN)[25]、腹外侧核(lateral hypothalamic area, LHA)[26]、腹内侧核(ventromedial hypothalamus, VMH)[27],大脑边缘系统如海马[28]、CeA和外侧隔核等[29]。利用此特性学者们还可以研究调节胃运动的中枢神经通路及其肽能神经元的调控。有研究采用多管微电极中枢电生理结合胃运动曲线同步记录、神经逆行示踪,以及核团电刺激、电损毁和微注射等方法,证实 DVC-迷走神经-胃之间存在 1条调节胃运动和摄食的通路,且其效应受到高位中枢的调控,包括LHA-NTS神经通路[22]、LHA-PVN神经通路[25]、VMH-伏隔核(nucleus accumbens, NAc)神经通路[27]等;多种神经肽参与核团之间的信息传递,如胃动素[28]、生长素[22-23,26]、人摄食抑制因子1[25,27]和食欲素[24,29]等。
3.2 中枢核团参与针刺调节胃运动的机制研究
余芝[19]采用DMV微注射谷氨酸(glutamate, Glu)和γ-氨基丁酸(γ-aminobutyric acid, GABA),结合胃内压记录的方法,证实 DMV迷走-迷走反射可能不参与腹部腧穴(中脘和天枢)调控胃运动的中枢机制,但与足三里调节胃运动的效应相关。IWA M等[30]采用形态学方法发现,电针足三里可使NTS尾侧和DMV内c-Fos免疫阳性神经元明显增多,而电针天枢则主要集中在NTS中、尾部以及延髓头端腹外侧区内。已有研究采用放射免疫、免疫组化,结合胃内压记录等方法,发现针刺通过调节低位脑干 c-Fos、胶质纤维酸性蛋白和 OX42等表达,通过迷走神经发挥对胃运动的调节[31]。李江山团队采用PVN免疫荧光双标、高位颈髓横断,结合胃内压记录等方法,证实异神经节段腧穴对胃内压的调控依赖脊髓上中枢的参与,PVN的OT能神经元可整合足三里穴和胃内压变化的传入信息,而同神经节段腧穴则通过脊髓间反射可对其进行调控[32];进一步敲除OT基因可加速小鼠的胃排空,且影响部分穴位的针刺效应,这提示PVN的OT能神经元可能以神经及神经-内分泌的形式参与不同神经节段穴位对胃功能的调节[33]。申国明团队采用神经电生理和核团电损毁,结合迷走神经横断等方法,证实DVC是胃俞募配穴调节胃运动的重要中枢,且这种效应依赖迷走神经的完整性[34];进一步采用神经电生理、免疫印迹等方法证实,电针胃俞募穴对胃运动的调节效应可能是通过PVN-DVC-迷走神经-胃的通路实现,且与PVN的胃动素、胃泌素的表达有关[35];采用免疫组化、比色法、胃内留置球囊记录胃运动曲线等方法,证实DMV区Glu通过调控NMDA受体亚单位NR1及NR2A-2C参与电针胃俞募穴调节胃运动[36];采用免疫组化、应力传感器记录胃运动曲线等方法,证实电针胃俞募穴通过激活海马神经元,上调海马区NR2A,下调NR1及NR2B的表达实现对胃运动的调节[37];采用免疫组化、基于病毒载体的神经示踪技术、化学遗传激活病毒、胃排空率等方法,证实电针胃俞募配穴对胃运动的调控作用与 CeA-PVN GABA能神经通路有关[38]。
也有学者们采用神经电生理的方法,发现胃扩张和穴位针刺传入信息可在 DMV和 NTS[34,39]、前庭内侧核[40]、顶核[41]、CeA[42]、LHA[43-44]、PVN[45]等发生汇聚。但目前尚不明确针刺作用下不同核团的胃相关神经元主要通过哪类神经肽发挥调节胃运动作用;亦不明确针刺作用下不同核团之间的相互作用及神经通路。采用应力传感器记录胃运动曲线结合中枢放电同步记录技术是评价中枢调控胃运动功能的较好方法,而多数针灸相关的研究多采用胃排空率、胃内置球囊等方法,且多数研究是在麻醉后记录胃运动变化。因此有必要引入现代科学技术和检测手段,进一步探讨针刺对胃运动的调节机制。
4 小结与展望
中枢神经系统通过传入神经接受来自胃肠道的机械、化学性刺激(例如胃肠道扩张、盐酸、无水乙醇、福尔马林以及各种营养成分等)以及来自穴区的躯体感觉信息,经各级中枢整合后再通过自主神经系统或室周器以神经-内分泌的方式,将其调控信息传送到肠神经系统或直接作用于胃肠效应细胞,从而发挥针刺调节胃运动的效应。本文从外周传入、中枢整合和自主传出神经分析了针刺调节胃运动效应的可能机制。在不同情况下,针刺兴奋不同类型的外周感觉传入纤维,经各级中枢整合激发中枢的负反馈调节机制,通过交感和副交感神经,发挥对胃运动的良性调节效应。
目前针灸调节胃运动的机制已被大量研究从不同的层次、角度及方向所证实。无论中枢调控,还是外周调节,无论正常状态,还是病理状态,或者模式动物,均证实针刺能良性调节胃运动功能,但针刺对胃运动调节的关键环节是在外周还是在中枢,或者兼而有之尚不明确。尽管已有报道自主神经活动的4种方式(交感兴奋或抑制、副交感兴奋或抑制)在针刺效应中均可被证实[4]。但自主神经系统的各分支在发挥针刺调节胃运动时所起的作用以及它们之间的串扰对话尚未系统阐明。并且,已有报道支配胃的交感神经和迷走神经在NTS、VLM、PAG、CeA和下丘脑等核团均能产生交互作用[21](详见图1)。但目前,有关针刺对胃运动调节的中枢机制多以低位脑干和下丘脑为主,且多集中于单一核团及其递质、受体的作用,针刺调节胃运动的神经通路尚不够细致、具体,还需进一步深入探索。
