基于自噬与突触可塑性探讨电针治疗缺血性脑卒中的机制
2022-09-16李煜超王燕邹伟
李煜超,王燕,邹伟
(1.黑龙江中医药大学,哈尔滨 150040;2.宁夏医科大学,银川 750000;3.黑龙江中药大学附属第一医院,哈尔滨 150040)
电针是中医学临床治疗缺血性脑卒中(cerebral ischemic stroke, CIS)非常重要的治疗手段。已有研究证明,电针可通过抑制炎性反应、脑水肿形成,减轻氧化应激损伤、细胞凋亡,促进神经与血管再生等多种途径治疗 CIS[1]。此外,有报道[2-3]显示,电针可通过自噬和突触可塑性途径促进 CIS后神经恢复,但具体机制尚不完全清楚。笔者将从自噬途径和突触可塑性途径两方面对电针治疗 CIS的相关机制进行综述,并探讨自噬与突触可塑性在电针治疗 CIS过程中的联系,旨在进一步明晰电针治疗CIS的内在机制。
1 电针治疗CIS与自噬
1.1 CIS中影响自噬的因素
自噬是一种溶酶体降解途径,可以清除受损细胞内细胞器和异常折叠的蛋白质及细胞内病原体,对真核细胞生存、分化、发育及内环境稳态至关重要[4]。在饥饿、缺氧、营养缺乏和感染等应激条件下,自噬可被激活为细胞的生存提供营养和能量[5]。自噬有 3种常见类型,即巨自噬、微自噬和伴侣介导的自噬,其中巨自噬与CIS的研究最为广泛。巨自噬的发生发展(以下称为自噬)有多个阶段,包括自噬的启动、囊泡成核、扩张和成熟以及自噬小体的融合和降解[6-7]。相关研究发现,在CIS的发生和发展过程中,自噬与多种细胞内生物学过程相互作用,包括自由基积累、线粒体功能失调和内质网应激(endoplasmic reticulum stress,ERS)的激活。这些过程与自噬在调节神经细胞死亡或存活方面有着复杂的联系[8]。
CIS发生后,多种因素均可诱导自噬。当缺氧时,缺氧诱导因子(hypoxia inducible factor, HIF)被激活,HIF基因依赖性产物 B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)/腺病毒 E1B相互作用蛋白3(adenovirus E1B 19 kDa interacting protein 3,BNIP3)增加,BNIP3能竞争性结合Bcl-2,使 Beclin-1被释放,从而启动自噬[9]。缺血发生后,出现能量供应不足,单磷酸腺苷(adenosine monophosphate, AMP)与三磷酸腺苷(adenosine triphosphate, ATP)比值增大,AMP激酶(AMP-activated protein kinase, AMPK)被激活,AMPK可直接抑制雷帕霉素机能靶标蛋白复合物1(mechanistic target of rapamycin complex 1,mTORC1)并且磷酸化unc-51样自噬激活激酶1(unc-51 like autophagy activating kinase 1, ULK1)来启动自噬[10-11]。ERS出现时,内质网膜驻留蛋白肌醇依赖酶1α(inositol-requiring enzyme 1α, IRE1α)和RNA依赖性蛋白激酶(double-stranded RNA-dependent protein kinase, PKR)样内质网激酶(PKR-like ER kinase, PEPK)被激活,它们可感知内质网管腔中未折叠蛋白的存在。激活的IRE1α通过激活c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)介导的Bcl-2磷酸化导致Beclin-1/Bcl-2复合物的破坏,从而释放自由的Beclin-1参与自噬体成核。PERK使真核起始因子 2α亚基(eukaryotic initiation factor 2α,eIF2α)磷酸化,磷酸化的 eIF2α通过上调自噬基因相关蛋白 12(autophagy-related protein 12, Atg12)的表达或促进 Atg5-Atg12-Atg16复合物形成参与自噬体膜的延伸。此外,ERS增加了细胞中钙离子浓度,从而激活了AMPK途径,缓解了mTOR对ULK1的抑制作用[12]。脑缺血性卒中后自噬过程见图1。
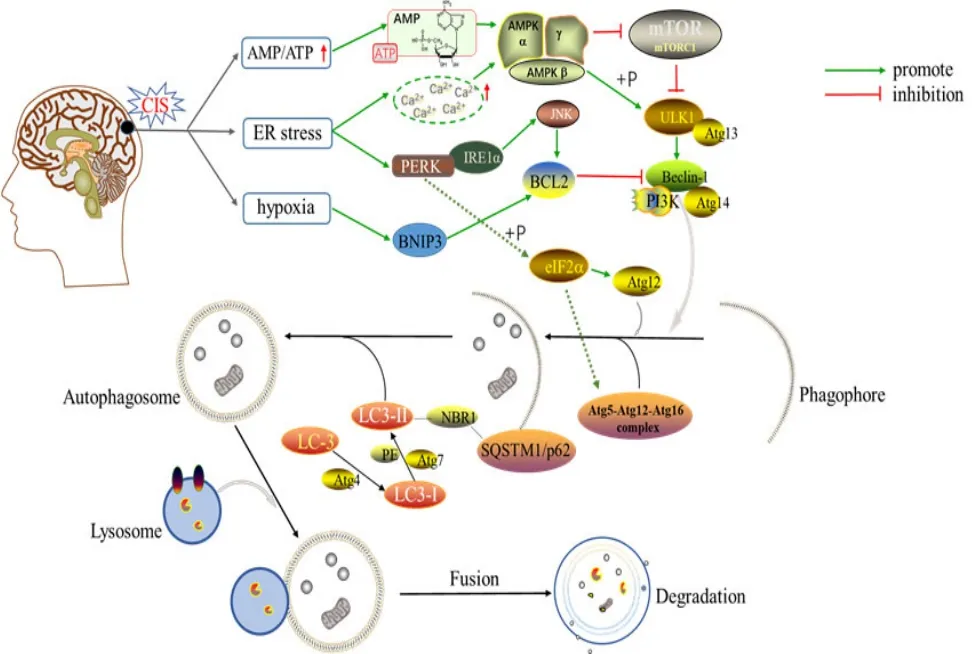
图1 脑缺血性卒中后自噬过程
1.2 自噬在电针治疗CIS的作用
电针治疗 CIS对自噬的调节取决于时间节点[13],CIS发生2 h后,电针可促进自噬对抗神经损伤;而在24 h后,电针通过抑制自噬达到神经保护作用。此外,有学者[14]认为自噬在CIS过程中起双重作用,适度的自噬对神经元起保护作用,而过度的自噬导致细胞损伤死亡。CHEN C等[15]研究发现,电针预处理通过抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK3β),经 Wnt通路抑制自噬,从而诱导对脑缺血的耐受。黄亚光等[16]于术前5 d通过电针百会及双侧足三里、曲池等穴对右侧大脑中动脉梗死(middle cerebral artery occlusion, MCAO)大鼠模型进行预处理,发现电针预处理治疗 CIS的机制可能通过抑制自噬发挥神经保护作用。WANG M M等[17]观察电针足三里和曲池穴对MCAO大鼠磷脂酰肌醇3-激酶(phosphatidylin-ositol-3-kinase, PI3K)/蛋白激酶B(protein kinase B, PKB或Akt)/mTOR通路的影响,于造模后24 h进行电针治疗,发现电针可能通过调节PI3K/AKT/mTOR通路来抑制神经元自噬达到减少神经元死亡的作用。
有研究表明,减轻 ERS可有效缓解脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)[18-19]。SUN X等[20]研究发现电针对CIRI损伤的神经保护主要是通过抑制ERS介导的自噬和细胞凋亡发挥作用。CIRI的发生促进了大量的促炎介质分泌,包括IL-6、IL-1β和TNF-α。有文献证明,促炎性细胞因子可进一步促进嗜中性粒细胞和巨噬细胞浸润到受损组织和炎症反应中,导致炎症反应发生和发展的恶性循环[21]。TING Z等[22]研究发现,电针治疗CIS可以减轻缺血再灌注引起的炎症反应。MATSUZAWAISHIMOTO Y等[23]认为自噬主要通过抑制炎症小体,多蛋白复合物,以及通过自噬依赖性和非依赖性机制抑制I型干扰素(type I interferon, IFN-1)的产生来抑制炎症。WANG X等[24]在研究心肌梗死炎症与自噬时发现,自噬信号的早期增加和随后的下降与促炎信号的出现保持一致,表明这两种现象之间存在密切联系。以上研究为电针调节自噬抑制缺血性脑卒中引起的炎症提供了理论基础。
自噬相关蛋白是哺乳动物细胞自噬程序正常执行所必需的。电针可以通过调节自噬相关蛋白来减少CIS的神经细胞损害。XU S Y[25]等研究发现,CIS早期给予电针治疗,可以提高LC3-Ⅱ、Beclin1的表达促进自噬来改善MCAO大鼠神经功能障碍评分。另有研究[26]显示,卒中后 24 h电针曲池和足三里穴可显著提高mTORC1水平,从而导致ULK复合物失活,并抑制脑梗死后皮层中 Beclin1的磷酸化,提示电针通过抑制自噬小体的形成以及自噬而保护脑神经。CIS后线粒体受到破坏时,PTEN诱导的激酶1(PTEN-induced kinase 1,PINK1)会介导Parkin磷酸化,激活的Parkin介导线粒体外膜蛋白泛素化而促进线粒体自噬[27-29]。WANG H等[30]研究发现电针可改善自噬溶酶体途径功能紊乱,通过PINK1/Parkin介导的线粒体自噬清除作用,减轻一氧化氮/氧化应激诱导的线粒体功能损伤,改善受损线粒体的积累,从而保护神经元免受CIRI。
2 突触可塑性与CIS
2.1 CIS影响突触可塑性的因素
突触可塑性是指在内环境或外环境变化时,突触在结构和功能上产生适应性改变的能力。在生理条件下,该过程与大脑发育,学习和记忆有关。在病理情况下,它参与脑损害的恢复[31]。LISMAN J[32]认为突触可塑性的主要表现形式为短时程增强、早期长时程增强、晚期长时程增强、长时程抑制、距离依赖性缩放、稳态突触缩放。
CIS后会导致突触结构和功能的改变。谷氨酸是哺乳动物中枢神经系统的主要兴奋性神经递质,N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体和 a-氨基-3-羟基-5-甲基-4-异恶唑丙酸(alphaamino-3-hydroxy-5-methyl-4-isoxazolepropionic acid, AMPA)受体被认为是介导快速兴奋性突触传递的主要离子型谷氨酸受体[33]。AMPA受体在突触后膜上稳定表达促进突触传递的LTP,参与对大脑学习、记忆等认知功能的调节[34]。相关研究表明,慢性脑缺血可引起AMPA受体的谷氨酸受体2(glutamate receptor 2,GluR2)亚基内化增多,该亚基调控与钙离子信号相关的突触功能,导致钙离子内流增加,使得细胞内一氧化氮水平增加,抑制线粒体的转运功能,造成细胞内 ATP水平迅速下降,这一系列的调控机制最终损害神经突触功能[35]。此外,该研究还提到脑缺血后蛋白激酶 C相互作用蛋白 1(protein interacting with C-kinase 1, PICK1)表达升高,PICK1是一种普遍存在的膜结合蛋白,它的PDZ结构域能与AMPA受体的GluR2亚基 C末端结合,使 GluR2内吞,导致突触后膜上含GluR2亚单位的 AMPA受体减少,影响突触传递的功能[36]。树突棘是树突上的小突起,是大多数兴奋性突触的突触后位点,参与突触信号的传递和整合,突触的强度和活性与树突棘的形态密切相关[37]。大脑皮质和海马是机体最易受氧化应激和脑缺血缺氧损伤的区域,有学者研究了亚急性期到慢性期双侧感觉运动皮层和海马树突和树突棘的动态变化,发现急性脑卒中后双侧感觉运动皮层和海马的树突和树突棘均有不同程度的损伤,脑卒中后同侧和对侧感觉运动皮层树突棘密度明显降低[38-39]。
2.2 突触可塑性在电针治疗CIS的作用
潘爱环[40]观察电针百会、大椎和肾俞穴联合有氧运动对脑缺血模型大鼠认知功能、海马组织形态学的影响,发现该疗法能抑制PICKl的过表达,调节突触后膜上AMPA受体的分布,从而改善慢性脑缺血导致的认知障碍。此外,电针可能通过抑制海马CA1区嘌呤能受体 P2X配体门控离子通道 7(purinergic-receptor-P2X ligand-gated ion channel 7, P2X7R)的表达,促进突触囊泡膜蛋白和突触素的表达,改善突触超微结构,促进突触可塑性,进而改善大鼠的学习记忆功能[41]。
突触后密度蛋白-95(postsynaptic density protein-95, PSD-95)是膜相关鸟苷酸激酶超家族的成员,是突触后致密物中最丰富的支架蛋白,可连接谷氨酸受体、信号分子,以及其他结构蛋白,超过 95%的PSD-95表达定位于兴奋性突触[42]。BÉÏQUE J C等[43]研究发现PSD-95的短期过表达通过选择性促进AMPA受体介导的突触传递和显著增加这些突触表达LTD的能力,从而明显改变皮质间突触的特性。突触素(synaptophysin,SYP)是突触前膜的特异性标志,可以促进突触的形成,参与神经的修复、再生和突触重塑[44-45]。郭斌等[46]研究发现,电针曲池和阳陵泉穴能够升高大脑中SYP和PSD-95含量,促进了皮质突触的重塑,从而改善中枢神经系统的运动功能。
突触素P38是一种与突触结构和功能密切相关的钙结合蛋白,参与钙离子依赖神经递质乙酰胆碱和谷氨酸的释放,还参与了神经元间信息的传递,对突触传递效能的变化有明显影响[47]。生长相关蛋白43(growth-associated protein-43, GAP-43)也被称为神经调节蛋白,是伸长轴突和未成熟突触终末的运动生长锥的主要成分[48]。在神经元的发育和再生过程中,GAP-43伴随着轴突的生长在神经组织内大量合成[49]。有研究[50]表明,电针可以通过提高突触素 P38和 GAP43在缺血中心区周围皮层的表达,保护缺血性脑损伤。
3 电针治疗CIS过程中自噬与突触可塑性
近些年有较多学者分别研究了CIS中自噬及突触可塑性对神经元的不同调节机制,发现自噬和突触可塑性在缺血性脑卒中恢复过程中有重要作用。先前的研究提示自噬与突触可塑性之间具有密切关系[51],而CIS后功能失调的自噬可能会引起一些突触蛋白的紊乱,从而导致突触功能障碍。有学者研究发现,自噬与突触相关蛋白的表达呈负相关,应用自噬抑制剂后突触相关蛋白的表达增加,而应用自噬激活剂后突触相关蛋白的表达下降[52]。因此,自噬与突触可塑性的联系在电针治疗CIS的过程中值得探究。
3.1 CIS后自噬与突触可塑性的联系
CIS后,由于脑组织缺血缺氧,增加了血管性痴呆(vascular dementia, VD)风险。有研究发现,自噬对VD大鼠海马CA1区突触可塑性相关蛋白GAP-43、SYP、PSD-95表达具有抑制作用,抑制自噬有利于VD大鼠海马CA1区神经突触重塑[53-54]。此外,自噬的诱导与AMPA受体亚基GluR1降解相关,在化学性LTD刺激神经元后,锥体神经元树突和棘中的自噬体形成增加,使得 AMPA受体导向溶酶体从而降解[55],最终影响突触可塑性。ZHANG X等[56]基于大鼠海马神经元缺氧-葡萄糖剥夺(oxygen-glucose deprivation, OGD)模型和MCAO小鼠模型研究了缺氧缺血应激对自噬和突触结构的影响,实验发现缺血应激后出现功能性溶酶体储存异常并伴有突触功能障碍,具体表现为自噬短暂上调后出现溶酶体功能的紊乱,突触蛋白1、突触囊泡蛋白Ⅰ、TUBB3和突触体相关蛋白 25等突触功能相关蛋白表达的下调和蛋白质稳态破坏的相继发生。此外,突触中的自噬效应能降解SHANK3、PSD-95和PICK1等关键突触后蛋白[57]。另有研究显示,MCAO小鼠急性缺血后出现溶酶体相关膜蛋白 1的聚集和突触超微结构的损伤,作者通过检测突触结构发现突触功能障碍伴随着溶酶体功能的改变,说明突触蛋白动态转换中的自噬依赖性损伤可能是突触部位超微结构改变的原因,且溶酶体功能障碍可能是缺血应激条件下突触功能障碍的分子基础。
3.2 自噬与突触可塑性在电针治疗缺血性脑卒中的作用
脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)作为一种治疗脑损伤或神经退行性疾病的药物已显示出良好的前景,因为它可以改善认知功能,减少病理变化,防止神经元死亡[58]。BDNF作为突触强度的活性依赖性修饰的关键介质,已知可增加突触小泡的数量,并增强神经递质的释放。有研究指出,BDNF以其受体激酶 B(tropomysin related kinase B, TrkB)与PI3K途径发生作用激活mTOR,从而抑制自噬来调节突触可塑性[58]。ZHANG Y等[59]研究发现电针可以通过上调 BDNF的表达来抑制缺氧缺血大鼠海马细胞死亡。另外,电针百会穴对MCAO模型大鼠进行干预,可以通过 BDNF/TrkB通路的表达促进脑缺血大鼠运动功能的恢复[60]。WANG H等[30]观察了脑缺血再灌注过程中线粒体功能的损伤和受损线粒体的积累,发现电针对这两种损伤均有改善,作用机制可能是通过PINK1/Parkin介导的线粒体自噬,提高自噬清除率从而改善受损线粒体的积累。CIS后出现线粒体功能障碍和线粒体累积,这种线粒体的异常导致突触功能出现障碍[61],而线粒体自噬作为线粒体质量和数量的重要调节因素,可以有效改善线粒体功能[62]。通过线粒体自噬对线粒体的良性调节,可以支持突触功能的恢复[63],为电针治疗 CIS通过线粒体自噬改善突触可塑性提供了理论依据。慢性脑缺血可引起突触后膜上AMPA受体损伤,这种损伤可能是通过 PI3K-Akt-mTOR途径介导自噬引起,应用 PI3K抑制剂能抑制自噬,部分恢复AMPA受体水平[55]。另有研究[17]发现,在CIS的治疗过程中,电针可以通过 PI3K-Akt-mTOR通路抑制自噬,从而可能使 AMPA受体水平恢复,进一步调节突触功能。
4 讨论
自噬和突触可塑性在 CIS恢复过程中有重要作用。目前自噬和突触可塑性相关分子机制的研究尚处于探索阶段,研究学者大多侧重于对单个途径的机制研究,而关于两者或多个途径之间联系的报道较少,尤其是在电针治疗CIS机制探讨方面。本文从自噬和突触可塑性两方面分别综述了电针治疗CIS的不同机制,发现自噬在缺血早期可能对神经元起保护作用,而在再灌注期会导致细胞过度损伤而引起神经细胞死亡。电针治疗作为缺血性脑卒中后神经功能恢复的重要干预手段,不仅可以促进自噬去除病理产物,还能抑制自噬抵抗不同疾病时期的细胞死亡,并且通过调节自噬抑制缺血性脑卒中引起的炎症。自噬可以维持突触的完整性和功能。此外,缺血性脑卒中后会出现突触结构和功能的改变,电针干预后能促进突触囊泡膜蛋白和突触素的表达,改善突触超微结构。
通过进一步探讨自噬与突触可塑性在电针治疗CIS中的联系,发现功能失调的自噬会引起一些突触蛋白的紊乱,从而导致突触功能障碍。自噬对突触可塑性相关蛋白表达具有抑制作用,突触中的自噬效应能降解关键突触后蛋白。电针可以通过刺激 BDNF/TrkB的表达来抑制自噬从而调节突触可塑性。在脑缺血损伤中,随着活性氧、缺血/再灌注或毒素的刺激,导致线粒体和线粒体自噬功能的损伤。线粒体自噬途径对维持突触功能至关重要,而电针治疗 CIS可通过调节线粒体自噬调节突触可塑性。此外,电针可能抑制自噬提高AMPA受体的水平调节突触功能。综上所述,电针不仅可以通过分别调节自噬和突触可塑性途径促进 CIS后神经恢复,并且在自噬和突触可塑性的关联机制中发挥重要的调节作用。基于电针治疗具有多靶点、多途径的特点,从自噬和突触可塑性及其联系等多角度揭示电针对缺血性脑卒中的作用机理,对中医学治疗手段的现代化发展具有重要意义。
