卡罗藻有毒株与无毒株对菲律宾蛤仔的生长、存活及生理生化的影响
2022-09-16吴延华梅丽敏潘渊博徐建峰周成旭
吴延华 ,郭 贺 ,梅丽敏 ,潘渊博 ,徐建峰 ,周成旭,4*
(1.宁波大学 食品与药学学院,浙江 宁波 315832;2.宁波大学 海洋学院,浙江 宁波 315832;3.福建省连江县水产技术推广站,福建 连江 350500;4.宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315832)
微藻是滤食性贝类的重要食物来源,其组成结构影响着养殖贝类的产量和品质[1-5].有毒有害微藻存在时,贝类可能减少或避免摄食[6-7],生长率下降,甚至死亡[8-9].
甲藻是海洋微藻的主要类群之一,有些种类具有明确的毒素,而有些种类没有毒素.卡罗藻属(Karlodinium)是一类沿海养殖水域广泛分布的小型裸甲藻[10-13].其中,剧毒卡罗藻(Karlodinium veneficum)能分泌卡罗藻毒素(Karlotoxins)[13-15],具有多种毒性特征,在全球各大洲沿海水域赤潮时,能致死养殖生物[16-21].周氏卡罗藻(Karlodinium zhouanum)是一种无毒的卡罗藻[22],与剧毒卡罗藻具有一致的细胞大小和形态特征.2 种卡罗藻在中国南北沿海水域均有广泛分布[22-23].在早期研究中,由于卡罗藻细胞微小,常规镜检方法不易检出而常被忽视.近年来在我国沿海水域,卡罗藻属种的分布和生物量上升,赤潮发生并致害事件也呈增加趋势[19,24-25],对生态环境和不同海水养殖生物的影响还需大量研究.对有毒甲藻毒素的食物链累积、致害机制、赤潮时的生态效应等研究较多,但对非赤潮密度时的作用以及对有毒和无毒甲藻类影响贝类生长、生理生化代谢的比较等方面研究尚存不足.
菲律宾蛤仔(Ruditapes philippinarum)是典型滤食性双壳贝类,在我国沿海滩涂分布广泛,是重要养殖物种,其养殖规模和产量均位列前茅[26].由于滤食性贝类的摄食受到食物颗粒形态、大小等的影响,在以摄食率和滤水率等摄食生理指标为研究目标时,以颗粒大小、形态一致的藻种做比较研究为宜.本文以菲律宾蛤仔为研究对象,比较分析产毒和不产毒卡罗藻对菲律宾蛤仔生长、存活、摄食生理的影响及其差异,并对不同组织中的糖原含量在摄食前后的变化特征进行解析.研究的主要目的: (1)比较2 种细胞颗粒大小、形态完全一致的有毒和无毒甲藻对菲律宾蛤仔生长及生理生化的影响;(2)初步探究卡罗藻属种对菲律宾蛤仔潜在的影响效应机制.研究结果可为评价该属种赤潮甲藻对双壳类养殖生产的影响提供科学依据.
1 材料与方法
1.1 卡罗藻藻种
2 种卡罗藻均分离自东海养殖水域,为宁波大学微藻种质库保存藻种,分别为有毒的剧毒卡罗藻(库存编号NMBjah047-1,株系编号GM2)和无毒的周氏卡罗藻(NMBjah056-9,株系编号GM17).藻种扩大培养至足量以用于实验.
1.2 有毒和无毒卡罗藻对菲律宾蛤仔稚贝生长和存活的影响
菲律宾蛤仔稚贝采自于福建宁德育苗场,平均壳长约(2.62±0.19)mm,壳高约(2.16±0.18)mm.在实验室暂养期间,投喂球等鞭金藻(Isochrysis galbana),隔天换水,连续充气.
生长实验前,以筛网筛取大小均匀的稚贝.在白色塑料方盆中加入5 L 过滤海水(盐度25),均匀撒入2 g 的稚贝.分为2 组,各组3 平行,投喂有毒或无毒卡罗藻.每天定时投喂2 次(8:00 和20:00),每次投喂使水体中的藻密度约为2×106~2.5×106cells·L-1.充气培养,隔天更换海水,同时随机取稚贝于显微镜下测量10 粒活贝的壳长和壳高,计算其相对规格大小(壳长×壳高,mm2),测量完成后,稚贝放回对应实验组.
稚贝相对生长率R= (St-St-1)/St-1×100%,式中,St为t时间点的规格大小,St-1为t时间点前一个采样时间点的规格大小.
投喂9 d 后,各组分别随机取样,计数100 粒稚贝,其中空壳记为死亡个体,以计算存活率,重复3 次计数.
1.3 有毒和无毒卡罗藻对菲律宾蛤仔滤水率和摄食率的影响
1.3.1 成贝摄食率和滤水率
成贝取自福建定海湾贝类养殖基地,选取健康活力好的个体,放入塑料盆中驯养1 周,以球等鞭金藻投喂.驯养期间每天换水1 次.实验前,放入抽滤海水中饥饿24 h.实验用成贝平均规格大小即壳长、壳宽、壳高分别约为33、22、14 mm,湿重约(6.6±0.6)g.
预实验确定菲律宾蛤仔摄食2 种微藻在1 h 内不产生假粪的最大藻密度,以排除藻密度过高造成贝类形成假粪的影响.正式实验时,设置藻密度梯度为10×105、15×105、20×105、25×105、30×105cells·L-1,各密度组投放3 个成贝,不投放菲律宾蛤仔的对应藻密度组为无摄食对照组.水体体积1 L,各组3 平行.实验于控温培养室(23±2)℃进行,海水盐度25,pH 值7.82.
经1 h 后,取2 mL 各实验组藻液,以20µL 鲁哥氏碘液固定,用浮游计数框计数藻细胞密度.贝类滤水率和摄食率计算公式如下[27-28]:

式中:VFR为一个菲律宾蛤仔(shell)单位时间(h)的滤水体积(滤水率,L·(shell·h)-1);V为藻液体积(L);n为菲律宾蛤仔数目(个);t为试验持续时间(h);C0、Ct分别为实验起始和t时间的微藻密度(cells·mL-1);S为无摄食对照组微藻的变化系数;C1和C2分别为对照组起始和t时间后的微藻密度(cells·mL-1);IIR为一个菲律宾蛤仔(shell)单位时间(h)摄食的藻细胞数(摄食率,cells·(shell·h)-1).
1.3.2 稚贝摄食率和滤水率
稚贝材料与生长实验相同.实验前,将稚贝于抽滤海水中饥饿24 h.摄食实验时,设置卡罗藻密度梯度5×105、10×105、15×105、20×105、25×105cells·L-1,藻液体积1 L,各密度组放入2 g 稚贝,不加稚贝的对应藻密度组为无摄食对照组,各组3 平行.实验与成贝相同环境下进行.1 h 后,各实验组取2 mL 藻液,以20µL 鲁哥氏碘液固定,浮游植物计数框计数藻密度.稚贝滤水率和摄食率计算同成贝,其中,贝类生物量为质量(g),因此,稚贝滤水率和摄食率单位分别为L·(g·h)-1和cells·(g·h)-1.
1.4 菲律宾蛤仔摄食有毒和无毒卡罗藻时各组织糖原的变化
利用成贝摄食实验的贝类样品进行分析.摄食实验结束后,取摄食前以及3 组不同藻密度(10×105、20×105、30×105cells·L-1,记为低、中、高密度)实验组的成贝,置于冰面上及时解剖,取闭壳肌、外套膜、足、肝胰腺组织,将各组3 只菲律宾蛤仔的相同组织分别混合后,置于-80 ℃冰箱保存,待测其糖原.
糖原含量采用蒽酮比色法测定[29].精确称取待检组织各100 mg,加入8 mL 5%(体积百分比)三氯醋酸,匀浆1 min,以3 000 r·min-1离心匀浆液15 min,取1 mL 上清液放入10 mL 离心管中,加入4 mL 95%(体积百分比)乙醇,将试管放置在37~40 ℃水浴锅中水浴加热3 h.沉淀完全后,3 000 r·min-1离心15 min,弃上清液,离心管倒立放置10 min.加入1 mL蒸馏水溶解糖原后,加入5 mL蒽酮硫酸试剂,搅拌均匀,沸水浴中反应15 min(反应液呈蓝绿色)后,在流水下迅速冷却以停止反应.以酶标仪测定620 nm 吸光值.根据标准曲线计算糖原含量.
标准曲线制定: 配制葡萄糖质量浓度梯度为0.2、1.0、1.8、2.6、3.4、4.2、5.0 mg·mL-1的工作溶液各1 mL,加入5 mL 蒽酮硫酸试剂,沸水浴15 min,取出后迅速于流水下冷却以停止反应.酶标仪测定620 nm 吸光值.以1.0 mL 蒸馏水同样方式操作,作为空白对照.
1.5 数据统计分析
结果数据以“平均值±标准偏差”表示.SPSS 19.0对实验组间结果进行One-Way ANOVA单因子方差分析.显著水平设置为P<0.05.
2 结果
2.1 有毒和无毒卡罗藻对菲律宾蛤仔稚贝生长和存活的影响
2 组甲藻投喂菲律宾蛤仔,其大小变化如图1所示.在相同的策略下投喂9 d 后,相对于初始规格,无毒藻组(GM17)和有毒藻组(GM2)分别增长了16%±2.6%和8%±1%.由图可见,在投喂初期(1~3 d)和后期(7~9 d),每2 d 的相对生长率均呈现GM17 组显著大于GM2组(P<0.05),大小规格也是GM17 组显著大于GM2 组(P<0.05).在第5 天和第7 天时,2 组的规格大小和相对生长率没有显著差异(P>0.05).

图1 GM2 和GM17 投喂下稚贝的规格和相对生长率
从稚贝存活结果来看,在相同投喂策略下,稚贝生长8 d后,GM17组存活率约76.3%±3.2%,GM2组约为58.0%±2.6%,有毒组显著低于无毒组(P<0.05).
2.2 有毒和无毒卡罗藻对菲律宾蛤仔成贝的滤水率和摄食率的影响
由图2 可见,在2 种卡罗藻液中,菲律宾蛤仔的滤水率随藻密度增加而增加,在出现最大滤水率后,滤水率下降.GM2 组中,最大滤水率为(0.28±0.03)L·(shell·h)-1,出现在藻密度为15×105cells·L-1的实验组;GM17 组中,最大滤水率为(0.46±0.03)L·(shell·h)-1,出现在藻密度较高的实验组(20×105cells·L-1).GM17 组滤水率均大于GM2 组.在最低实验藻密度组中(10×105cells·L-1),GM2 组滤水率已出现显著低于GM17 组(P<0.05).除藻密度为15×105cells·L-1的实验组以外(P>0.05),在其他更高密度下,GM2组滤水率均显著低于GM17组滤水率(P<0.05).

图2 不同密度的GM2 和GM17 中成贝的滤水率
菲律宾蛤仔摄食率与藻密度的相关特征如图3所示.较低藻密度中(10×105~15×105cells·L-1),2 组贝类摄食率相同.当藻液密度大于15×105cells·L-1后,随着藻密度增加,摄食率出现差异.与滤水率不同,实验藻密度范围内,摄食率未出现增加至最大值后下降的趋势.GM17 组摄食率随藻密度增加而增加.GM2 组中摄食率增加幅度降低,各密度下,其摄食率均显著低于GM17 组摄食率(P<0.05).
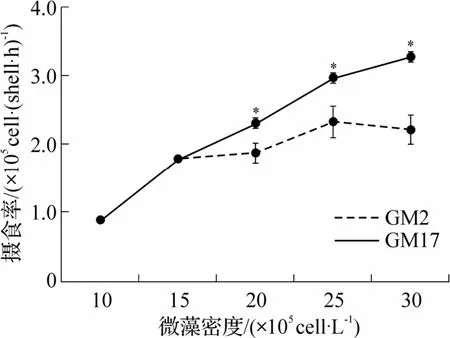
图3 不同密度的GM2 和GM17 中成贝的摄食率
2.3 有毒和无毒卡罗藻对菲律宾蛤仔稚贝摄食率和滤水率的影响
稚贝滤水率和摄食率与卡罗藻密度相关,藻密度小于15×105cells·L-1时,滤水率和摄食率随藻密度增加而增加(图4 和图5);与成贝不同,稚贝摄食率和滤水率均在相同藻密度(15×105cells·L-1)达到最大.无毒藻组(GM17)中,最大滤水率和摄食率分别为(0.46±0.04)L·(g·h)-1和(7.00×105±0.63×105)cells·(g·h)-1;有毒藻组(GM2)中,分别为(0.37±0.02)L·(g·h)-1和(5.65×105±0.41×105)cells·(g·h)-1.藻 密度进一步增加(>15×105cells·L-1)时,滤水率和摄食率均下降,并在2 种藻液中具有相同下降特征,呈现幂函数相关特征.当藻密度低于15×105cells·L-1时,2 组滤水率和摄食率无显著差异(P>0.05).藻密度大于15×105cells·L-1以后,GM2 组滤水率和摄食率均显著低于GM17 组(P<0.05).

图4 不同密度的GM2 和GM17 中稚贝的滤水率

图5 不同密度的GM2 和GM17 中稚贝的摄食率
2.4 摄食有毒和无毒卡罗藻时菲律宾蛤仔成贝各组织糖原的变化
糖原含量分析的工作曲线如图6 所示.实验检测的OD 值范围内,糖原量与吸光值的关系式为:
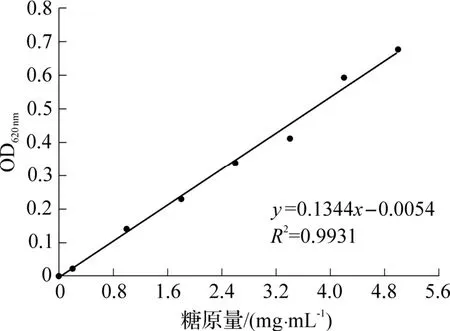
图6 糖原量分析的工作曲线

式中:y为OD620nm;x为糖原量(mg·mL-1).
摄食前以及低、中、高藻密度组摄食1 h 后,菲律宾蛤仔各组织糖原含量结果如图7 所示.不同组织糖原含量水平不同,其中,外套膜具有最高糖原相对含量(约640~1 890 mg·g-1),其次为足(约140~600 mg·g-1)和闭壳肌(约100~220 mg·g-1),肝胰腺糖原相对含量最低(约18~60 mg·g-1).除高藻密度下GM2 组的外套膜和闭壳肌糖原含量与未摄食组没有显著差异外(P>0.05)(图7(a)、(c)),摄食后,组织中的糖原均出现显著增加(P<0.05).摄食1 h 后,GM17 低藻密度组外套膜中糖原含量最高,且显著大于GM2 低藻密度组(P<0.05);中、高藻密度组中,GM17 和GM2 糖原含量没有显著差异(P> 0.05)(图7(a)).足的低藻密度组中,GM17 组和GM2 组的糖原含量没有显著差异(P>0.05),高密度组中,GM2组显著低于GM17组(P<0.05)(图7(b)).各藻密度组的闭壳肌和肝胰腺中(图7(c)、(d)),GM17 和GM2组的糖原含量均未呈现显著差异(P> 0.05).

图7 菲律宾蛤仔摄食不同密度GM2 和GM17 后各组织的糖原量
研究结果显示,有毒和无毒卡罗藻对菲律宾蛤仔生长、存活以及摄食生理产生了不同的影响.有毒种使菲律宾蛤仔生长和存活率显著降低,并使其滤水率和摄食率显著下降,与藻密度相关性发生变化,且对菲律宾蛤仔软组织糖原的存储和组织间分布产生了影响.
3 讨论
滤水率和摄食率是反映贝类摄食生理的重要指标[30].环境颗粒物的大小、密度、形态、生化成分等都是影响贝类摄食生理的重要因子[2-5],摄食有毒有害颗粒物时,贝类生长、存活及摄食生理代谢等方面会发生显著改变[6-7].本研究显示,在细胞大小、形态和投喂策略完全一致的情况下,2 种卡罗藻对菲律宾蛤仔成贝摄食生理产生了显著不同的影响,与其含毒与否显著相关.Binzer 等[9]就卡罗藻属另一有毒种(K.armiger)对紫贻贝(Mytilus edulis)成贝的影响研究发现,相对于贝类喜食的无毒隐藻对照组,贻贝在卡罗藻藻密度大于1.5×106cells·L-1时,开始避免滤食(相当于本文中成贝实验密度1×106~3×106cells·L-1);密度约为3.6×107cells·L-1时(大于本文中成贝实验密度1×106~3×106cells·L-1),贻贝在24 h 和48 h 出现不同程度的死亡.塔玛亚历山大藻(Alexandrium tamarensis)也是一种赤潮甲藻,具有有毒和无毒生态型,不同双壳贝类的摄食活动对该藻的响应不同,且与海域相关[31];不同贝类摄食生理受到不同影响时,有滤水率升高的,也有降低的;而有的贝类可能发展了某种适应机制,能够适应此赤潮种类,而没有受到任何不利影响[31].本研究中,从摄食率响应藻密度增加的变化关系来看,菲律宾蛤仔成贝较稚贝对高密度卡罗藻具有更高的耐受力.高藻密度影响下,其摄食率未下降,但稚贝摄食率显著下降.虽然不同微藻对养殖生物的影响效应不能在绝对细胞密度上进行比较,且贝藻相互作用关系具有种类特异性[32].但研究结果均显示,产毒甲藻对贝类的摄食生理过程产生了影响.本研究显示,菲律宾蛤仔在摄食卡罗藻有毒和无毒种时,其滤水率和摄食率始终是无毒组高于有毒组.可见其对于卡罗藻的无毒种和有毒种具有不同的摄食活力.但如果需要完全明确2 种株藻共存时,菲律宾蛤仔是否有偏爱滤食,目前尚难以在实验中做到,原因是此2 种藻在显微镜镜检条件下无法进行区分.因此,需要在今后的研究中进一步提高外形无法区分的藻株识别技术,比如采用特异性的荧光标记或分子探针技术等,以明确其对有毒株和无毒株共存时摄食偏好问题.
2 种卡罗藻在不同程度上支持菲律宾蛤仔个体生长,但生长率和存活率均显著不同,且摄食后,短期内即表现出糖原存储差异,说明有毒与无毒卡罗藻使菲律宾蛤仔在生化代谢层面上也发生了变化.糖原主要参与贝类的能量代谢[33-34],其含量在生理代谢过程中变化迅速[35-36],是评价贝类营养健康状况的重要指标.尚未见关于贝类摄食不同微藻短期内造成各组织糖原含量变化的报道.Galimany 等[37]对剧毒卡罗藻影响紫贻贝贝苗的免疫功能和组织病理学变化进行了研究.投喂的剧毒卡罗藻终密度为(6.25×104cells·L-1),小于本研究稚贝实验中的藻密度(2×106~2.5×106cells·L-1),并且为每天1 次投喂.投喂3 d 后,贝类已显示免疫功能受到影响,6 d 暴露后,血细胞释放活性氧增加.本研究中,菲律宾蛤仔摄食2 种卡罗藻1 h 后,糖原含量均有不同程度的上升,说明在获得可摄食颗粒后,饥饿的菲律宾蛤仔迅速启动了糖原储存机制.并且低藻密度组的贝类摄食率和滤水率均没有显著差异,但有毒藻组外套膜糖原含量显著小于无毒藻组,说明在相同摄食率情况下,有毒卡罗藻可能对糖原存储和相关代谢过程产生了影响.Tatsuya[38]研究发现,菲律宾蛤仔不同组织的糖原含量具有差别,外套膜糖原在生理活动中变化迅速.本研究结果显示,菲律宾蛤仔外套膜糖原含量最高,且与有毒和无毒卡罗藻的影响显著相关.在所有藻密度组中,肝胰腺和闭壳肌的糖原没有显示有毒和无毒组的差异,且其糖原含量相对低,也可能说明2 个组织中的糖原代谢响应不如外套膜迅速.由于剧毒卡罗藻不仅细胞内含毒,且毒素释放到环境水体,还具有主动猎食多细胞动物的行为[13],使其贝藻相互作用过程较为复杂.在高密度组中,可能在过高的藻密度及毒素的作用下,对菲律宾蛤仔不同组织及其他生理生化过程造成了影响,其机制尚待研究挖掘.但本研究显示,饥饿处理的菲律宾蛤仔可在摄入卡罗藻后,迅速储存糖原,说明2 种甲藻提供了菲律宾蛤仔能量代谢的物质基础,但有毒种可能造成其糖原累积以及组织间分布不同.
本研究结果显示,常以非赤潮密度分布于海水养殖水域中的剧毒卡罗藻可能通过影响滤食性贝类的摄食生理活动及糖原等生化代谢过程对贝类的生长和存活产生影响,在沿海养殖水域中剧毒卡罗藻生物量趋于增加的背景下,该藻对贝类养殖业的影响值得关注.
