镉胁迫下姬松茸菌株转录组测序及分析
2022-09-16张宇慧马鑫旺夏志兰黄民凤苏荣荣
张宇慧,马鑫旺,夏志兰,黄民凤,苏荣荣
(1. 湖南省农业产业化发展服务中心,湖南 长沙 410006;2. 湖南农业大学,湖南 长沙410128;3.贵州黔西南喀斯特区域发展研究院,贵州 兴义 562400)
姬松茸(Agaricus blazeiMurill)又名巴西蘑菇,是一种起源于巴西的可食用蘑菇。其具有较高的营养价值和药用价值,在抗肿瘤活性、抗凋亡作用和防治心血管疾病等方面发挥着重要的作用。有研究指出,姬松茸菌丝体对重金属镉的富集能力较强,子实体中镉含量较高,易超过食用标准,导致姬松茸相关产品出现食品安全问题。因此,探究姬松茸镉胁迫相关的生理及分子响应机制,为姬松茸重金属胁迫相关研究提供理论基础,对解决实际生产问题具有重要的现实意义。
目前,已有研究人员对不同生长发育时期的巴西菇和双孢蘑菇等真菌子实体进行转录组测序,并针对子实体褐变这一现象进行转录组分析,但对于真菌菌丝在镉胁迫下的生理及分子响应机制相关报导较少,为了进一步了解姬松茸富集重金属的机理,笔者以前期筛选出的镉高、低富集菌株为材料,分别对其进行镉胁迫处理,通过Illumina 高通量测序技术分析不同菌株菌丝样品的差异表达基因,以明确姬松茸菌丝富集重金属的机理。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 供试姬松茸菌株为J4、J11,其中J4 菌株子实体的镉含量较低,J11 菌株子实体的镉含量较高[1]。
1.1.2 培养基 (1)固体培养基:马铃薯20%,葡萄糖2%,琼脂2%,pH 值自然。(2)液体种子培养基:葡萄糖2%,玉米粉2%,酵母膏0.75%,豆饼粉2%,KH2PO40.2%,MgSO4·7H2O 0.1%,pH 值自然。(3)液体发酵培养基:葡萄糖2%,玉米粉2%,酵母膏0.75%,豆饼粉2%,KH2PO40.2%,MgSO4·7H2O 0.1%,pH 值自然。
1.2 试验方法
1.2.1 菌株活化在母种试管中挑取黄豆大小的菌丝块接种于装有20 mL 固体培养基的平皿中,置于25℃培养箱中培养14 d,待菌丝长满整个平皿后用9 mm 打孔器取同一圈内的菌丝接种于装有100 mL 液体培养基的三角瓶中,静置24 h 后于25℃恒温、140 r/min 的摇床中培养12 d。
1.2.2 镉胁迫处理在液体发酵培养基中添加0.2 mL的镉溶液(CdCl2母液1 g/L),同时设置不添加镉处理的对照,每个处理3 个重复。接种量为10%,250 mL 的三角瓶装液量共100 mL(即镉胁迫浓度为2 mg/L),置于28℃恒温、140 r/min 的摇床中培养8 d。培养结束后过滤发酵液并收集菌丝,于-80℃冰箱中保存待用。
1.2.3 总RNA 的提取及检测选用天根 DP441 多糖多酚植物总RNA 提取试剂盒按照产品操作步骤提取姬松茸菌丝的RNA,2 个品种2 种处理(镉胁迫与对照)共4 个样品,每个样品作3 次生物学重复,共获得12 个样品的总RNA。使用Agilent 2100 分光光度计检测RNA 的浓度及OD260/280、OD260/230比值,进一步用琼脂糖凝胶电泳检测RNA 的降解程度及污染情况。随后进行RNA 文库构建,库检合格后,将样品委托至北京百迈克生物科技有限公司,采用Illumina HiSeq 进行高通量测序。
1.3 数据分析及qRT-PCR 验证
1.3.1 测序数据分析高通量测序得到的原始数据经过CASAVA 碱基识别后,转化为原始测序序列,对原始数据过滤,得到clean reads,对其进行序列组装,构建Unigene 库。利用BLAST[2]软件将Unigene 序列与NR[3]、Swiss-Prot[4]、GO[5]、COG[6]、KOG[7]、eggNOG4.5[8]、KEGG[9]数据库进行比对,使用KOBAS2.0[10]得到Unigene 在KEGG 中 的KEGG Orthology 结 果,预 测完Unigene 的氨基酸序列之后使用HMMER[10]软件与Pfam[11]数据库比对,获得Unigene 的注释信息。采用DESeq 进行样品组间的差异表达分析,获得2 个条件之间的差异表达基因集,以FDR(False Discovery Rate)作为degs 筛选的关键指标,在筛选过程中,挑选FDR <0.05 且FC(Fold Change)≥2 的差异基因构建火山图、GO 分类图、COG 分类图、KEGG 富集图,推断各差异基因的分布情况,并进行分析。
1.3.2 qRT-PCR 验证同1.2.3 方法提取样品总RNA,选用来自天根生化(北京)科技有限公司的FastKing一步法除基因组cDNA 第一链合成预混试剂(KR118)试剂盒将样品总RNA 反转录为cDNA,作为模板,将模板稀释为1 ng,保存于-20℃冰箱中备用。选取10 个与镉胁迫相关的差异表达基因进行实时荧光定量qRT-PCR 来验证转录组测序结果的可靠性。基因信息及引物如表1所示。选用Ab28S作为内参[12],按照2-△△Ct法计算相对表达量。

表1 qRT-PCR 引物
2 结果与分析
2.1 镉胁迫下姬松茸菌株差异表达基因的数量
完成12 个样品的转录组测序,原始数据过滤(除去带有接头的,低质量的reads)后,得到clean reads,其中Q20 均在98%以上,Q30 均高于94%。测序结果质量评估合格。对 Unigene 进行功能注释,包括与NR、Swiss-Prot、KEGG、COG、GO 数据库的比对,共获得26 776 条Unigene 的注释结果。
为了探究姬松茸菌丝在镉胁迫下转录水平的变化,以FDR <0.05,|FoldChange|≥2 为筛选标准,对2 个姬松茸品种菌丝进行差异基因的筛选。镉低富集品种的姬松茸菌丝J4-CK 与J4-Cd 中共检测到623个差异表达基因,其中上调基因244 个,下调基因379 个。镉高富集品种J11-CK 与J11-Cd 中共检测到1 386 个差异表达基因,其中580 条基因表达为上调,806 条表达为下调基因。J4-CK VS J4-Cd 与J11-CK VS J11-Cd 差异表达基因中共有的为264 个,J4-CK VS J4-Cd 特有的差异表达基因为359 个,J11-CK VS J11-Cd 特有的差异表达基因为1 122 个(图1A)。J4-CK、J4-Cd、J11-CK、J11-Cd 这4 个样品通过测序组装分别得到7 762、14 117、8 843、8 007 个Unigene。4个样品共有表达基因为7 420 个,J4-CK VS J4-Cd 共有7 563 个Unigene,J11-CK VS J11-Cd 共有7 887 个Unigene(图1B)。

图1 镉胁迫下镉高、低富集姬松茸菌株差异表达基因的韦恩图
2.2 镉胁迫下姬松茸菌株差异表达基因的GO功能富集分析
GO(gene ontology)是基因功能国际标准分类体系。根据GO 功能注释,从生物过程、细胞组成和分子功能3 个部分分析镉高、低富集姬松茸品种的菌丝镉富集情况。在J4-CK VS J4-Cd(图2A)所有的差异表达基因中,共有343 个基因有GO 功能注释;生物过程、分子功能和细胞组成分别有12、12、9 个注释条目;其中,差异基因在生物学过程中主要注释在代谢过程、信号生物过程等条目中;细胞组分中注释的差异基因主要富集在细胞及细胞膜成分、细胞及细胞成分等条目中;分子功能注释得到的差异基因主要富集在催化活性及结合等条目中。在J11-CK VS J11-Cd(图2B)所有的差异表达基因中,共有809 个基因有GO功能注释;生物过程、分子功能和细胞组成分别有14、14、10 个注释条目;注释最多的条目分别是代谢过程、信号生物过程、细胞及细胞成分、催化活性及结合等。
生物过程中的代谢过程、单有机体过程、细胞过程,细胞组成中的膜、膜部分、细胞、细胞部分,分子功能中的催化活性、蛋白结合等均是J4 与J11 这2个品种差异表达基因GO 富集注释最多的种类。然而,J11 菌株的 GO 功能注释中有6 个条目是J4 菌株GO功能注释中所没有的,这6 个条目分别是生物过程中的发育过程、生长,细胞组成中的病毒、病毒体部分,分子功能中的分子传感器活性、蛋白标记。
对J4-CK VS J4-Cd 与J11-CK VS J11-Cd 共 有 的差异基因进行表达GO 分类(图2C)发现,在生物学过程中代谢过程与单有机体过程注释的比较多,在细胞组成中膜与膜部分注释的比较多,分子功能中注释最多的前2 个条目分别为催化活性与结合。杨淑芳[13]的研究发现,在重金属铜处理下,小麦根尖细胞壁细胞膜受到破坏,细胞膜的膜层呈游离状态,推测细胞膜与重金属胁迫有关。

图2 镉胁迫下镉高、低富集姬松茸菌株差异表达基因GO 分类图
2.3 镉胁迫下姬松茸菌株差异表达基因的COG 数据库比对分析
通过K-均值聚类分析,将姬松茸J4-CK VS J4-Cd 菌丝的623 条差异表达基因到COG 数据库进行比对,结果如图3A 所示,分为19 大类,其中排前3位的COG 分别为:次生代谢物生物合成、转运和分解,一般功能预测,能量产生与转化。排第4 位的是防御机制。
将J11-CK VS J11-Cd 的1 386 条差异表达基因进行COG 分类注释,结果如图3B 所示,发现次生代谢物生物合成、转运和分解,一般功能预测,糖类转运和代谢,脂类转运和代谢占比排前4 位;胞内运输、分泌和泡内运输占比最少。其中,上调占比最多的注释条目是蛋白质翻译后修饰与转运、分子伴侣,下调占比最多的注释是次生代谢物生物合成、转运和分解。
将J4-CK VS J4-Cd 与J11-CK VS J11-Cd 共 有 的264 条差异基因比对到COG 数据库,结果如图3C 所示,共分为17 大类。其中,次生代谢物生物合成、转运和分解,防御机制,能量产生与转化占比排名前3 位。

图3 镉胁迫下镉高、低富集姬松茸菌株差异表达基因COG 的分类图
从以上结果可知,镉胁迫引起了姬松茸菌丝的次生代谢生物合成、转运和分解,蛋白质翻译后修饰与转运、分子伴侣等相关基因的差异表达。
2.4 镉胁迫姬松茸菌株差异表达基因的KEGG富集分析
生物体内,KEGG 的Pathway 富集通路可以具体到差异表达基因参与的某些信号转导途径代谢通路。通过富集因子(Enrichment factor)可以分析差异基因代谢通路的富集程度。富集因子即差异表达基因中注释到某通路的基因比例与所有基因中注释到该通路的基因比例的比值。富集因子越大,说明差异表达基因在该通路中的富集程度越高。此外,多重假设检验校正q 值越小,表明差异表达基因显示的显著差异性更
加可信。
镉胁迫下姬松茸菌丝体内富镉特性十分复杂,对J4-CK VS J4-Cd、J11-CK VS J11-Cd 以及二者共有的差异表达基因的上下调差异基因进行KEGG 富集分析,结果如图4 所示。从图4A 中发现,J4-CK VS J4-Cd上调差异基因富集在类固醇生物合成、内质网蛋白质加工、泛醌和其他萜烯类醌生物合成等通路;下调基因富集在氰基氨基酸代谢、甲烷代谢、碳代谢、淀粉和蔗糖代谢、组氨酸代谢、氧化磷酸化途径等通路。从图4B 中发现,J11-CK VS J11-Cd 上调基因主要富集在抗生素的生物合成、类固醇的生物合成、内质网蛋白质加工、萜类化合物的生物合成、氨基酸的生物合成、酮体的合成与降解、甘氨酸、丝氨酸和苏氨酸的代谢、硫代谢等通路;下调基因主要富集在谷胱甘肽代谢、甲烷代谢、酪氨酸代谢、磷酸肌醇代谢、不饱和脂肪酸生物合成途径、糖酵解和糖质新生、抗坏血酸和醛酸代谢、碳代谢、MAPK 信号通路等通路。

图4 差异基因KEGG 散点富集图
与J4-CK VS J4-Cd 相比,J11-CK VS J11-Cd 特有的上调差异表达通路为抗生素的生物合成,特有的下调差异表达通路为谷胱代谢、酪氨酸代谢、磷酸肌醇代谢等通路。而与J11-CK VS J11-Cd 相比,J4-CK VS J4-Cd 特有的上调差异表达代谢途径为泛醌和其他萜烯类醌生物合成,特有的下调差异表达代谢途径为氧化磷酸化代谢途径。
从图4C 中可以看到,差异表达基因主要富集在类固醇生物合成、抗生素的生物合成、碳代谢、谷胱甘肽代谢、内质网的蛋白质加工、甲烷代谢、淀粉和蔗糖的代谢等通路。其中类固醇生物合成、抗生素的生物合成途径上调,甲烷代谢、淀粉和蔗糖代谢、碳代谢、谷胱甘肽、乙醛酸和二羧酸等代谢途径下调。
2.5 qRT-PCR 荧光定量验证
将荧光定量的相对表达量结果2-△△CT用log2(FC)做标准化处理与转录组测序的结果一致化。从图5 可以看出,虽然10 个基因荧光定量的结果与转录组测序结果有一定的误差,但是总体趋势是一致的,表明转录组测序结果是可靠的。
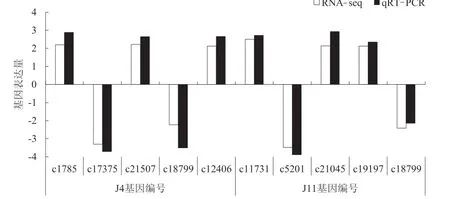
图5 差异基因表达量qRT-PCR 验证结果
3 讨 论
真菌的镉富集机制是一个比较复杂的过程。研究结果显示,姬松茸菌株在2 mg/L 的镉胁迫下,2 个姬松茸菌株响应镉富集的机制存在较大差异,与J4-CK VS J4-Cd 相比,J11-CK VS J11-Cd 差异基因显著表达的代谢通路更多。通过J4-CK VS J4-Cd 与J11-CK VS J11-Cd 共有差异表达基因的KEGG 富集分析发现:镉胁迫抑制姬松茸菌株的甲烷代谢、淀粉和蔗糖代谢等途径,却促进了内质网蛋白质加工及内固醇生物合成途径,可能通过改变菌丝细胞壁结构来增强菌丝对镉胁迫的耐受力。J11-CK VS J11-Cd的半胱氨酸和甲硫氨酸代谢途径中的基因表达均上调。半胱氨酸是谷氨酸合成前体氨基酸之一,谷胱甘肽是由谷氨酸、半胱氨酸及甘氨酸组成的含有γ-酰胺键和巯基的三肽,在螯合酶的催化下形成螯合肽(PC),螯合肽与重金属离子结合形成无毒的化合物,从而可以清除镉胁迫下菌丝体内的活性氧自由基,保证菌丝的正常活力。因此,半胱氨酸在菌株对抗镉胁迫过程中发挥了重要作用。在J11-CK VS J11-Cd 中,抗生素的生物合成途径差异基因富集较多,表明抗生素与次级代谢产物可能在体内起到保护细胞机体免受重金属毒害的作用。该推测与刘俊敏[14]研究双孢蘑菇镉耐性的结果一致。谷胱甘肽代谢通路是真菌以及植物自身适应镉胁迫的重要防御机制,这在双孢蘑菇[14]、酵母[15]、南极酵母[16]、水稻[17]、菜心[18]、红麻[19]中都有报道。该研究发现在J11-CK VS J11-Cd 的KEGG 富集中谷胱甘肽代谢途径下调,可能是由于一部分谷胱甘肽与重金属镉离子形成PC-Cd 低分子量复合物,从而影响了其下游代谢[20]。
研究以前期筛选出的镉高、低富集姬松茸菌株(J11、J4)为材料进行2 mg/L 的镉胁迫处理,以未添加外源镉作对照,采用Illumina 高通量测序技术对其菌丝样品进行转录组测序分析。KEGG 富集分析发现,J4-CK VS J4-Cd 镉胁迫响应的代谢途径有类固醇生物合成、谷胱甘肽代谢、抗生素的生物合成、碳代谢等;J11-CK VS J11-Cd 响应的代谢途径有类固醇生物合成、抗生素的生物合成、半胱氨酸和甲硫氨酸代谢、硫代谢等;采用qRT-PCR 实时荧光定量对10 个镉胁迫响应基因进行基因表达水平的验证,包括谷胱甘肽代谢、细胞色素P450、硫氨酸合成酶、多酚氧化酶、甲烷代谢、氮代谢等,得到的基因表达水平变化的结果与转录组测序得出的差异基因变化趋势基本一致,表明转录组测序结果是可靠的。该研究对姬松茸菌丝进行转录组测序分析,下一步可以对姬松茸子实体进行转录组测序,以期发掘姬松茸子实体的耐镉及富镉的关键基因。将姬松茸子实体的转录组测序结构与菌丝体的转录测序结果进行整合与比对,进一步完善姬松茸不同生育时期对重金属镉的调控转运机制。
