海马N-乙基马来酰亚胺敏感因子在肠易激综合征大鼠中的作用 *
2022-09-16崔子芝翁宇璇周怡飞
肠易激综合征 (irritable bowel syndrome, IBS)是临床常见病与多发病,病人常伴有腹部疼痛和排便习惯的改变,且反复发作,迁延不愈,严重影响病人的生活质量。一般认为内脏痛觉敏化是肠易激综合征的主要原因,其发病机制复杂且不明确
,临床亦缺乏有效的治疗方法,加重了病人及社会的医疗负担。痛觉敏化有外周敏化和中枢敏化两种机制,中枢敏化是脊髓或脊髓上位伤害性感觉神经元对外周刺激过度兴奋或过度反应的状态以致其突触传递效能发生持久性改变。研究发现谷氨酸受体、γ- 氨基丁酸受体和瞬时感受器电位香草酸亚型1 通道等多种离子通道和受体参与慢性内脏痛的中枢敏化,尤其是谷氨酸能突触传递的异常激活,是慢性疼痛中枢敏化的重要机制
。离子型谷氨酸受体AMPA 受体 (alpha-amino-3-hydroxy-5-methylisoxazole-4-propionic acid receptors, AMPAR
) 可介导快速兴奋性突触传递,在痛觉传递和突触可塑性中发挥着重要作用,但具体机制还有待阐明
。
N-乙基马来酰亚胺敏感因子(N-ethylmaleimide sensitive factor, NSF) 是ATP 酶AAA 家族的主要成员,在细胞内囊泡转运神经肽类激素或突触后膜神经递质释放过程中起重要作用。研究发现,NSF 可改变突触后AMPA 受体的分布;神经元的细胞内灌注合成肽可竞争NSF 和AMPA 受体亚基之间的相互作用,并降低微小兴奋性突触后电位的幅值
。我们前期研究发现IBS 大鼠海马突触可塑性增强及AMPA 受体表达增高
,推测海马NSF 可能通过调控AMPA 受体在慢性内脏痛中枢敏化中起着重要作用。本研究拟以IBS 模型大鼠为研究对象,通过在体与离体脑片实验探讨海马NSF 在IBS 大鼠中的作用及其机制,为IBS 临床治疗提供新的思路。
方 法
1. 实验材料
实验动物:清洁级新生SD 大鼠,福建医科大学实验动物中心提供 [实验动物许可证号:SCXK(闽)2012-0001]。所有操作及动物处理均严格遵循相关动物保护及使用规定,并已通过福建医科大学实验动物福利伦理委员会批准(伦理审批编号:2017-027)。
97 S7-200型PLC在破碎系统中的生产应用 ………………………………………………………… 林 斌
实验仪器:动物麻醉机(USA Matrx 公司);RM6240 多道生理记录仪(成都仪器厂);脑立体定位仪(深圳市瑞沃德生命科技有限公司);电泳槽(北京市六一仪器厂);电泳转膜仪(北京市六一仪器厂);解剖显微镜(77001,深圳市瑞沃德生命科技有限公司);微电极操纵仪(MX160L,成都仪器厂);微电极放大器(SWF-2W,成都仪器厂)。
(3)NSF 抑制剂pep2m 对IBS 大鼠腹外斜肌放电活动的影响
2. 实验方法

腹外斜肌放电检测:用异氟烷将大鼠诱导麻醉后,将结直肠加压气囊浸少量甘油插入大鼠肛门,固定于手术台上,气囊导管的另一端与一“T”型三通管连接,三通管另外两端分别连接血压计及注射器。将银丝双极电极插入腹股沟韧带上方、距中线1.5 cm 的一侧腹外斜肌上,调节适当的异氟烷麻醉剂量,使大鼠处于浅麻醉状态,通过对大鼠结直肠扩张 (colorectal distension, CRD) 予以加压,压力梯度分别为40 mmHg 和60 mmHg,每次加压10 s,休息4 min,用RM6240 多道生理信号采集处理系统记录在不同CRD 压力下大鼠腹外斜肌放电活动。通过与正常对照组大鼠的腹外斜肌放电幅值的比较分析,腹外斜肌放电幅值高于正常对照组20%为造模成功IBS 大鼠,筛选出内脏痛觉敏化的大鼠即IBS 大鼠进行后续实验。
海马定位及微量注射:大鼠56 只,模型组及对照组各28 只,模型组及对照组均根据海马注射药物的浓度分为溶剂组、100 µM pep2m 组、200 µM pep2m 组和400 µM pep2m 组,每组7 只。用异氟烷将大鼠麻醉后俯卧位,固定于大鼠脑立体定位仪上,顶部正中切口,显露前囟,根据大鼠脑图谱进行定位。参照Paxinos&Watson 大鼠脑图谱,向海马两侧CA1 区 (AP -4.0 mm,RL +/-2.5 mm,H 2.5 mm) 插入内径为0.35 mm、外径为0.65 mm 的不锈钢金属外套管。双侧海马CA1 区微量注射给予NSF 抑制剂pep2m 三个剂量组 (100 µM、200 µM 和400 µM) 及20%乙腈对照组,每侧海马给药量为2 µl,给药前后腹外斜肌放电检测。实验后海马微量注射5%溴酚兰溶液后处死,取脑行冠状切片观察套管轨迹,定位不准确者弃去。
1)入院护理。接诊护士面带微笑迎接新患者,同时进行自我介绍,给家属及患者留下良好的印象,建立良好的护患关系。备好床单元,护送患者至床前,通知医生查看患者。向患者及家属介绍责任医生及责任护士,介绍病区环境,消除患者的陌生感,同时完成入院时身高、体重及生命体征的监测,期间应了解患者的主诉、症状、心理状态,具有同理心,根据患者的需求提供需要。
海马蛋白样品的制备:用异氟烷深麻醉大鼠后断头,取出完整的海马组织放入研磨器中,倒入液氮研碎,按照每10 mg 组织加入100 µl 裂解的比例加入裂解液迅速研磨,移至1.5 ml EP 管中冰上放置30 min。4℃,12,000 r/min,离心10 min,取上清液分装于0.5 ml EP 管中,BCA 法测定蛋白浓度。
Western blot 结果显示,对照组大鼠pep2m 灌流海马脑片组(给药组)GluR2 的相对光密度比值(0.93±0.15)与未给药组(1.25±0.13)相比无显著性差异(
< 0.05,见图6);IBS 大鼠给药组GluR2 的相对光密度比值(0.69±0.12)与未给药组(1.51±0.17)相比显著降低(
< 0.05,见图6),此结果提示pep2m 可抑制IBS 模型大鼠海马GluR2的表达。
一个正常的社会不该总是在好人遭遇恶人时束缚好人而放纵坏人。昆山“反杀案”撤案是对这一现象的有效扭转,是对公民同违法犯罪说不的极大鼓励,它让社会更有正气、公众更有力量、善良正直的人更有底气和勇气。
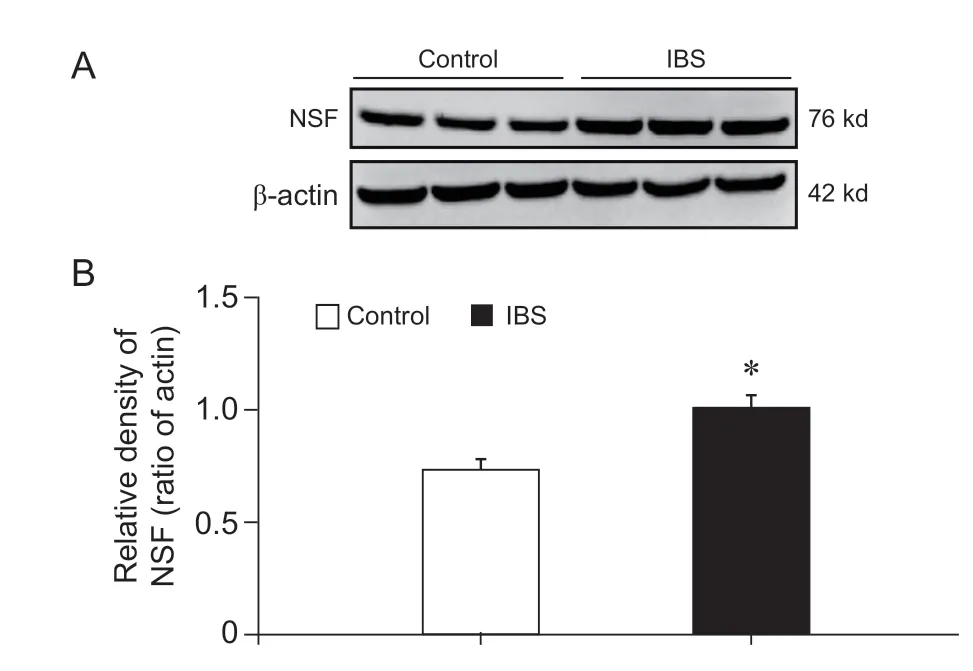
Western blot 结果显示,对照组大鼠和IBS 大鼠海马NSF 的光密度值的相对比值分别为0.73±0.04和1.01±0.05 (
= 3),IBS 大鼠海马NSF 的表达较对照组大鼠显著增加(
< 0.05,见图2)。
3. 统计学分析
IBS 慢性功能性内脏痛大鼠模型的建立
:SD乳鼠在出生后第3 天至第21 天,每日固定时间给予一次母婴分离刺激(不同笼、不同室),每只幼鼠分隔于单独的小隔间里3 h。正常饲养至第8 周,选体重220 g 左右的雄鼠开始进行实验。模型组和对照组大鼠各45 只。
结 果
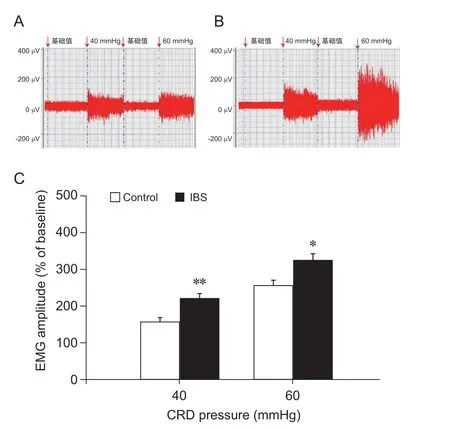
1. IBS 模型大鼠内脏痛觉敏化
采用新生期母婴分离建立IBS 模型大鼠,待大鼠成年(8 周)后,IBS 大鼠在40 mmHg、60 mmHg CRD 压力下腹外斜肌放电幅值显著高于对照组大鼠(
< 0.05,见图1),提示大鼠在新生期时给予母婴分离应激可致其成年后出现内脏痛觉敏化。
今年是HK IWSC的十周年,大赛在参赛数量以及评审团队的规模都录得破纪录的数字。今年共有35个国家(逾500个法定产区)参赛,而大赛亦汇聚了破纪录60 位亚洲各地的顶级评委。HK IWSC十周年另一重点是全新推出的“Green Wine Award绿色葡萄酒奖”-表彰致力于可持续发展的优质葡萄酒、烈酒及清酒(获得金奖和项目大奖的得奖酒)。
二是进一步加大工作指导力度,利用全区统筹整合涉农资金专题培训班和全区财政支农政策培训班等培训方式,不断提高基层工作水平。
2. 海马NSF 参与IBS 大鼠内脏痛觉中枢敏化
(1)IBS 大鼠海马NSF 的表达增强
第二,管理者特质会对企业内部控制要素的执行效果产生相应的影响。尤其是在风险评估、管控过程中,管理者特质会影响管理者风险识别过程和应对能力,且会考验企业内部经营对环境的适应性。
离体海马脑片的制备及NSF 抑制剂pep2m 对离体海马脑片的干预:大鼠12 只,模型组及对照组各6 只。10%水合氯醛麻醉后断头,迅速取出大脑,放置于低于4℃的冰人工脑脊液(ACSF)中,振动切片机将含有海马的大脑部分切成脑片,厚度500 µm。脑片在持续充有95% O
和5% CO
混合气体的常温ACSF 中孵育1 h。给药组将脑片移至界面型记录槽,通过尼龙网与槽内ACSF 接触,以1~2 ml/min 持续灌流脑片,ACSF 灌流液中加入pep2m 灌流60 min,脑脊液温度控制在(30±1) ℃,持续充有95% O
和5%CO
混合气体;未给药组正常条件下孵育。分别取脑片海马组织,制备海马蛋白样品,Western blot 检测GluR2 表达。
(2)NSF 抑制剂pep2m 对正常大鼠腹外斜肌放电活动的影响
对照组大鼠双侧海马CA1 区微量注射溶剂(20%乙腈)、100 µM 和200 µM pep2m 30 min 后,在40、60 mmHg CRD 压力下,腹外斜肌放电幅值与给药前30 min 相比,差异无显著性(见图3AC);双侧海马CA1 区微量注射400 µM pep2m 30 min 后腹外斜肌放电幅值与给药前30 min 相比显著降低,差异有统计学意义(见图3D),提示海马微量注射100 µM、200 µM pep2m 对正常大鼠的内脏痛觉敏感性无显著影响,但高浓度的pep2m 可抑制正常大鼠腹外斜肌放电。

实验试剂:鼠抗NSF 单克隆抗体 (ab16681, Abcam);鼠抗GluR2 单克隆抗体 (MAB397, Millipore);鼠抗β-actin 单克隆抗体 (E021020-03; EarthOx Life Science);pep2m (Cat. No.1595, TOCRIS);BCA 蛋 白定量试剂盒(碧云天生物技术有限公司)等。
IBS 模型大鼠双侧海马CA1 区微量注射溶剂、100 µM pep2m 30 min 后在40、60 mmHg CRD 压力下腹外斜肌放电幅值与给药前30 min 相比,无统计学差异(见图4 A, B)。 IBS 模型大鼠双侧海马CA1 区微量注射200 µM pep2m 后,与给药前30 min相比,在40 mmHg 与60 mmHg CRD 压力下腹外斜肌放电幅值均显著降低,差异有统计学意义(给药前
给药后:40 mmHg,323±10
241±9;60 mmHg,396±8
313±16,
< 0.001,见图4C)。IBS 模型大鼠双侧海马CA1 区微量注射400 µM pep2m后与给药前30 min 相比,在40 mmHg 和60 mmHg CRD 压力下测的腹外斜肌放电幅值均显著降低,差异有统计学意义(给药前
给药后:40 mmHg,216±10
86±6;60 mmHg,329±11
170±14,
< 0.001,见图4D)。此结果提示双侧海马CA1区微量注射200 µM、400 µM pep2m 对IBS 模型大鼠的内脏痛觉敏感性有抑制作用。

IBS 模型大鼠海马微量注射不同剂量 pep2m(100 µM、200 µM 和400 µM)后30 min,其 在40 mmHg CRD 压力的抑制率分别为7%±3% 、25%±2%和60%±2%,表现为随剂量的增加其抑制率显著增加(
< 0.001,见图5B);在60 mmHg CRD 压力的抑制率分别为7%±3%、21%±3%和48%±3%,也表现出随剂量的增加其抑制率显著增加(
< 0.01,
< 0.001,见图5D)。此结果提示pep2m 对IBS 模型大鼠的抑制作用呈现剂量依赖性。
对照组大鼠海马微量注射不同剂量pep2m(100 µM、200 µM 和400 µM)后30 min,其 在40 mmHg CRD 压力的抑制率分别为23%±5% 、24%±4%和39%±4%,在60 mmHg CRD 压力的抑制率分别为13%±6%、25%±4%和33%±4%。对照组大鼠在40 mmHg 与60 mmHg CRD 两个压力下各剂量之间的抑制率差异无统计学意义(见图5A, C)。
(4)pep2m 对大鼠内脏痛觉敏感性的抑制效应

3. pep2m 灌流IBS 大鼠海马脑片后GluR2 的表达降低
免疫印迹法:配制10%的分离胶和5%的浓缩胶,行SDS-PAGE 电泳,电转膜,取出 PVDF膜,将膜放在5%的脱脂奶粉液里,摇床上室温封闭2 h。将封闭好的膜分别对应加入鼠抗NSF 一抗(1:500)、鼠抗GluR2 一抗(1:1000)及鼠抗β-actin 一抗(1:3000),4℃孵育过夜。TBST 漂洗3 次,每次10 min,加入辣根过氧化物酶(HRP)标记的羊抗鼠二抗(1:6000),室温孵育1 h。ECL 法显色1~3 min,置于分子成像仪内成像,凝胶分析软件进行图像分析。
1)第①种情况 将工序u移至v之后,如图11所示,Q变为Q1={l1,l2,,lk,v,u},求解评价值λu,v(0,w)和λu,v(w,#)的过程如下:

讨 论
慢性疼痛可以影响大脑的高级功能,如感觉、情感、认知及记忆等。研究表明大脑尤其是边缘系统在慢性疼痛中发挥着关键作用,边缘系统具有接受调控伤害性信息的功能。伤害性信息传入边缘系统,并由此传向大脑皮质,产生疼痛的感受和心理反应。海马是边缘系统的重要组成,在学习与记忆、情绪情感调控以及感觉集成等方面发挥重要作用。研究发现海马参与了机体对慢性疼痛的调控过程,并且在痛觉信息的加工处理中起着重要作用。海马CA1、CA2、CA3 和齿状回颗粒细胞层内存在伤害性敏感神经元。在慢性疼痛病人和动物模型上均发现海马功能的改变,并伴有海马神经元增多及行为学等多方面的变化
。本课题组前期研究发现,IBS 模型大鼠海马CA1 区LTP 比正常大鼠显著增强,海马微量注射PKMζ 抑制剂ZIP 和AMPARs 抑制剂CNQX 均可剂量依赖性抑制IBS 模型大鼠内脏痛觉敏感性
,提示海马作为内侧痛觉系统的组成部分,在慢性功能性内脏痛的形成中发挥着重要的作用,海马突触可塑性 LTP 有助于痛记忆和痛情绪的形成,为疼痛的研究提供借鉴。
NSF 作为一种在神经系统内能引发多种生物学效应的膜融合蛋白,近年来受到越来越多的关注。NSF 蛋白单体包含有一个N-结构域和两个相互独立ATP 结合结构域,NSF 通过N-结构域与其他蛋白复合物互相链接,ATP 结合结构域在囊泡融合的过程中催化ATP 水解为该过程供能,这三个结构域对NSF 的整体活性起着不可或缺的作用
。NSF在成年大鼠大脑中广泛表达,特别是在海马区有着较高的表达水平。本研究应用免疫印迹法检测发现,IBS 大鼠海马NSF 蛋白表达显著高于正常大鼠;进一步通过双侧海马CA1 区微量注射NSF 抑制剂pep2m,发现IBS 大鼠腹外斜肌放电幅值显著下降,pep2m 可呈剂量依赖性降低IBS 模型大鼠的内脏痛觉敏感性,提示海马NSF 作为转运蛋白在慢性功能性内脏痛中枢敏化中起着重要作用。
NSF 可通过细胞质中NSF 粘附蛋白 (soluble NSF attachment protein, SNAP) 结合到高尔基体膜上的NSF 粘附蛋白受体(SNAP receptors, SNAREs),在细胞膜囊泡转运过程中发挥重要作用
。在SNAP依赖的行为中,NSF 可与AMPARs 的GluR2 亚型C 端直接结合,这种稳定性的结合是核苷酸依赖性的,需要NSF 的三个结构域参与
。研究发现NSF 抑制剂pep2m 可引起突触电流的迅速减少,NSF与GluR2 之间的相互作用对突触后膜表面AMPAR 的稳定性有着重要作用
。此外,研究还发现NSF也可不经SNAP 直接与膜上AMPARs、多巴胺受体和γ-氨基丁酸受体等结合,进而调控受体在细胞质和核内体之间物质传输的作用
。
AMPARs 是促离子型谷氨酸受体,普遍存在于中枢神经系统中,AMPARs 的GluR1 和GluR2 亚基被认为是与疼痛关系密切的受体亚型。有研究发现在芥子油诱发的内脏痛模型大鼠海马前扣带回GluR2 的表达量显著增加
。本课题组前期研究发现IBS 慢性内脏痛大鼠海马GluR2 表达增加而GluR1 表达减少,且IBS 慢性内脏痛大鼠离体海马脑片长时程增强后GluR2 表达明显增加
。还有学者在神经病理性疼痛模型中,发现鞘内注射豆蔻酰化的抑制剂阻断GluR2、GluR3 亚基和NSF 之间的联系后,能选择性抑制外周神经损伤时神经病理性痛觉敏化
。
(3)一致式与隐喻式之间具有形似性。形似性原则是一条接受度较高、简便有效的判定标准,同时也能起到我们在第一条标准里谈到的限制研究范围的作用,此处不再赘述(可参见3.2小节的例子及相关分析)。
有关学习记忆的研究表明,NSF 与GluR2 之间的相互作用是背侧杏仁核恐惧记忆形成的前提条件;海马长期记忆的维持需要NSF 与GluR2 之间的相互作用
,LTP 的维持阶段AMPAR 信号通路上NSF 与GluR2 之间的相互作用上调,进而加速AMPARs 向胞膜转运,导致突触后膜AMPARs 的突触传递效应增强
。疼痛被认为也是学习记忆的一种形式,说明NSF 与GluR2 之间的相互作用在疼痛形成中起着重要作用。有学者研究发现NSF 抑制剂pep2m 的过度表达,可抑制NSF-GluR2 相互作用,降低突触前活性区膜中GluR2 的浓度
。本研究用含有NSF 抑制剂pep2m 的人工脑脊液灌流脑片后,发现IBS 模型大鼠海马中GluR2 表达显著降低,而正常大鼠GluR2 表达水平未发生明显变化,提示IBS 大鼠海马NSF 的高表达,可通过NSF 与GluR2之间的相互作用,使GluR2 表达增加,导致IBS 大鼠中枢痛觉敏化,其具体机制有待进一步研究。
利益冲突声明:作者声明本文无利益冲突。
[1] 张弘弘,孙艳,徐广银. 慢性内脏痛的病理机制研究和临床治疗新进展[J]. 中国疼痛医学杂志, 2017,23(1):2-20.
[2] Henderson LA, Keay KA. Imaging acute and chronic pain in the human brainstem and spinal cord[J]. Neuroscientist, 2018, 24(1):84-96.
[3] Defaye M, Abdullah NS, Iftinca M,
. Gut-innervating TRPV1
neurons drive chronic visceral pain via microglial P2Y12 receptor[J]. Cell Mol Gastroenterol Hepatol, 2022, 13(4):977-999.
[4] Song Y, Meng QX, Wu K,
. Disinhibition of PVN-projecting GABAergic neurons in AV region in BNST participates in visceral hypersensitivity in rats[J].Psychoneuroendocrinology, 2020, 117:104690.
[5] Chen AQ, Chen Y, Tang Y,
. Hippocampal AMPARs involve the central sensitization of rats with irritable bowel syndrome[J]. Brain Behav, 2017, 7(3):e00650.
[6] Urbina FL, Gupton S. SNARE-mediated exocytosis in neuronal development[J]. Front Mol Neurosci, 2020,13:133.
[7] 崔子芝,林春. 海马N-乙基马来酰亚胺敏感因子在慢性内脏痛中的作用[D]. 福州:福建医科大学,2017:10-11.
[8] Chen AQ, Bao CJ, Tang Y,
. Involvement of protein kinase ζ in the maintenance of hippocampal long-term potentiation in rats with chronic visceral hypersensitivity[J].J Neurophysiol, 2015, 113(9):3047-3055.
[9] Apkarian AV, Mutso AA, Centeno MV,
. Role of adult hippocampal neurogenesis in persistent pain[J].Pain, 2016, 157(2):418-428.
[10] Yoon TY, Munson M. SNARE complex assembly and disassembly[J]. Curr Biol, 2018, 28(8):R397-R401.
[11] Kim CH, Lisman JE. A labile component of AMPA receptor-mediated synaptic transmission is dependent on microtubule motors, actin, and N-ethylmaleimide-sensitive factor[J]. J Neurosci, 2001, 21(12):4188-4194.
[12] Osten P, Srivastava S, Inman GJ,
. The AMPA receptor GluR2 C terminus can mediate a reversible,ATP-dependent interaction with NSF and α-and β-SNAPs[J]. Neuron, 1998, 21(1):99-110.
[13] Nishimune A, Isaac JT, Molnar E,
. NSF binding to GluR2 regulates synaptic transmission[J]. Neuron,1998, 21(1):87-97.
[14] Shen K, Limon A. Transcriptomic expression of AMPA receptor subunits and their auxiliary proteins in the human brain[J]. Neurosci Lett, 2021, 755:135938.
[15] Garry EM, Moss A, Rosie R,
. Specific involvement in neuropathic pain of AMPA receptors and adapter proteins for the GluR2 subunit[J]. Mol Cell Neurosci,2003, 24(1):10-22.
[16] Zhao CX, Slevin JT, Whiteheart SW. Cellular functions of NSF: not just SNAPs and SNAREs[J]. FEBS Lett,2007, 581(11):2140-2149.
[17] Zhou L, Huang J, Gao J,
. NMDA and AMPA receptors in the anterior cingulate cortex mediates visceral pain in visceral hypersensitivity rats[J]. Cell Immunol,2014, 287(2):86-90.
[18] Migues PV, Hardt O, Finnie P,
. The maintenance of long-term memory in the hippocampus depends on the interaction between N-ethylmaleimide-sensitive factor and GluA2[J]. Hippocampus, 2014, 24(9):1112-1119.
[19] Umanah GKE, Ghasemi M, Yin XL,
. AMPA receptor surface expression is regulated by S-Nitrosylation of thorase and transnitrosylation of NSF[J]. Cell Rep,2020, 33(5):108329.
[20] Haglerød C, Hussain S, Nakamura Y,
. Presynaptic PICK1 facilitates trafficking of AMPA-receptors between active zone and synaptic vesicle pool[J]. Neuroscience, 2017, 344:102-112.
