miR-127对皮肤鳞状细胞癌细胞生物学行为调控作用研究
2022-09-15李滋泽
李滋泽,岳 振,胡 楠
皮肤鳞状细胞癌(鳞癌)约占所有非黑素瘤皮肤癌的20%,是继基底细胞癌之后第二大常见非黑素瘤皮肤癌[1]。非黑素瘤皮肤癌中不同类型肿瘤的相对比例正在发生变化,与基底细胞癌相比,皮肤鳞癌的发病率呈上升趋势,在老年人群中其增长趋势尤其显著[2]。虽然多数病人通过手术联合放疗可以有效治疗皮肤鳞癌,但是对于转移病人预后不佳[3]。对于皮肤鳞癌发病机制的深入研究尤为重要。微小RNA(microRNA,miR)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,通常在转录后发挥作用,通过抑制翻译过程或降解靶mRNA来调节蛋白质表达。miR与几乎所有正常细胞功能相关,广泛参与包括增殖、分化和凋亡在内的各种细胞活动。miR-127位于母系印迹基因Dlk1/Gt12区域内[4],主要受到小异二聚体配体和雌激素相关受体γ等核受体信号的调控[5],其在结直肠癌、急性髓性白血病以及骨肉瘤等肿瘤中表达明显升高[6-8]。但目前对于miR-127在皮肤鳞癌中的研究较少,本研究通过检测miR-127在皮肤鳞癌、癌旁组织中的表达水平差异,同时调控miR-127在皮肤鳞癌细胞系中的表达,探讨miR-127对皮肤鳞癌细胞的生物学行为调控作用,为临床诊疗提供参考。现作报道。
1 材料与方法
1.1 标本采集及细胞株 收集2017年8月至2021年6月间于蚌埠医学院第一附属医院皮肤科确诊的21例皮肤鳞癌病人的鳞癌标本及周边正常皮肤组织,所有收集标本均经病理检查明确诊断及肿瘤细胞恶性程度判定。本研究经过我院伦理委员会批准,所有标本提供者均签署知情同意书。HaCaT细胞、A431细胞以及HSC-5细胞均购自美国模式培养物集存库。
1.2 实验试剂 Trizol 总RNA 抽提试剂盒购自美国Invitrogen公司;Takara 逆转录试剂盒购自宝生物工程(大连) 有限公司;SYBR GreenⅠ荧光染料试剂盒购于美国Thermofisher公司;miR-127引物购自于上海吉玛生物有限公司。
1.3 荧光定量PCR(RT-qPCR)检测 使用Trizol法提取标本总RNA,并用Nano-Drop2000 紫外分光光度计检测RNA 浓度和纯度(A260:A280),后进行凝胶电泳,将琼脂糖胶置于BioRad GELDOC XR+凝胶成像扫描仪内扫描检测PCR产物。按照Takara 逆转录试剂盒说明书要求将miR 逆转录成cDNA,合成的cDNA产物直接用于PCR 或保存于-20 ℃保存待用。采用SYBR GreenⅠ法进行miR-127的实时荧光定量检测。反应体系如下:miR-127逆转录产物2 μL,SYBR Green Mix 9 μL,上下游引物各1 μL,加入DEPC水将反应总体系配至20 μL。PCR反应程序如下,预变性:94 ℃ 5 min,变性:94 ℃ 30 s,退火:58 ℃ 30 s,延伸:72 ℃ 30 s,设置30个反应循环。同时将U6作为内参基因。miR-127逆转录引物为5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG AAG CCA A-3′;miR-127上游引物为5′-GCG GCT CGG ATC CGT CTG AGC T-30;miR-127下游引物为5′-GTG CAG GGT CCG AGG T-3′;U6上游引物为5′-CTC GCT TCG GCA GCA CA-3′;U6下游引物为5′-AAC GCT TCA CGA ATT TGC GT-3′。每个实验重复进行3次,目的基因的相对表达量采用2-ΔΔCt法进行分析。
1.4 蛋白免疫印迹实验 采用细胞裂解液获得细胞总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,将分离出的蛋白电转至硝酸纤维素膜,采用一抗封闭过夜,次日采用二抗孵育,后于ECL显影液中浸润,暗室中显影,采用Image J对蛋白条带测量灰度值。
1.5 细胞转染 分别将miR-127模拟物(miR-127 agomir),miR-127抑制物(miR-127 antagomir)以及各自对照试剂(NC agomir和NC antagomir)(上海吉玛生物技术公司)以及lipofectamine 3000(Thermo Fisher 公司)充分混合后加入A431细胞中,37 ℃ 5% CO2恒温培养箱培育48 h后以供后续实验。
1.6 细胞增殖实验 采用CCK8法检测A431细胞的增殖能力,将105个细胞加入96孔板中,每孔加入10 μL CCK-8溶液,置入37 ℃ 5% CO2恒温培养箱培育,分别检测24、48以及72 h的吸光度值。
1.7 细胞侵袭实验 将105个细胞加入铺有matrigel胶的transwell小室上层,小室下层加入10%FBS的细胞培养基,入37℃ 5% CO2恒温培养箱培育48 h后取出采用结晶紫染色,观察显微镜视野下的细胞数。
1.8 荧光素酶报告基因实验 根据预测结果克隆靶基因中含有的miR-127结合位点序列以及靶基因3′UTR中含有的miR-127结合位点序列,将以上序列分别插入到psiCHECK2载体中,构建荧光素酶报告基因载体。将miR-127 agomir或NC agomir分别与上述重组载体共转染HEK-293 T细胞,采用荧光素酶报告基因实验检测荧光强度。
1.9 统计学方法 采用t检验、方差分析及q检验。
2 结果
2.1 皮肤鳞癌组织及癌旁组织中miR-127的表达情况 采用qRT-PCR检测皮肤鳞癌组织以及癌旁组织中miR-127的表达水平,结果显示,miR-127在皮肤鳞癌组织中表达2.94±0.25,明显高于癌旁组织的1.17±0.17(t=10.14,P<0.01),在皮肤鳞癌组织中含量为癌旁组织的2.9倍。
2.2 皮肤鳞癌细胞中miR-127的表达水平 分别收集HaCaT细胞、A431细胞以及HSC-5细胞中的RNA,采用qRT-PCR检测3种细胞中miR-127的表达水平。相较于HaCaT细胞,miR-127表达水平在A431细胞以及HSC-5细胞中显著升高,差异有统计学意义(P<0.05)(见表1)。
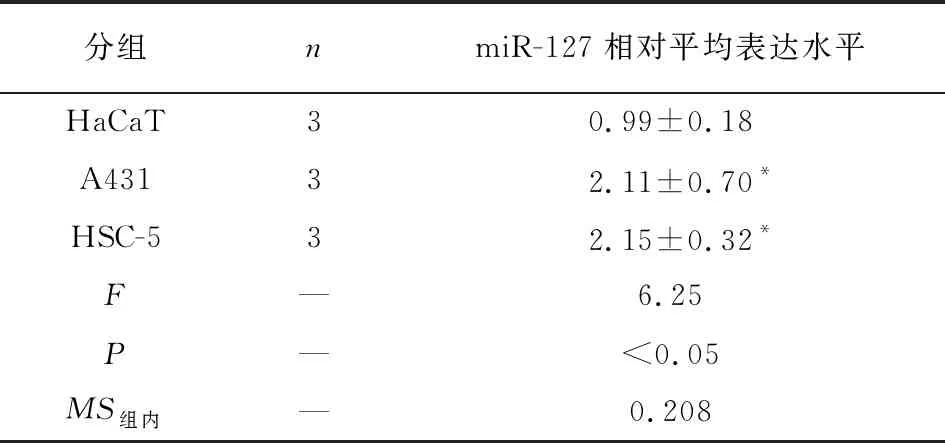
表1 miR-127在HaCaT细胞、A431细胞以及HSC-5细胞中的相对表达水平
2.3 miR-127对皮肤鳞癌细胞生物学调控的影响 分别将miR-127 agomir.miR-127 antagomir以及NC agomir和NC antagomir转染A431细胞,结果显示,上调miR-127表达后,A431细胞的增殖及侵袭能力显著增强;下调miR-127的表达后,A431细胞的增殖及侵袭能力受到抑制(P<0.05)(见图1、表2)。


表2 调控miR-127后细胞侵袭能力比较
2.4 miR-127调控皮肤鳞癌细胞的可能作用途径 通过生物信息学预测网站我们发现miR-127与抑癌基因PTEN存在结合位点,进一步通过双荧光素酶报告基因实验我们发现miR-127可以与PTEN直接结合(见图2)。调控miR-127后PTEN在蛋白水平的表达发生改变,其中miR-127+PTEN组荧光素酶相对强度高于Control+PTEN组,Control+PTENmut组荧光素酶相对强度均高于miR-127+PTENmut组(P<0.05);miR-127 agomir组PTEN蛋白表达水平低于NC agomir组和NC antagomir组,miR-127 antagomir组PTEN蛋白表达水平高于NC agomir组和NC antagomir组(P<0.05)(见表3~4)。


表3 调控miR-127后不同组荧光素酶相对强度比较

表4 不同调控组PTEN蛋白表达水平
3 讨论
miR是由双链RNA经过剪切、修饰后做得到的短链小分子RNA,一般长度在20~24个核苷酸。其自身通常不参与编码合成mRNA,而是在转录后水平参与靶基因调控过程。miR是近年来表观遗传学方面研究的热点,主要通过抑制它的靶基因来起调控作用,其作用遍及生命体的发生、生长、发育、分化和死亡的各个过程。许多研究已经证实多种miR在皮肤鳞癌中的表达量存在异常,如WANG等[9]研究发现皮肤鳞癌中miR-31表达异常增高,且miR-31可以调控皮肤鳞癌细胞的迁移及集落形成能力;MiR-216b可通过结合TPX2从而激活p53信号通路,抑制皮肤鳞癌的迁移、侵袭及成血管能力[10]。此外,还有研究[11]列举了miR-21、miR-205、miR-365、miR-31等miR,这些异常表达的miR可能与细胞增殖分化、凋亡、血管形成、肿瘤浸润及转移等多种功能相关。
对于miR-127在皮肤鳞癌作用的相关研究较少。miR-127与miR-431,miR-433、miR-127、miR-432和miR-136等属于同一簇,miR-127和miR-433存在重叠的基因区域,但拥有彼此独立的启动子,并且这2种miRNA的表达均受到雌激素相关受体γ诱导并且被小异源二聚体配体的抑制。有研究[12]表明miR-127在胎儿肺发育晚期期间表达水平最高,因此可能在此过程中发挥重要作用。此外,miR-127调节BCL6介导的CDKN1A的表达,在大鼠肝细胞中,miR-127的下调促进细胞增殖,而miR-127的上调抑制增殖[13]。在多种肿瘤细胞中,miR-127也参与其生物学功能调控。GUO等[14]发现miR-127在胃癌细胞中的表达水平受到抑制,而上调其表达可抑制肿瘤的生长。除了胃癌等实体肿瘤,miR-127可能在皮肤肿瘤中发挥作用,而在本研究中,我们对比了皮肤鳞癌组织与正常组织中miR-127的表达水平差异,结果发现在皮肤鳞癌组织中,miR-127的表达水平升高,提示miR-127可能参与了鳞癌细胞的发生发展过程,这个结果与CAI等[15]发现相一致。此外,我们通过体外调控miR-127的表达,结果发现皮肤鳞癌细胞的增殖和侵袭能力受到调控;同一miR可作用于多个靶基因,如miR-127可作用于DLK1从而影响黑素瘤的进展[16],miR-127也可抑制Wnt7a的转录后翻译过程从而调控胃癌的生长[17];而本研究进一步检测miR-127的作用靶基因,验证了miR-127可作用于PTEN的表达。
综上所述,本研究发现miR-127在皮肤鳞癌组织中表达显著上升,同时其表达水平与鳞癌细胞的生物学行为存在联系,且这种调控与作用于PTEN有关。因此我们认为miR-127可能作为一个潜在的分子生物学标志物,可能成为临床诊治的一个重要靶点。
