高考中元素周期律考查动向分析
2022-09-14邹小浪
邹小浪
(贵州省遵义市务川仡佬族苗族自治县第二高级中学)
纵观近年高考化学试题,对元素周期律的考查常以文字叙述或图表的形式出现,意在考查学生对基础知识的掌握情况.随着新高考制度的实施,试题向学生的知识应用能力方面发展,对学生提取信息能力、推理能力和知识迁移能力要求较高.本文以元素周期律为核心,帮助学生分析高考考查动向,提高学生复习的针对性.
1 元素周期律简述
元素周期律是指随着原子序数的变化,元素的性质呈现周期性变化,其实质是核外电子排布呈周期性变化的外在表现,表现了量变引起质变的化学观念,体现了微观世界与宏观世界的紧密联系.
元素周期律主要有两种表现形式,一种体现在原子结构上,包括核电荷数、电子层数、原子半径、离子半径等;另一种是物质的性质,包括元素的金属性和非金属性、离子的氧化性和还原性、最高价氧化物对应的水化物的酸碱性等.
元素周期律的两种表现形式是学生解答相关试题的基础,学生由此可推测出“陌生”物质的性质.在复习过程中,学生要能根据元素周期律掌握性质与位置、结构与性质之间的互推,达到高考对知识层面和方法层面的要求.
2 元素周期律的考查动向
新课程改革反映在高考上,主要是对学生的知识应用能力、信息提取能力、自主学习能力和核心素养的考查.因此学生在复习元素周期律时,不仅要深入了解相关知识,还要了解高考的考查动向,总结解题技巧,提高自身的应试能力.
2.1 综合推断元素及其化合物
元素周期律的应用主要以推断题为主,常结合元素化合物知识和元素反应原理等基本理论进行综合考查,解答此类试题需掌握“位(位置)、构(结构)、性(性质)”之间的关系.
例1科学家研究发现某离子液体有助于盐湖水提锂,其结构式如图1所示.其中X、Y、Z、W、E、Q均为短周期主族非金属元素,且原子序数依次增大.下列说法正确的是( ).
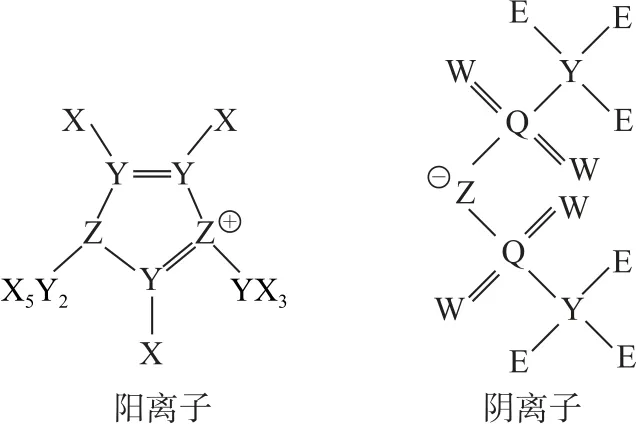
图1
A.最高价含氧酸的酸性:Z>Y>Q
B.简单氢化物的沸点:E>W>Y
C.Z元素最高价氧化物对应的水化物能与它的氢化物反应
D.简单离子的半径:Q>E>W>Z
【解题导引】由离子液体的结构式可知,X 和E 原子均可以形成1个共价键,Y 原子形成4个共价键,Z原子形成3个共价键,W 原子形成2个共价键,Q 原子形成6个共价键,则X 为H 元素、Y 为C 元素、Z为N 元素、W 为O 元素、E为F元素、Q 为S元素.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,硫元素的非金属性强于碳元素,则硫酸的酸性强于碳酸,选项A 错误.氟化氢和水都能形成分子间氢键,水分子形成氢键的数目多于氟化氢,分子间作用力强于氟化氢,沸点高于氟化氢,选项B错误.氮元素最高价氧化物对应的水化物为硝酸,氢化物为氨气,硝酸可与氨气反应生成硝酸铵,选项C 正确.电子层结构相同的离子,核电荷数越大,离子的半径越小,则电子层结构相同的氮离子、氧离子和氟离子中,氮离子的离子半径最大,选项D 错误.答案为C.
2.2 比较元素金属性或非金属性的强弱
在元素的金属性或非金属性类试题中,学生可依据“三表、三反应、两池”来进行判断,如图2所示.
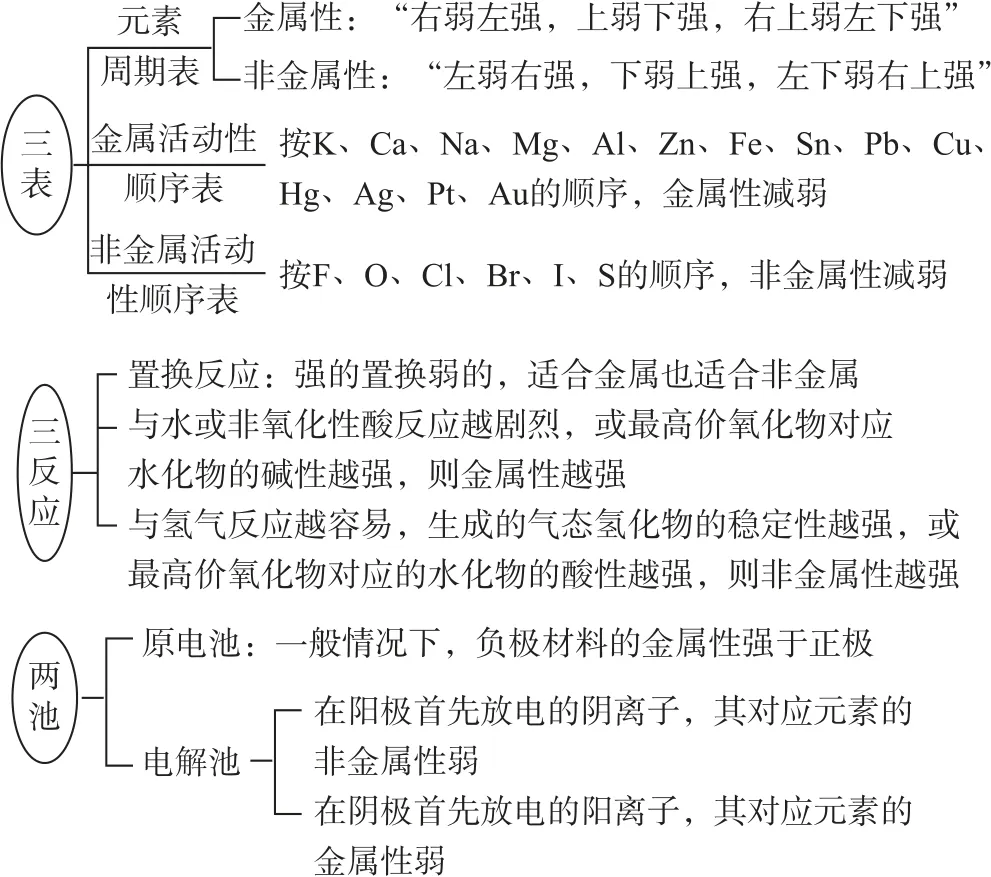
图2
例2A、B、C、D、E、F 是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图3所示,A 与C 能形成2种无色气体,C 是地壳中含量最多的元素,D 是地壳中含量最多的金属元素.
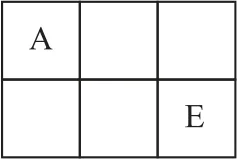
图3
(1)C 在元素周期表中的位置为_________.AE2的电子式为________.
(2)C、E、F 的单质中沸点最低的是_________(填化学式).
(3)C、D、E、F 的离子半径由大到小的顺序是_________(填离子符号).
(4)A 和C相比,非金属性较强的是________(填元素符号),下列事实能证明这一结论的是_________(填序号).
①常温下,A 的单质呈固态,C的单质呈气态
②C的氢化物的稳定性强于A 的氢化物
③A 与C形成的化合物中,A 呈正价
④C的氢化物的沸点高于A 的氢化物
(5)实验室制取F2气体的离子方程式为______.
【解题导引】C是地壳中含量最多的元素,则C 为O 元素,根据“A 与C能形成2种无色气体”可知A 为C元素,根据题意,B 只能为N 元素,结合A、E 在元素周期表中的相对位置可知,E 为S元素;D 是地壳中含量最多的金属元素,则D 为Al元素,F的原子序数最大,F只能为Cl元素.
2.3 比较微粒的半径
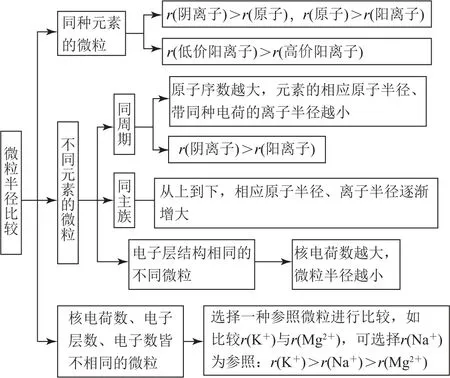
图4
例3短周期元素X、Y、Z、W在元素周期表中的相对位置如图5所示,其中W 原子的质子数是其最外层电子数的3倍,下列说法正确的是( ).
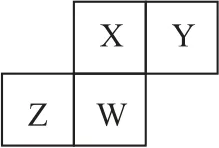
图5
A.原子半径:Z>W>X>Y
B.元素X、Y、Z、W 的最高化合价分别与其主族序数相等
C.最简单气态氢化物的热稳定性:X>Z>W
D.最高价氧化物对应水化物的酸性:X>Z>W
【解题导引】W 原子的质子数是其最外层电子数的3倍,所以W 是P元素.根据X、Y、Z与W 的相对位置,可知X、Y、Z 分别是N、O、Si.同周期从左到右半径减小,同主族从上到下半径增大,原子半径:Z>W>X>Y,选项A 正确.O 元素最高化合价与其主族序数不相等,选项B 错误.最简单气态氢化物的热稳定性:X>W>Z,选项C错误.最高价氧化物对应水化物的酸性:X>W>Z,选项D 错误.答案为A.
元素周期律知识在近几年的考查动向变化不大,学生在复习过程中要抓住重点知识,把握解题关键,灵活运用元素周期表的结构知识,准确判断元素及其化合物的性质,通过列表或构建思维导图的方式辨析物质之间的异同,然后依据物质的特殊性解答问题.
(完)
