霍乱弧菌溶血素HlyA的原核表达、纯化及多克隆抗体制备与鉴定
2022-09-14王光丽范婵王辉卢惠芳夏灵尹黄健闵迅
王光丽 范婵 王辉 卢惠芳 夏灵尹 黄健 闵迅
(1.遵义医科大学附属医院医学检验科,遵义 563003;2.遵义医科大学检验医学院,遵义 563003)
非O1/非O139群霍乱弧菌是指除O1群和O139群霍乱弧菌以外的其他霍乱弧菌的总称,可引起局部范围内的或零星的霍乱样腹泻疾病,常表现为轻度和短暂的胃肠道感染[1]。此外,非O1/非O139群霍乱弧菌还可引起肠道外感染,表现为败血症[2-4]、皮肤和软组织感染[5]、脑膜炎[6]、细菌性肺气肿[7]、甚至致人死亡[8-9]。本课题组前期也从两例脓毒血症患者中分离到两株非O1/非O139群霍乱弧菌,其中一例导致患者死亡[10]。近年来关于非O1/非O139群霍乱弧菌感染的病例报道越来越多[11],但人们对其致病机制知之甚少。因此,对非O1/非O139群霍乱弧菌生物学特性及致病性的研究具有重要价值。
霍乱弧菌溶血素(hemolysin,HlyA)是一种细胞外成孔毒素[12-13],主要由霍乱弧菌El Tor生物型和大多数非O1/非O139群菌株分泌[14-16]。HlyA可在靶细胞膜上形成跨膜寡聚β-桶状孔导致细胞膜通透性增加[12-13]。霍乱弧菌HlyA对包括Caco-2细胞(人结直肠腺癌细胞)在内的多种细胞系具有空泡化[17]和杀细胞活性[17-18]。HlyA还能诱导Caco-2细胞凋亡[1,19]。纯化的HlyA能够在兔结扎肠环模型、幼兔模型和乳鼠模型中诱导大量的肠液积聚[20-22]。与CT毒素诱导的水样腹泻不同,HlyA诱导的腹泻呈血性黏液样[23]。此外,在自然水生栖息环境中,非O1/非O139群霍乱弧菌通过分泌HlyA抑制或杀死异源细菌,获得局部生态环境的竞争优势[2]。因其强大的细胞杀伤活性,HlyA被认为在霍乱弧菌致病过程中起着关键作用,特别是在缺乏霍乱CT毒素的菌株中。在非O1/非O139群霍乱弧菌中HlyA的调控和致病机制目前还知之甚少。本研究拟通过原核表达系统表达纯化HlyA蛋白,并制备其多克隆抗体,为后续研究HlyA致病与调控机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 非O1/非O139群霍乱弧菌HN375(中国典型培养物保藏中心CCTCCAB2010-414)、大肠杆菌(Escherichia coli)DH5a 和 BL21(DE3)菌株及pET28a、pET32a、pCold TF质粒为本课题组保存。
1.1.2 实验动物 BALB /c小鼠(SPF级,6-8周,雌性)购自国家龋齿类动物实验中心。
1.1.3 主要试剂 蛋白质Maker、DL2000 DNA Maker、DL5000 DNA Maker、T4 DNA 连 接 酶、Primer Star高保真DNA聚合酶、限制性内切酶、DNA纯化试剂盒购自TaKaRa公司;质粒抽提试剂盒、琼脂糖凝胶回收试剂盒、细菌基因组DNA提取试剂盒购自北京天根公司;辣根过氧化物酶(HRP)标记的山羊抗鼠抗体购自Proteintech公司;Ni-NTA亲和层析柱购自美国GE Healthcare 公司;Omni-ECLTM基础型化学发光检测试剂盒购自雅酶公司;异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、氨苄青霉素、LB培养基等其他生化试剂购于生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 引物设计 根据标准菌株HN375中hlyA基因序列,为了构建pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA原核表达载体,分别设计了下列引物:pET28a-hlyA:上游引物F:5'-TTCCATATGTTAGTTC AAATCAAATTGAACCCCTTT-3',下游引物R:5'-CG GGATCCATGCCAAAACTCAATCGTTGC-3',下划线部分分别为Nde I和BamH I酶切位点。pET32a-hlyA:上游引物F:5'-GCGGCCGCTTAGTTCAAATCAAAT TGAACCCCTTT-3',下游引物R:5'-CGGGATCCAT GCCAAAACTCAATCGTTGC-3',下划线部分分别为Not I和BamH I酶切位点。pCold TF-hlyA上游引物F:5'-TTCCATATGTTAGTTCAAATCAAATTGAACCC CTTT-3',下游引物R:5'-CGGAATTCATGCCAAAAC TCAATCGTTGC-3',分别为Nde I和EcoR I酶切位点,引物由上海生工生物工程技术服务有限公司合成。
1.2.2 PCR扩增及切胶回收目的基因 以霍乱弧菌标准菌株HN375 DNA为模板进行PCR扩增hlyA基因。PCR 反应体系为 50 μL :ddH2O 31.5 μL、5×PSBuffer 10 μL、dNTP Mixture 4 μL、DNA模板2 μL、上游、下游引物各1 μL、Prime Star酶0.5 μL。PCR扩增条件为:98℃变性20 s,55℃退火15 s,72℃延伸2 min 30 s,30个循环,72℃延伸5 min。用1%琼脂糖凝胶对PCR产物进行电泳鉴定,再用琼脂糖凝胶DNA回收试剂盒进行纯化回收目的基因。
1.2.3 pET28a-hlyA、pET32a-hlyA和 pCold TF-hlyA重组质粒的构建 分别用相应的限制性内切酶对hlyA基因及pET28a、pET32a、pCold TF质粒进行双酶切,酶切条件为37℃,4 h。酶切后用1%琼脂糖凝胶对酶切产物进行电泳鉴定,然后纯化回收酶切质粒和目的基因,二者按摩尔比1∶10比例混合后加入T4 DNA连接酶在16℃条件下连接16 h。将连接产物转化入E.coli DH5a感受态细胞中,在含有相应抗生素的LB平板上涂布接种,培养24 h后挑选阳性克隆菌进行菌液PCR鉴定,阳性克隆增菌后提取重组质粒行双酶切验证,并送江苏塞索飞生物科技有限公司进行测序。
1.2.4 pET28a-hlyA、pET32a-hlyA和 pCold TF-hlyA重组质粒的诱导表达 将构建成功的pET28a-hlyA、pET32a-hlyA和 pCold TF-hlyA重组质粒分别转入E.coli BL21(DE3)表达菌中,分别涂布于含相应抗生素的LB平板上,培养24 h后筛选阳性菌落行菌液PCR鉴定。吸取阳性克隆菌液按1∶50比例转接于相应抗生素的LB培养液中,37℃,180 r/min恒温摇床中培养至OD600吸光度值约为0.6时,在不同的诱导条件下诱导后离心收集菌体,用1×Binding Buffer(300 mmol/L NaCl、10 mmol/L PBS,pH 8.0)重悬然后超声破菌,行SDS-PAGE电泳分析HlyA蛋白在上清和沉淀中的表达情况。
1.2.5 纯化诱导表达在上清的HlyA蛋白 使用Ni-NTA亲和层析柱纯化破菌后的上清,将上清液与Ni-NTA琼脂糖珠混合30 min以充分结合,再用含有10、20、30、40 mmol/L 咪唑的 1×Washing Buffer洗杂蛋白,最后使用含有300 mmol/L咪唑的1×Washing Buffer洗脱结合在Ni -NTA柱中的目的蛋白。行SDS-PAGE电泳分析蛋白纯度,以超滤杯进行脱NaCl、脱咪唑并浓缩蛋白。行BCA法对浓缩蛋白定量后分装保存于-80℃备用。
1.2.6 HlyA蛋白溶血活性分析 用生理盐水将新鲜兔红细胞配制成2%(V /V)的红细胞悬液,用PBS溶液将纯化的全长HlyA蛋白稀释至不同浓度(0,4和8 μg/mL)。再将2%兔红细胞悬液与稀释的HlyA蛋白溶液等体积混合,以PBS为阴性对照,以1%Trion-X为阳性对照,37℃温育3 h后低速离心取上清200 μL于96孔板,酶标仪测定541 nm处的光密度值。
1.2.7 多克隆抗体的制备及抗体效价的检测 将纯化HlyA蛋白与等体积Alum佐剂充分混合后,通过皮下多点注射免疫剂量为30 μg /只的BALB /c小鼠,同时设置注射Alum佐剂作阴性对照组。每次免疫间隔两周,共免疫3次,末次免疫后一周采尾静脉血分离血清测抗体效价。将HlyA蛋白用抗原包被液(pH 9.6的碳酸盐缓冲液)稀释为浓度10 μg/mL,100 μL/孔加至96孔酶标板,4℃过夜包被;以间接ELISA法测定抗体效价,显色终止后于酶标仪上读取450 nm下的吸光度值。结果判定标准:以稀释的待测标本A450/Alum佐剂对照A450≥2.1的最大稀释倍数判定为该抗体的滴度。
1.2.8 抗HlyA多克隆抗体抑制霍乱弧菌培养基上清溶血活性分析 收集OD600≈0.6时霍乱弧菌培养基上清预先与抗 HlyA抗血清按40∶1比例稀释,室温孵育1 h;再以上述抗体中和后的菌液上清:红细胞悬液按9∶1的比例加入玻璃试管中,以未加抗体的霍乱弧菌培养基上清作为未处理对照,以1%Trion-X为阳性对照,将试管放置于37℃恒温水浴箱中温育3 h后,低速离心取上清用酶标仪测定其在波长541 nm的光密度值并计算其溶血率。实验数据均重复3次以上,使用SPSS统计学软件进行数据分析,选用未配对的双尾t检验分析两组之间的差异,以P < 0.05表示差异有统计学意义。
1.2.9 Western blot检测HlyA蛋白的表达 将霍乱弧菌HN375野生菌株(WT)及其hlyA基因敲除菌株(HN375△hlyA)分别接种于LB液体培养基中,在37℃,180 r/min恒温摇床中培养至OD600≈0.6时,通过离心分离培养物上清液。如前所述[24],使用三氯乙酸-丙酮沉淀法从2 mL培养物上清液中沉淀出分泌的蛋白质,加1 × SDS -PAGE蛋白上样缓冲液于沉淀出分泌的蛋白质充分混匀,煮沸15 min,取20 μL样本行SDS -PAGE电泳,转膜、封闭后,用1∶1 000稀释的抗HlyA血清作为一抗,在4℃,80 r/min摇床上孵育过夜;用TBST洗涤3次后,用1∶5 000稀释的HRP标记羊抗鼠IgG作为二抗,室温80 r/min摇床上孵育1 h,经TBST洗涤3次后行ECL显色。取Western blot印迹条带对应位置的胶条送华大基因进行质谱鉴定分析。
2 结果
2.1 PCR扩增hlyA基因及构建pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA原核表达载体
以霍乱弧菌HN375菌株的DNA为模板行PCR扩增hlyA基因,行1.0%琼脂糖凝胶电泳分析PCR扩增产物,可见大小与预期分子量相符的目的条带(图1-A)。将hlyA基因克隆入pET28a、pET32a和pCold TF载体中,转化E.coli DH5a后筛选阳性克隆菌落行菌液PCR验证,结果分别如图1-B、1-C和1-D所示,均能扩增出与预期大小相符的目的条带。提取阳性菌落中的重组质粒进行测序,测序结果与GenBank数据库中hlyA基因序列相符,表明pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA重组质粒构建成功。
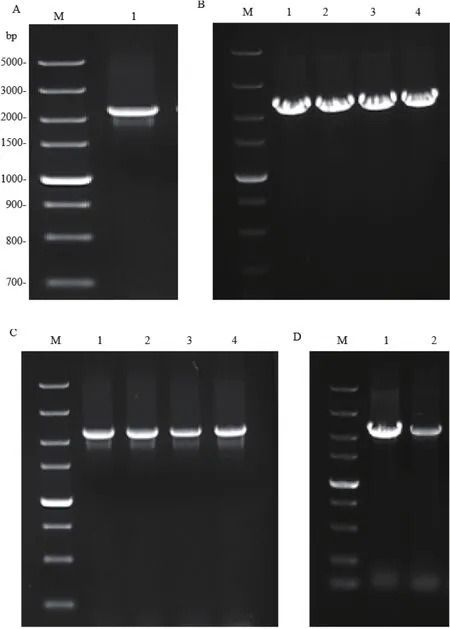
图1 pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA重组质粒的构建Fig.1 Construction of recombinant plasmids pET28ahlyA,pET32 a-hlyA and pCold TF-hlyA.
2.2 pET28a-hlyA和pET32a-hlyA重组质粒中HlyA蛋白的诱导表达
将含pET28a-hlyA和pET32a-hlyA重组质粒的E.coli BL21(DE3)表达菌分别在不同温度、转速和IPTG浓度下进行蛋白诱导表达,用SDS-PAGE电泳分析超声破菌后的沉淀与上清中HlyA蛋白的表达形式。结果如图2-A和2-B所示,在10℃、15℃和23℃等条件下,pET28a-hlyA- E.coli BL21(DE3)菌株中的HlyA蛋白都以包涵体形式表达,未获可溶表达形式。同样,pET32a-hlyA- E.coli BL21(DE3)表达菌分别在15℃、20℃和25℃等条件下诱导,HlyA蛋白也以包涵体形式表达于沉淀中(图3)。
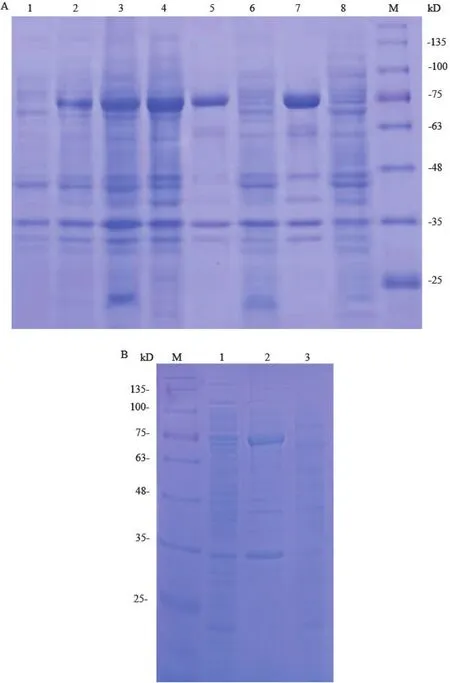
图2 pET28a-hlyA在E.coli BL21(DE3)中诱导表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of pET28a-hlyA expression pro-ducts in E.coli BL21(DE3)induced with IPTG
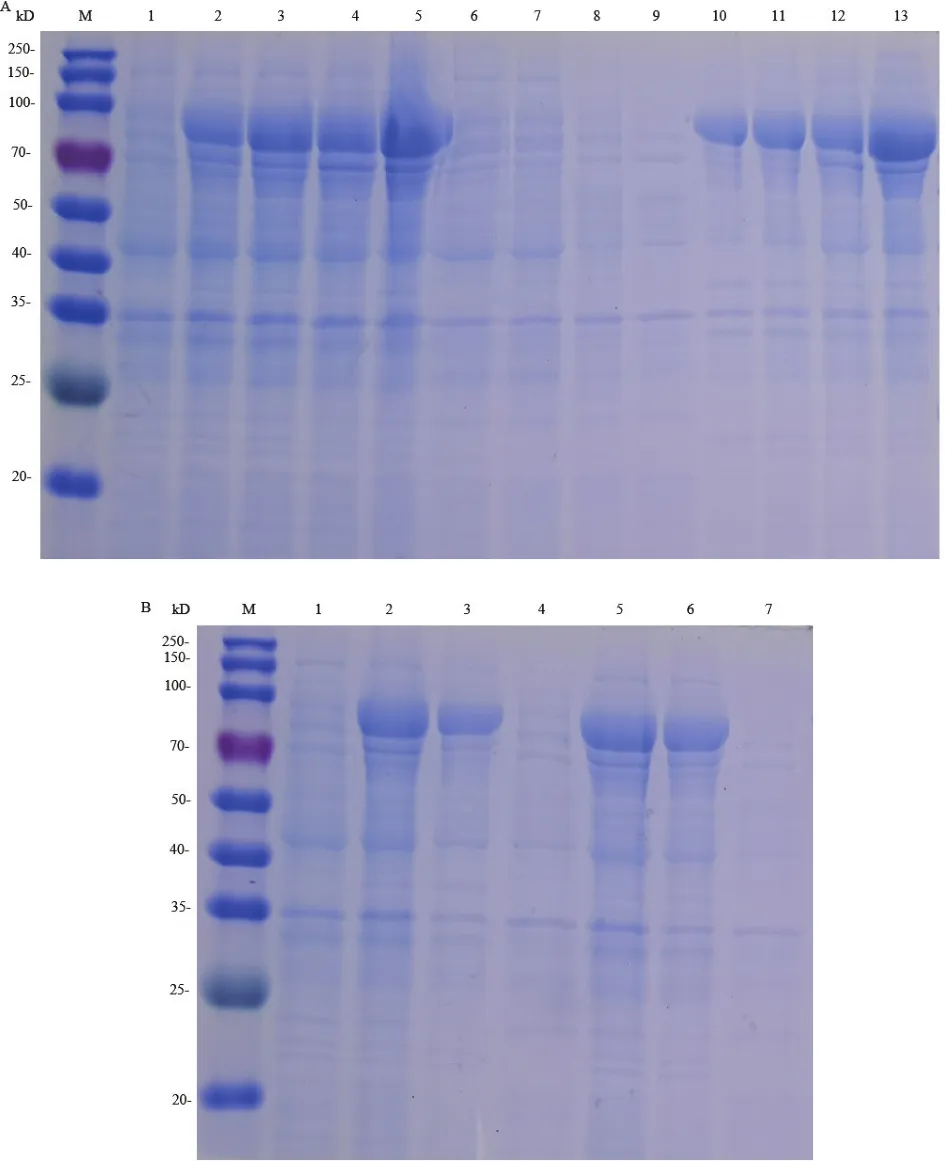
图3 pET32a-hlyA在E.coli BL21(DE3)中诱导表达的SDS-PAGE分析Fig.3 SDS-PAGE analysis of pET32a-hlyA expression products in E.coli BL21(DE3)induced with IPTG
2.3 pCold TF-hlyA重组质粒中HlyA蛋白的诱导表达及纯化
pCold TF-hlyA-E.coli BL21菌株在15℃、90 r/min、0.05 mmol/L IPTG条件诱导16 h后,在SDS-PAGE电泳图中可见分子量约为130 kD的目的蛋白表达,即82 kD的HlyA蛋白和48 kD的pCold TF标签蛋白之和(图4),超声破菌后沉淀与上清均有目的蛋白表达,表明在该菌株中可获得可溶形式的HlyA蛋白,经Ni-NTA柱亲和层析纯化后,获较纯的HlyA蛋白。
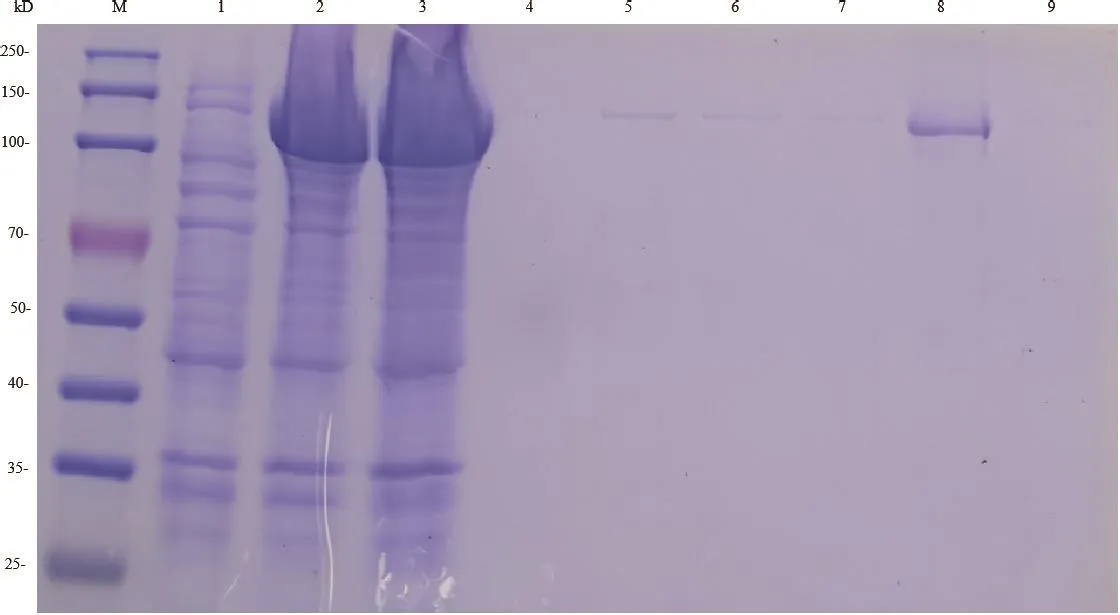
图4 pCold TF-hlyA在E.coliBL21中诱导表达和HlyA蛋白纯化的SDS-PAGE分析Fig.4 SDS-PAGE analysis of pCold TF-hlyA expression products in E.coli BL21 induced with IPTG and the purified HlyA protein
2.4 重组表达的HlyA蛋白的溶血活性分析
将不同浓度的HlyA蛋白与2%的新鲜兔洗涤红细胞悬液在37℃温育3 h后,行溶血活性测定。结果显示4和8 μg/mL的重组HlyA蛋白与兔红细胞共孵育未见明显的溶血现象(P>0.05)(图5),提示重组HlyA蛋白没有溶血活性。
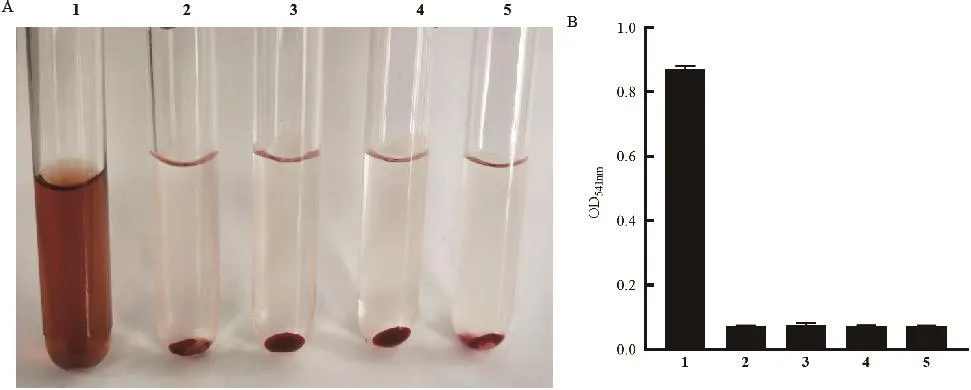
图5 重组表达的HlyA蛋白溶血活性测定Fig.5 Hemolytic activity determination of recombinant expressive protein HlyA
2.5 间接ELISA法检测抗HlyA蛋白多克隆抗血清效价
末次免疫一周后取小鼠尾静脉血行间接ELISA法测抗体效价,结果显示抗血清效价达到了1∶521 000(图6)。
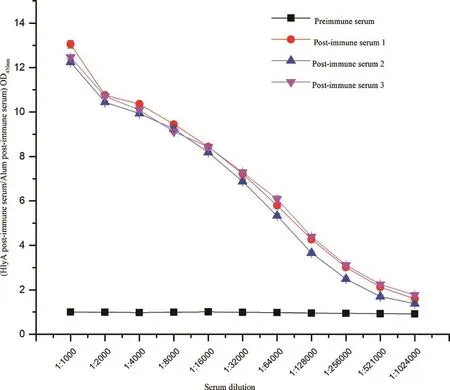
图6 HlyA蛋白免疫前后小鼠血清抗体效价分析Fig.6 Analysis of serum antibody titer in mice before and after immunization with HlyA protein
2.6 抗HlyA多克隆抗体特异性的鉴定
收集霍乱弧菌HN375菌株和HN375△hlyA菌株培养基上清,行Western blot分析,以制备的抗HlyA多克隆抗体作为一抗。结果显示在霍乱弧菌HN375野生株培养上清中出现了与预期分子量相符的特异性HlyA蛋白印迹条带,而HN375△hlyA菌株培养上清未见反应条带(图7)。为进一步鉴定该条带为HlyA蛋白,取该位置条带行质谱鉴定,结果显示该条带为霍乱弧菌HN375菌株分泌HlyA蛋白(图8)。以上结果提示,我们制备的抗HlyA多克隆抗体能特异识别霍乱弧菌中天然表达的HlyA蛋白。

图7 Western blot分析抗HlyA多克隆抗体的特异性Fig.7 Analysis specificity of anti-HlyA polyclonal antibody by Western blot
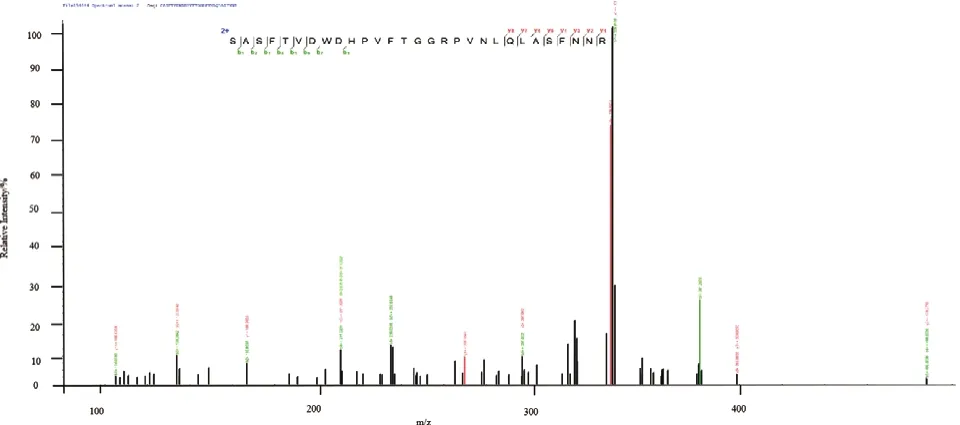
图8 HlyA蛋白的质量图谱Fig.8 Mass spectrometric profiles of HlyA protein
2.7 抗HlyA多克隆抗体能够抑制霍乱弧菌培养上清的溶血能力
为了验证抗HlyA多克隆抗体是否能够抑制霍乱弧菌HlyA的溶血活性,本研究选择非O1/非O139霍乱弧菌HN375菌株、HN375△tagH菌株(课题组前期构建的高表达HlyA的菌株)和本课题组前期分离的两株已鉴定为非O1/非O139霍乱弧菌的临床菌株进行抗体中和实验[10]。结果如图9所示,与未处理血清组和HlyA免疫前血清处理组相比,HlyA免疫后血清处理组明显抑制HlyA介导的溶血现象(P< 0.001)。
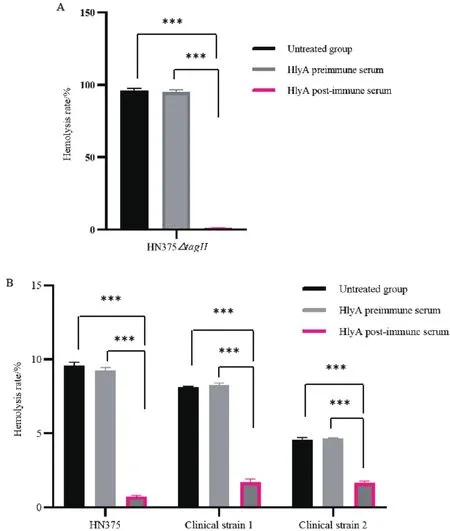
图9 抗HlyA多克隆抗体中和活性检测Fig.9 Detection of Anti-HlyA polyclonal antibody neutralization activity
3 讨论
HlyA蛋白被认为霍乱弧菌的致病过程中的重要毒力因子,但目前关于HlyA的调控机制和致病作用,尤其是在非O1/非0139群霍乱弧菌中的致病作用尚不完全清楚[1]。为深入研究HlyA的功能,我们拟通过原核表达系统获取HlyA蛋白并制备高效价的多克隆抗体,为后续研究奠定基础。目前大多数研究者主要通过快速蛋白液相色谱(FPLC)[1,25]或阴离子交换层析法[26]等方法分离纯化霍乱弧菌培养基上清的HlyA蛋白,但这些方法存在操作繁琐,实验和技术条件要求高,获得HlyA蛋白纯度不好等缺点。因此,本研究拟建立一种高效、方便的HlyA蛋白原核表达系统,以表达纯化可溶形式的HlyA蛋白。
本研究首先尝试以pET28a载体表达HlyA蛋白,虽经过温度、IPTG浓度和转数等条件优化,但是未获得可溶性表达形式的HlyA蛋白。有文献报道通过pET32a载体表达出HlyA蛋白,但并未说明其表达形式[22]。本研究也尝试以pET32a载体表达HlyA蛋白,但是同样未获得可溶性表达形式的HlyA。可能是HlyA蛋白在pET28a、pET32a中不能获得蛋白正确折叠形式,导致了包涵体表达。因此,我们进一步选择pCold TF载体表达HlyA蛋白,因为该载体带有可溶性标签Trigger Factor(TF),TF是原核核糖体相关的分子伴侣蛋白(48 kD),有利于新表达的多肽的共翻译折叠,且该载体是一种低温诱导的蛋白表达载体,低温诱导能增强目的蛋白的稳定性和能促使融合蛋白最大限度地以可溶形式存在,提高目的蛋白质的可溶性[27]。于是本研究尝试以pCold-TF载体表达HlyA蛋白,并获得高纯度和可溶性表达形式的HlyA蛋白。相比阴离子交换层析法等直接提取法,我们成功构建的以pCold-TF载体HlyA原核表达系统,能高效获取HlyA蛋白。纯化的HlyA蛋白免疫小鼠获得高效价的多克隆抗体,说明该蛋白具有较好的免疫原性。由于霍乱弧菌溶血素(hemolysin,HlyA)是由hlyA基因首先编码合成分子量为 82 kD prepro-HlyA前体蛋白,需在胞外经蛋白酶水解修饰后才形成成熟有活性的水溶性穿孔毒素[28-30]。然而在大肠杆菌系统可能缺少特定的蛋白酶水解修饰HlyA蛋白为成熟有活性的蛋白,因此,溶血活性实验显示原核表达的HlyA蛋白不能够裂解兔红细胞。由于本研究主要目的是制备HlyA多克隆抗体,无活性HlyA蛋白对免疫原性影响不大,抗体效价结果显示,原核表达的HlyA免疫原性较好,能获得高抗体效价的多克隆抗体。进一步的Western blot分析显示,制备的HlyA多克隆抗体能特异识别霍乱弧菌中天然表达的HlyA蛋白,质谱分析也验证了印迹条带的特异性,表明所制备的多克隆抗体具有识别天然HlyA蛋白的特异性。而抗体溶血抑制实验表明制备的HlyA多克隆抗体具备抑制霍乱弧菌HlyA蛋白溶血能力的生物学活性,提示该抗体在以后对抗霍乱弧菌致病过程中有可能作为HlyA中和抗体的潜力。
4 结论
本研究成功表达并纯化出可溶性的霍乱弧菌HlyA蛋白,免疫小鼠后获得高效价的抗HlyA多克隆抗体。该抗体能特异性识别霍乱弧菌天然表达HlyA蛋白,并能有效抑制霍乱弧菌的溶血活性。
(责任编辑 张婷婷)
