CYP2A6、ALDH2、FOSL1基因多态性对紫杉烷类基础化疗胃癌患者疗效的影响
2022-09-14王立晖
毛 灵,王立晖
江苏省丹阳市人民医院肿瘤内科,江苏丹阳 212300
胃癌是消化系统中常见的恶性肿瘤,病死率较高,研究发现80%以上的患者确诊时已进展至中晚期,且伴随广泛侵犯、远处转移,错过手术根治机会[1]。化疗可以缓解晚期胃癌患者的症状,其中紫杉烷类细胞毒药物联合其他化疗药(铂类、氟尿嘧啶类)是治疗中晚期胃癌的标准化疗手段[2]。肿瘤细胞的基因多态性使得肿瘤细胞呈现异质性,导致化疗药物疗效存在较大的个体差异,因此针对基因多态性调整化疗方案对于临床开展精准治疗具有重要指导意义。乙醛脱氢酶(ALDH2)、FOS样抗原1(FOSL1)均在肿瘤的发生、发展中发挥重要调控作用,如FOSL1为原癌基因c-Jun、KRAS的下游效应分子,可促进肿瘤细胞的增殖、分化,ALDH2基因多态性与胃癌易感性存在相关性,突变可导致乙醛代谢异常,乙醛是严重致癌物质,在长期饮酒、食用辛辣和腌制食物的人群中ALDH2基因突变者具有更高的胃癌发生风险[3-5]。细胞色素酶2A6(CYP2A6)基因多态性影响CYP2A6肝药酶的表达、酶活性,可影响肿瘤化疗药物(5-氟尿嘧啶)的血药浓度,从而影响化疗药物的治疗效果[6]。本研究通过检测ALDH2、FOSL1、CYP2A6基因多态性,并研究其与胃癌患者紫杉烷类基础化疗临床效果的相关性,探讨3者在胃癌治疗中的临床意义,为胃癌精准医疗探寻理论依据。
1 资料与方法
1.1一般资料 选取2018年5月至2020年4月于本院接受治疗的152例胃癌患者为研究对象,均接受紫杉烷类基础化疗。本研究获得本院伦理委员会批准。纳入标准:(1)符合《胃癌诊疗规范(2011年版)》[7]中关于胃癌的诊断标准,经过病理切片、影像学检测确诊;(2)病理学分期为Ⅲ~Ⅳ期,不适合手术切除,至少有1个可测量病灶;(3)机体状况可耐受化疗,Karnofsky评分≥60分,预计生存期≥3个月;(4)接受化疗后均可完成1年随访,所有患者均签署知情同意书。排除标准:(1)治疗过程中存在严重不良反应,如神经毒性、中性粒细胞降低、外周神经炎等,危及患者生命安全;(2)入组前接受过化疗;(3)合并其他危及生命的疾病;(4)严重心、肝、肾功能障碍;(5)哺乳期或孕产期妇女;(6)药物过敏或者不耐受。
1.2治疗方法 紫杉烷类基础化疗,对于存在基因突变的患者,可联合靶向治疗,具体用药方案参照《胃癌的规范化治疗》[8]中的常规推荐剂量。
1.3基因型分析方法 治疗前抽取患者外周静脉血3 mL,EDTA抗凝处理,3 000 r/min离心5 min,取上清保存-20 ℃待测。通过QIAAMP DNA Blood Mini Kit试剂盒提取血浆DNA,根据Genebank发布的人CYP2A6、ALDH2、FOSL1基因序列,采用Primer 5.0软件分别对相关位点设计引物。聚合酶链反应(PCR)反应体系为25.0 μL,其中含10×buffer 2.5 μL、 dNTPS 1.0 μL、DNA模板1.0 μL、引物1.0 μL、Taq DNA聚合酶0.4 μL、ddH20补足。扩增方法:95 ℃条件下预变性5 min,94 ℃变性0.5 min,55 ℃退火0.5 min,72 ℃延伸10 min,共40个循环。通过试剂盒回收目标片段,处理后通过DNA测序仪完成测定。
1.4疗效评价 所有患者均接受紫杉烷类基础化疗8周,临床效果分为完全好转(CR)、部分好转(PR)、疾病稳定(SD)和疾病进展(PD)。CR:肿瘤病灶消失,生命体征指标正常,且持续时间至少4周;PR:病灶面积缩小≥30%,持续时间至少4周;SD:病灶面积增加≤20%,减少<30%;PD:病灶面积增加≥20%,或者出现新发病灶[8]。总体客观缓解率=(CR+PR)/总例数×100%。
1.5统计学处理 采用SPSS20.0软件进行数据分析。计数资料以例数或百分率表示,采用χ2检验进行比较,采用Log-rank检验比较不同基因型的生存情况,采用Cox比例风险模型评估各因素对化疗效果的影响。以P<0.05表示差异有统计学意义。
2 结 果
2.1CYP2A6、ALDH2、FOSL1的基因型及等位基因频率分布情况 CYP2A6基因有3个位点存在基因多态性,rs28399433(TT型96例、TG型48例、GG型8例)、rs8192720(CC型110例、CT型38例、TT型4例)、rs8192725(CC型105例、CT型42例、TT型5例)。ALDH2基因rs671位点GG型124例、GA型18例、AA型10例。FOSL1基因有2个位点存在基因多态性,rs1892901(GG型94例、GA型40例、AA型18例)、rs637571(GG型78例、GA型62例、AA型12例)。以上各基因位点基因型的观测值、期望值符合Hardy-Weinberg平衡定律。
2.2临床疗效 152例患者中CR 24例、PR 62例、SD 44例、PD 22例,总体客观缓解率(CR+PR)为56.58%(86例)。
2.3化疗疗效的单因素分析 依据治疗效果对患者进行分组,CR和PR为化疗有效组(86例),SD和PD为化疗无效组(66例)。两组患者的TNM分期、CYP2A6 rs8192725、ALDH2 rs671、FOSL1 rs1892901基因型比较,差异有统计学意义(P<0.05),见表1。
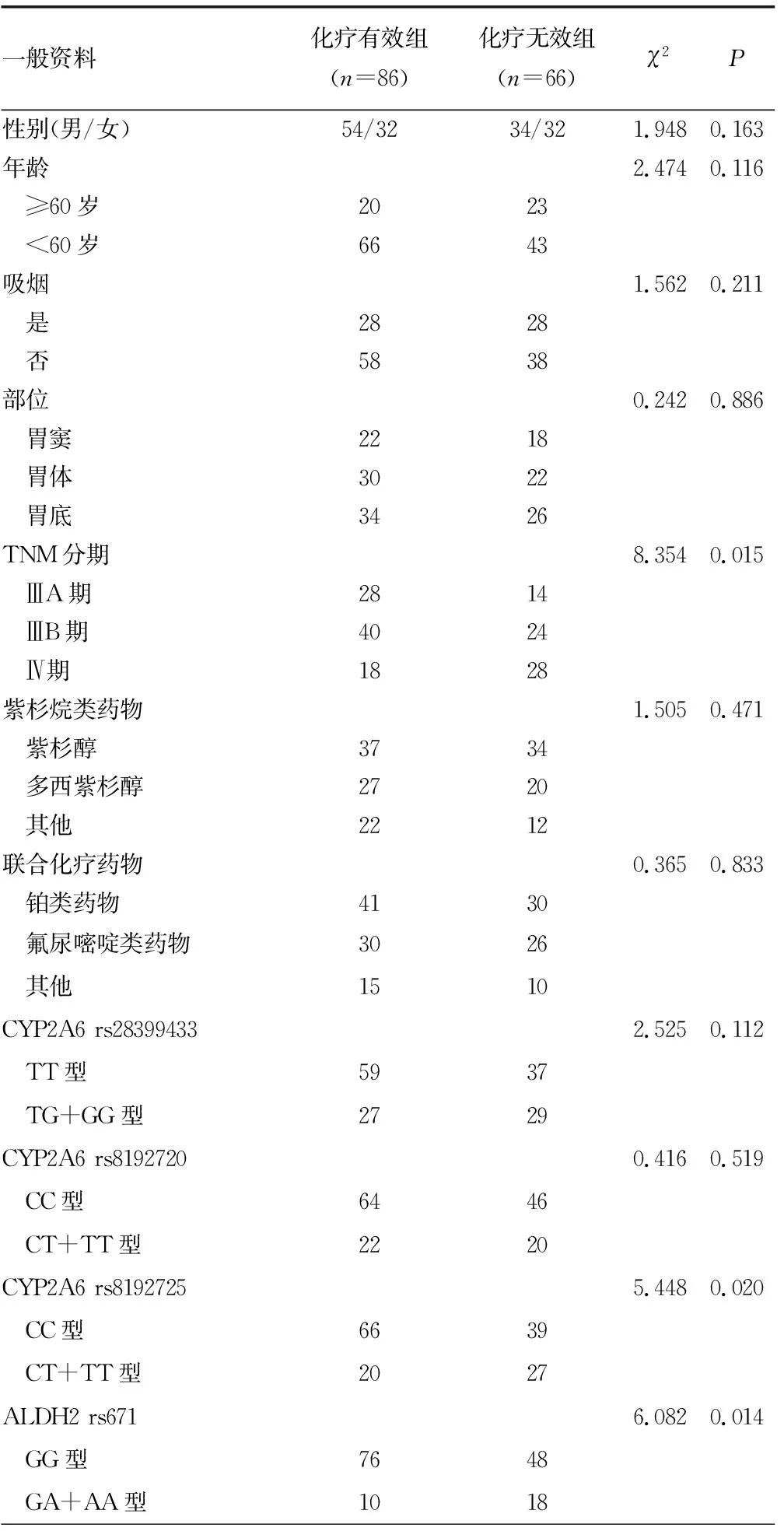
表1 化疗疗效的单因素分析(n/n或n)

续表1 化疗疗效的单因素分析(n/n或n)
2.4影响化疗结局的多变量Cox模型 经过多变量校正,TNM分期(HR值为2.654)、CYP2A6 rs8192725基因型(HR值为2.085)、ALDH2 rs671基因型(HR值为2.960)以FOSL1 rs1892901基因型(HR值为1.823)影响化疗结局(P<0.05),见表2。

表2 影响化疗结局的多变量Cox模型
2.5CYP2A6、ALDH2、FOSL1基因多态性对预后的影响 化疗结束后随访1年,死亡36例。CYP2A6 rs8192725基因型CC、其他(CT、TT)死亡人数分别为20、16例,生存曲线见图1,不同基因型死亡率差异有统计学意义(χ2=4.039,P=0.045)。ALDH2 rs671基因型GG、其他(GA、AA)死亡人数分别为25、11例,生存曲线见图2,不同基因型病死率差异有统计学意义(χ2=4.622,P=0.032)。FOSL1 rs1892901基因型GG、其他(GA、AA)死亡人数分别为16、20例,生存曲线见图3,不同基因型病死率差异有统计学意义(χ2=6.051,P=0.014)。
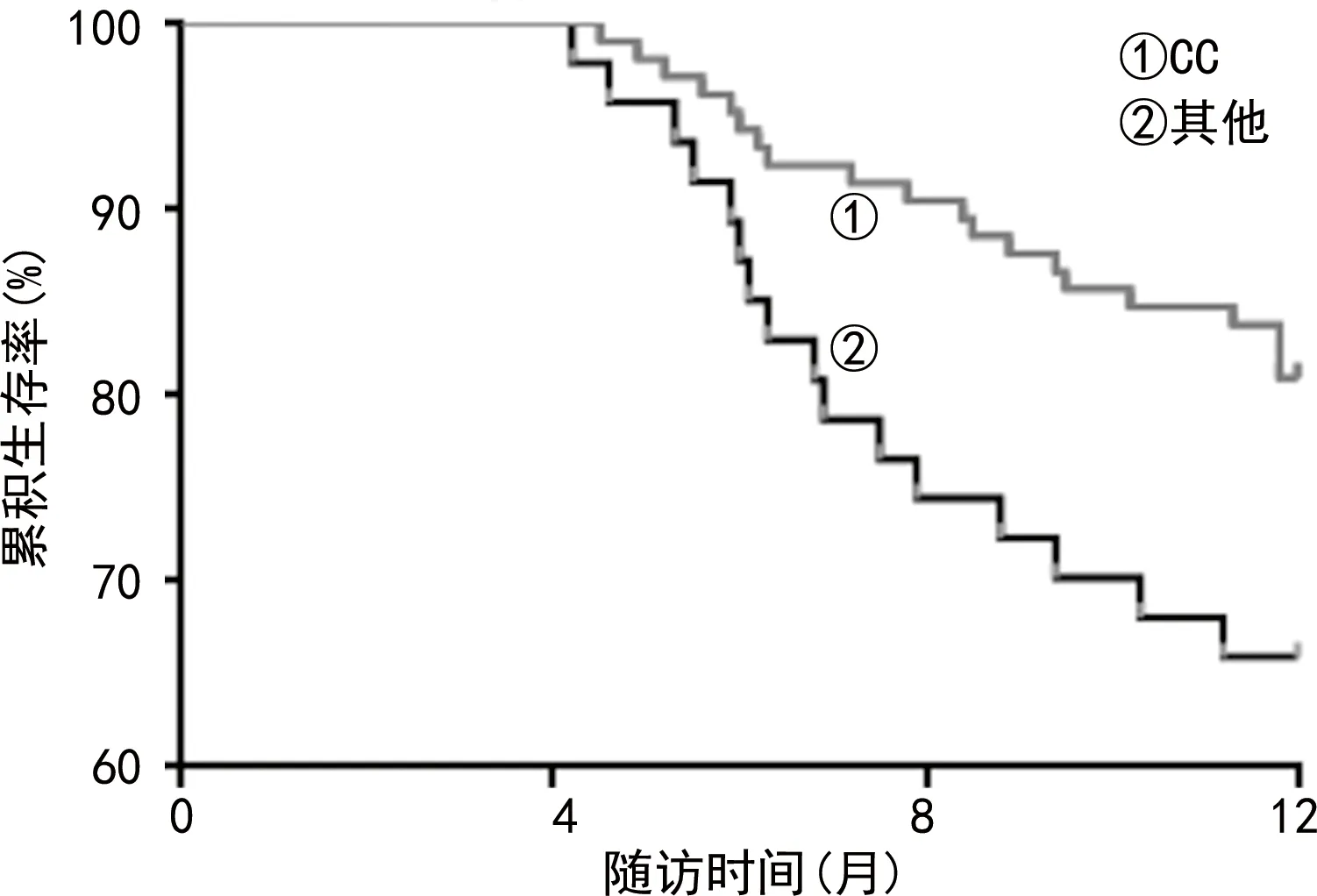
图1 CYP2A6基因rs8192725位点CC基因型、其他基因型的生存曲线

图2 ALDH2基因rs671位点GG基因型、其他基因型的生存曲线

图3 FOSL1基因rs1892901位点GG基因型、其他基因型的生存曲线
3 讨 论
化疗是中晚期胃癌的常见治疗手段,其中紫杉醇联合铂类、氟尿嘧啶类药物已广泛用于晚期胃癌的治疗[9]。多项研究发现,晚期胃癌患者接受以紫杉醇为基础的化疗方案,随访3~5年,病死率均较高,因此研究影响患者疗效的相关因素对于个性化治疗具有重要意义[10-11]。基因多态性已成为影响化疗药物疗效、毒性等的重要因素,如CYP2A6突变导致肝药酶CYP2A6活性改变,突变型胃癌患者相对野生型患者具有更低的5-氟尿嘧啶血药浓度,从而降低化疗药疗效[12]。本次研究结果发现,CYP2A6基因有3个位点存在基因多态性,rs28399433、rs8192720、rs8192725,其中CYP2A6 rs8192725基因型(HR值为2.085)是影响化疗结局的独立危险因素,携带突变等位基因的杂合子(TC)及突变纯合子(TT)对含紫杉烷类基础化疗方案的敏感率均低于野生纯合子(CC),且随访1年,CYP2A6 rs8192725位点CC基因型的病死率显著低于其他基因型(TC、TT),表明等位基因T→C突变会降低化疗效果。杨铁健等[13]研究发现,CYP2A6 rs8192725位点基因突变可影响CYP2A6 mRNA的表达,从而影响胃癌患者术后接受以替吉奥为基础的辅助化疗的预后,因此可基于个体基因组差异而指导临床化疗方案的制订,从而实现化疗的最大生存获益。
醛类物质是严重的致癌物质,ALDH2可促进乙醛、其他脂肪族醛转变成非毒性的乙酸盐,ALDH2基因突变可影响转变效率,进而调控肿瘤的发生、发展,且研究已证实ALDH2基因多态性与胃癌易感性存在相关性[13]。本次研究发现,ALDH2 rs671基因型(HR值为2.960)是影响化疗结局的独立危险因素,携带突变等位基因的杂合子(GA)及突变纯合子(AA)对含紫杉烷类基础化疗方案的总体客观缓解率均低于野生纯合子(GG),且随访1年,ALDH2 rs671位点GG基因型的病死率显著低于其他基因型(GA、AA),表明突变等位基因A会降低化疗效果。ALDH2 rs671位点的野生纯合子(GG)具有正常的催化乙醛活性,突变杂合子型GA的催化乙醛活性下降,而纯合突变则失去催化乙醛活性,乙醛可进一步导致DNA损伤,其中N(2)-亚乙基-2,-脱氧鸟苷为DNA损伤产物,故而突变型具有更高的肿瘤发生风险[14]。研究认为[15],ALDH2 rs671位点的等位基因G突变为A,使得谷氨酸突变成赖氨酸,导致相应蛋白质的结构功能域发生改变,增加了DNA损伤修复能力,故而此类患者对含紫杉烷类基础化疗药物的敏感性明显降低。
FOSL1 mRNA可在胃癌、乳腺癌、卵巢癌等恶性肿瘤中异常表达,体外研究证实鳞状细胞癌细胞系中FOSL1基因高表达,可促进肿瘤细胞的生长、增殖、侵袭等[16],其中胃癌高表达可调节PI3k/Akt 、p53信号通路而促进胃癌的发生、发展。本次研究结果显示,FOSL1基因的rs1892901、rs637571位点存在基因多态性,其中FOSL1 rs1892901基因型(HR值为1.823)与化疗结局密切关联,该位点纯合突变基因型(GG)病死率均低于其他基因型(P<0.05),表明纯合突变可降低紫杉烷类基础化疗疗效,增加胃癌患者死亡风险。FOSL1基因编码的亮氨酸拉链蛋白参与JUN家族蛋白形成异聚体,调控肿瘤细胞的增殖、分化,卢敏莹等[17]和刘凯华等[18]通过体外细胞实验证实经miR-200c-3p靶向野生型FOSL1可增加乳腺癌对化疗的敏感度,过表达的FOSL1可上调乳腺癌细胞对化疗药物的耐受程度,结合本次研究结果可推测FOSL1基因rs1892901位点多态性影响胃癌对含紫杉烷类基础化疗药的灵敏度,从而影响胃癌患者的疗效。另外,本次研究存在一定局限性,纳入样本量有限,研究结果可能存在一定程度偏倚。ALDH2、FOSL1、CYP2A6基因多态性在化疗灵敏度方面的相互作用尚不明确,所以下一步应该扩大样本量、多样性进行充分论证。
综上所述,胃癌患者CYP2A6、ALDH2、FOSL1基因多态性可影响紫杉烷类基础化疗的疗效以及生存率,提示可根据患者基因型来指导个体化治疗。
