早期应用促红细胞生成素对早产儿神经系统保护的有效性和安全性的Meta分析
2022-09-14唐亮陈晓晴谭伟强
唐亮,陈晓晴,谭伟强
早产儿神经系统发育不成熟,在缺血缺氧和感染等因素影响下容易出现脑损伤及远期不良预后,表现为精神运动发育迟缓、认知缺陷、视听觉障碍和脑性瘫痪(简称脑瘫)等神经系统后遗症,严重影响其生存质量[1-2]。全球每年约有1 500万名早产儿出生,且呈逐年升高趋势[3]。因此,研究和探索早期干预措施以促进早产儿神经系统发育,提高生存质量,是重大的公共卫生问题。
促红细胞生成素(erythropoietin,EPO)是一种多效性细胞生长因子,广泛分布于中枢神经系统的多种细胞中,具有神经保护和损伤后细胞修复效应,是防治早产儿脑损伤和改善神经系统发育最有前途的药物之一[4-5]。临床研究显示,早期应用EPO不仅可以为早产儿提供短期的神经保护作用,显著减少脑损伤发生率,同时能降低早产儿神经系统的远期不良预后风险[6-7]。然而,目前EPO的治疗方案不同,各研究结果差异较大,并且EPO发挥神经保护作用的同时是否有短期或长期的不良反应尚不清楚。因此,本文系统评价生后早期应用EPO对早产儿神经系统保护的有效性和安全性,为EPO临床应用提供证据。
1 资料与方法
1.1 文献纳入标准 (1)研究类型:随机对照试验(randomized controlled trials,RCTs)。(2)研究对象:胎龄<37周的早产儿,其种族、国籍不限。(3)干预措施:治疗组:在常规治疗的基础上早期(生后≤7 d)应用EPO治疗;对照组:接受常规治疗。
1.2 文献排除标准 (1)非中、英文文献;(2)无法获取全文;(3)数据不完整或无法获得相关数据;(4)实验设计或分组不严谨;(5)重复发表的文献。
1.3 结局指标 (1)疗效评价:①主要结局指标:校正年龄12~24个月时智力发育指数(mental development index,MDI)、运动发育指数(psychomotor development index,PDI)及MDI<70、PDI<70的发生率;②次要结局指标:脑瘫、视力损害、听力损害以及其他神经发育障碍。(2)安全性评价:新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、脑室周围白质软化(periventricular leukomalacia,PVL)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、≥Ⅲ期早产儿视网膜病(retinopathy in prematurity,ROP)、Ⅲ/Ⅳ度脑室内出血(intraventricular hemorrhage,IVH)的发生率。
1.4 文献检索策略 计算机检索PubMed、Embase、The Cochrane Library、中国生物医学文献数据库(CBM)、中国知网(CNKI)、万方数据库(WanFang Data)和维普中文期刊全文数据库(VIP)等数据库,搜集有关EPO对早产儿神经系统保护的临床RCTs,检索时限均从建库到2020年12月31日。此外,追溯纳入文献的参考文献,以补充获取相关文献。检索采取主题词和自由词相结合的方式进行。中文检索词包括:神经发育、早产儿、极低出生体重儿、促红细胞生成素、随机对照试验等;英文检索词包括:neurodevelopment,prematue infants,preterm infants,very low birth weight,erythropoietin,EPO、randomized controlled trials等。
1.5 文献筛选与资料提取 由2名研究者独立筛选文献、提取资料并交叉核对。如有分歧,则通过讨论或与第三方协商解决。文献筛选时首先阅读文题,在排除明显不相关的文献后,进一步阅读摘要和全文以确定是否纳入。如有需要,通过邮件、电话联系原始研究作者获取未确定但对本研究非常重要的信息。资料提取内容包括:(1)纳入研究的基本信息,包括第一作者、发表年份等;(2)研究对象的性别、胎龄、出生体质量等;(3)干预措施、治疗时间和随访时间等;(4)偏倚风险评价的关键因素;(5)所关注的结局指标和结果测量数据,临床有效性、安全性等。
1.6 纳入研究的偏倚风险评价 由2名研究者独立评价纳入研究的偏倚风险,并交叉核对结果。偏倚风险评价采用Cochrane手册5.1.0推荐的RCTs偏倚风险评价工具。
1.7 统计学分析 采用RevMan 5.3软件进行Meta分析。二分类变量采用比值比(odds ratio,OR)为效应分析统计量,并提供其95%可信区间(confidence interval,CI)。纳入研究结果间的异质性采用χ2检验进行分析(检验水准为α=0.1),同时结合I2定量判断异质性大小。若各研究结果间无统计学异质性,则采用固定效应模型进行Meta分析;若各研究结果间存在统计学异质性,则进一步分析异质性来源,在排除明显临床异质性的影响后,采用随机效应模型进行Meta分析。Meta分析的水准设为α=0.05。明显的临床异质性采用亚组分析或敏感性分析等方法进行处理,或只行描述性分析。
2 结果
2.1 文献筛选流程及结果 初步检索获得相关文献共327篇,剔除重复文献得到172篇,阅读文题和摘要后得到文献34篇,通过阅读全文复筛,排除无主要结局指标、重复发表的文献后得到文献16篇,最终纳入16个RCTs[8-23]。文献筛选流程及结果见图1。
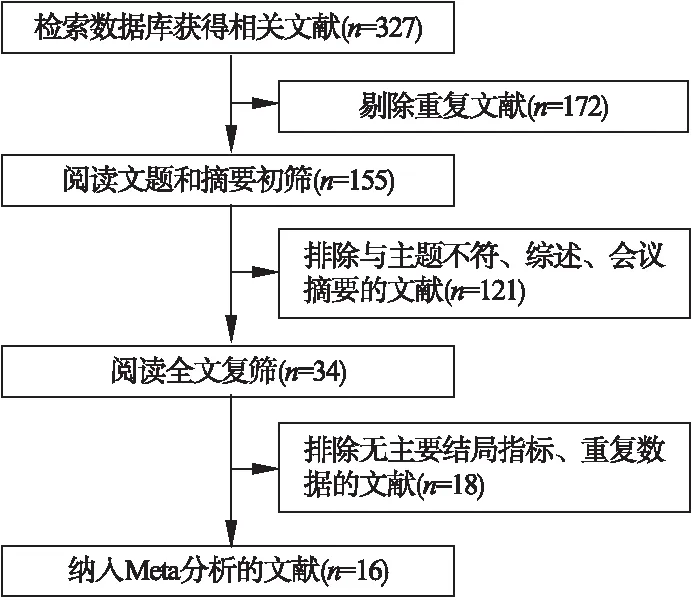
图1 文献筛选流程及结果
2.2 纳入研究的基本特征 见表1。

表1 纳入研究的基本特征
2.3 纳入研究的偏倚风险评价结果 见图2、3。

图2 纳入研究文献偏倚所占比例

图3 纳入研究文献的偏倚风险评价
2.3 Meta分析结果
2.3.1 有效性分析
2.3.1.1 早产儿校正年龄12~24个月时MDI、PDI评分 分别纳入8项[10,15,16,18-23]和7项[10,16,18-22]RCTs,各项研究间差异有统计学异质性(I2≥50%,P≤0.10),均采用随机效应模型分析。Meta分析结果显示,EPO组MDI评分[MD=7.26,95%CI(2.99,11.53),P=0.000 9]和PDI评分[MD=4.88,95%CI(1.76,7.99),P=0.002]均高于对照组。亚组分析结果显示,小剂量EPO组MDI评分[MD=8.73,95%CI(3.88,13.58),P=0.000 4]、PDI评分[MD=6.72,95%CI(2.85,10.59),P=0.000 7]均高于对照组,但大剂量EPO组与对照组MDI和PDI评分差异无统计学意义,见图4、5。

图4 早产儿校正年龄12~24个月时MDI评分的Meta分析森林图

图5 早产儿校正年龄12~24个月时PDI评分的Meta分析森林图
2.3.1.2 早产儿校正年龄12~24个月时MDI<70、PDI<70的发生率 分别纳入6项[8-10,15-17]和4项[8,10,16-17]RCTs,各项研究间同质性好(I2<50%,P>0.10),采用固定效应模型分析。Meta分析结果显示,EPO组MDI<70发生率[OR=0.52,95%CI(0.37,0.71),P<0.000 1]低于对照组,但PDI<70发生率[OR=1.30,95%CI(0.88,1.92),P=0.19]与对照组相比,差异无统计学意义。亚组分析结果显示,仅小剂量EPO亚组MDI<70发生率[OR=0.41,95%CI(0.27,0.64),P<0.000 1]低于对照组,差异有统计学意义。此外,无论大剂量EPO亚组[OR=1.14,95%CI(0.74,1.75),P=0.56]或小剂量EPO亚组[OR=2.46,95%CI(0.94,6.45),P=0.07],PDI<70发生率与对照组差异均无统计学意义。见图6、7。

图6 早产儿校正年龄12~24个月时MDI<70发生率的Meta分析森林图
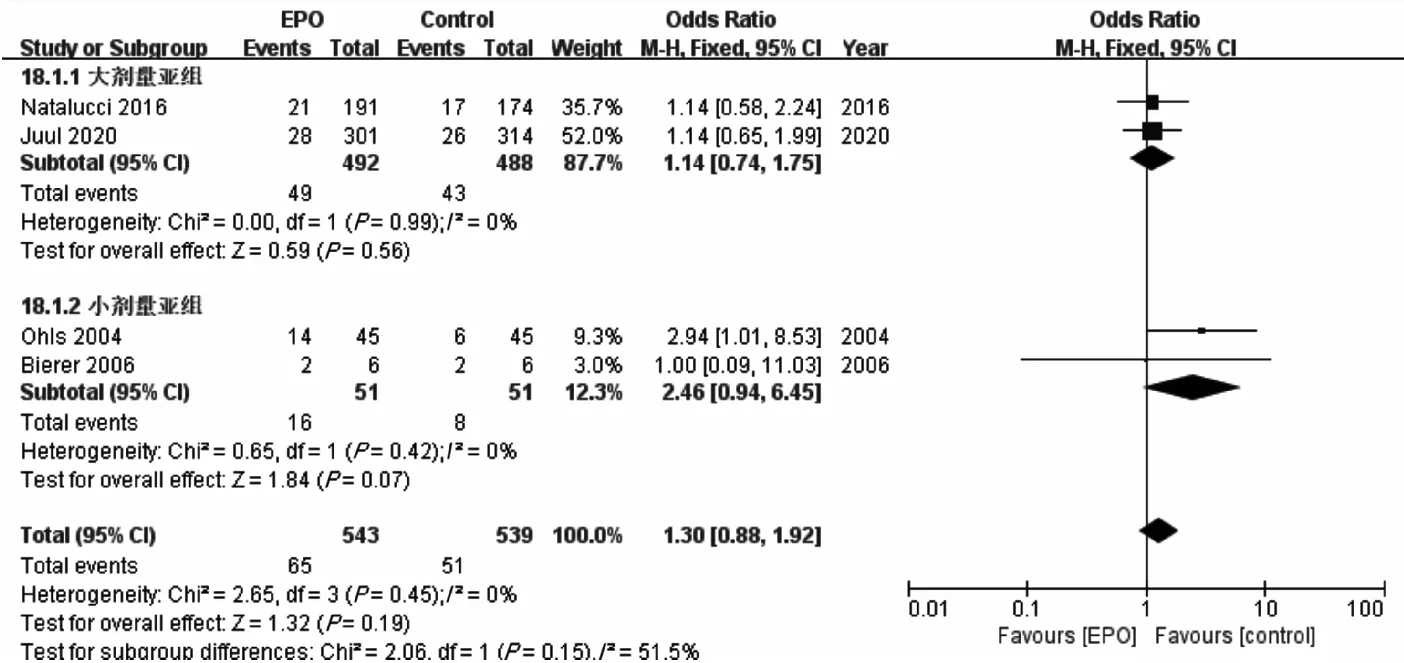
图7 早产儿校正年龄12~24个月时PDI<70发生率的Meta分析森林图
2.3.1.3 早产儿校正年龄12~24个月时神经系统发育不良结局比较 包括脑瘫、听力损害、视力损害的影响,分别纳入6项[8-10,15-17]、5项[9-10,15-17]、5项[9-10,15-17]RCTs,各研究间同质性好(I2≤50%,P≥0.10),采用固定效应模型进行分析。其他神经发育障碍发生率的影响纳入5项[9-10,15-17]RCTs,各研究异质性较大(I2>50%,P<0.10),采用随机效应模型进行分析。结果显示,脑瘫[OR=0.72,95%CI(0.44,1.18),P=0.19]、听力损害[OR=0.40,95%CI(0.13,1.23),P=0.11]、视力损害[OR=0.92,95%CI(0.21,4.11),P=0.91]、其他神经发育障碍[OR=0.53,95%CI(0.28,0.99),P=0.05],组间比较差异无统计学意义,见表2。
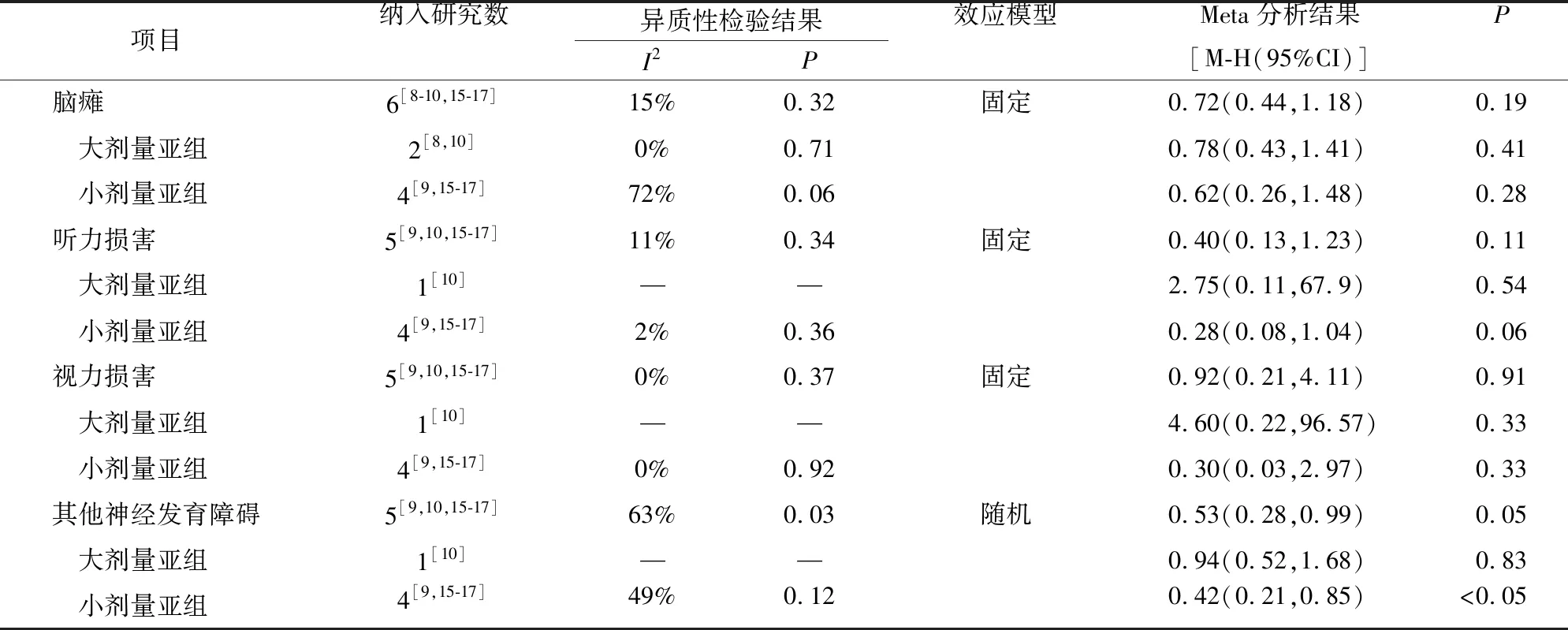
表2 EPO对早产儿神经发育不良结局发生率影响的Meta分析
2.3.2 安全性分析 本Meta分析针对EPO治疗后PVL、ROP(≥Ⅲ期)、BPD、NEC的发生情况进行比较,分别纳入4项[8-11]、8项[8,10-13,15-17]、9项[8-12,14-17]、9项[8-12,14-17]RCTs,各项研究间同质性好(I2≤50%,P≥0.10),采用固定效应模型分析。IVH(Ⅲ/Ⅳ度)纳入8项[8-11,14-17]RCTs,各研究异质性较大(I2≥50%),采用随机效应模型进行分析。Meta分析结果显示,EPO组NEC[OR=0.50,95%CI(0.34,0.73),P=0.000 3]、IVH[OR=0.71,95%CI(0.55,0.91),P=0.007]和PVL[OR=0.66,95%CI(0.49,0.88),P=0.006]的发生率均低于对照组,差异均有统计学意义(P<0.05);BPD[OR=0.98,95%CI(0.82,1.16),P=0.78]和ROP[OR=0.93,95%CI(0.65,1.33),P=0.69]发生率组间差异无统计学意义。见表3。
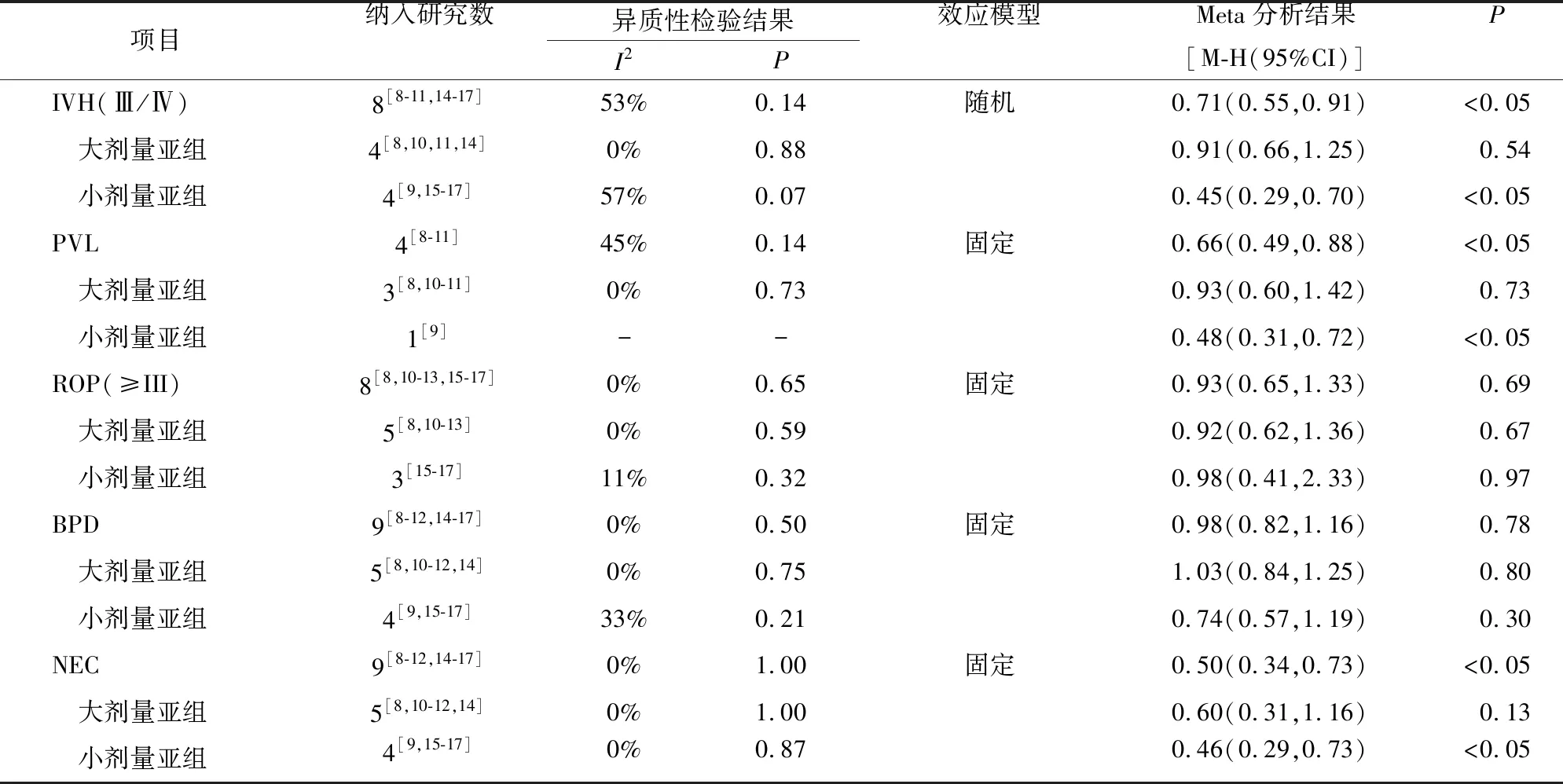
表3 早产儿应用EPO安全性的Meta分析
3 讨论
3.1 EPO对早产儿神经发育的保护作用 本Meta分析共纳入了16篇国内外RCTs研究,结果显示,早期应用EPO可显著提高早产儿校正年龄12~24个月时MDI和PDI评分,并且可降低MDI<70分的发生率,提示EPO可有效改善早产儿认知及运动发育水平。然而,亚组分析结果显示,小剂量EPO神经保护效果良好,但大剂量EPO治疗组MDI、PDI评分以及MDI<70、PDI<70发生率与对照组相比差异无统计学意义。分析可能的原因有:(1)在校正年龄24月龄内评估神经发育预后可能为时尚早,EPO的潜在神经保护作用尚未完全发挥出来,需要更长期的随访来进一步评估其疗效。(2)可能与纳入文献的样本量较少有关。(3)可能与大剂量亚组中相关研究应用EPO单次剂量或累积剂量超过有效浓度范围有关。Statler等[24]在新生小鼠脑损伤模型药代动力学试验中发现,EPO的神经保护作用呈U形曲线,剂量过高或过低均可导致疗效下降。Kellert等[25]研究显示大剂量EPO在新生儿缺氧缺血性脑损伤模型中具有神经保护作用,可抑制神经元细胞凋亡、促进胶质细胞增生并减轻脑损伤,但并未因剂量及给药次数的增加而获得更大的效益,甚至在极高浓度下可产生神经毒性[26]。说明大剂量EPO疗效可能存在安全有效上限,在高浓度下会失去神经保护作用。因此,EPO的最佳使用剂量及治疗时间窗、有效浓度范围、总疗程等仍需更多的高质量、大样本RCTs以及长期随访的评估数据来进一步明确。
此外,Meta分析结果显示,EPO组神经系统发育不良结局,包括脑瘫、听力损害、视力损害以及其他神经发育障碍的发生率与对照组差异均无统计学意义。分析原因可能在于纳入文献的样本量较少。另外,纳入相关文献中均以小剂量EPO治疗为主,也可能与单次使用剂量较小有关。
3.2 早产儿应用EPO的安全性 早产儿生后早期应用EPO的安全性也是一个重要问题。有研究指出[27-28],成人在使用EPO治疗期间可能会导致深静脉血栓形成、癫痫发作、红细胞增多症、高血压、脑实质或Ⅲ/Ⅳ级IVH,甚至意外死亡等严重并发症。动物模型试验也显示,早期使用大剂量EPO(5 000 U/kg)治疗可能会放大机械通气诱导的肺部炎症和损伤,并增加呼吸系统疾病的发生率和严重程度[29]。此外,EPO促进新生血管的形成过程可能参与了ROP的发病机制。然而,一项纳入了41项RCTs的综述评价显示,3 003例早产儿在接受EPO治疗后并没有出现上述药物不良反应[30]。本Meta分析结果也显示,EPO组与对照组在整个治疗过程中BPD和ROP(≥Ⅲ期)的发生率并无统计学差异,说明EPO发挥神经保护作用的同时具有较好的安全性,并不会增加BPD和严重ROP的发生风险,并且能够降低严重IVH(Ⅲ/Ⅳ)、PVL和NEC的发生率,考虑与EPO的抗炎、抗凋亡、促进新生血管形成并增加脑血流灌注从而减轻脑组织缺血缺氧性损伤等神经系统保护机制有关[31-32]。此外,EPO可在炎症应激状态下通过激活肌醇磷脂-3-激酶/苏氨酸激酶(phosphateidylinositol 3 kinase/serine-threonine kinase,PI3K/Akt)通路维持紧密连接蛋白(zonula occludens-1,ZO-1)的表达从而促进肠内细胞成熟来发挥肠黏膜屏障保护功能,降低NEC的发病率[33]。因此,EPO发挥神经保护作用的同时具有良好的耐受性,可安全用于临床。
本Meta分析还存在一定的局限性,(1)纳入文献质量总体一般,大部分中文文献未报告具体的随机方法、分配隐藏和盲法,存在一定的偏倚风险,影响结果的可信度;(2)纳入研究中EPO的用药剂量及治疗时间窗、总疗程以及神经发育评估时间均未完全一致,可能会给Meta分析结果造成偏倚;(3)需进一步延长随访时间以评估EPO对早产儿神经保护作用的远期疗效。
综上所述,早期应用小剂量EPO对早产儿神经系统有一定的保护作用且安全,大剂量EPO的神经保护作用需进一步探讨。受纳入研究数量和质量的限制,上述结论尚需更多高质量研究予以验证。
