StRab5b基因对马铃薯花青素合成的影响
2022-09-14张之为范俊臣康立茹贾瑞芳田再民
张之为,范俊臣,康立茹,2,贾瑞芳,田再民,赵 君
(1.内蒙古农业大学 园艺与植物保护学院,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院, 内蒙古 呼和浩特 010031;3.河北北方学院 农林科技学院,河北 张家口 075000)
花青素又称花色苷、花青苷或花色素,是一类水溶性类黄酮色素,普遍分布于植物的花瓣、果实、茎和叶等组织中,呈现红、紫、蓝等颜色[1]。花青素的基本结构由2个芳香环和一个含氧杂环组成,根据其结构不同被划分为六大类:天竺葵素(Pelargonidin)、矢车菊素(Cyanidin)、芍药花素(Peonidin)、飞燕草素(Delphinidin)、矮牵牛素(Petunidin)和锦葵素(Malyidin)[2]。对于植物来说,花青素给予了植物多种鲜艳的颜色,吸引昆虫授粉和传播种子,同时能够提高植物抗性,通过清除自由基、抗氧化、防御病原体等方式,帮助植物抵御多种生物与非生物胁迫[3-5]。花青素的合成是类黄酮合成通路中的一个重要分支,其过程涉及多个复杂的酶促反应,这些关键酶包括苯丙氨酸解氨酶(Phenylalanine ammonia lyase,PAL)、肉桂酸羟化酶(Cinnamate 4-hydroxylase,C4H)、查尔酮合成酶(Chalcone synthase,CHS)、查尔酮异构酶(Chalcone isomerase,CHI)、黄烷酮-3-羟化酶(Flavanone 3-hydroxylase,F3H)、二氢黄酮醇-4-还原酶(Dihydroflavonol 4-reductase,DFR)、花青素合成酶(Anthocyanidin synthase,ANS)和类黄酮3-O-葡萄糖基转移酶(Flavonoid 3-O-glucosyltransferase,UFGT)等[6-8]。这些关键酶受到早期生物合成(EBG)和晚期生物合成(LBG)2套结构基因的调控,其中EBGs 包括CHS、CHI和F3H;LBGs 包括F3′H、F3′5′H、DFR、ANS和UFGT[9],这些结构基因的表达受转录因子MYB、bHLH 和WD40 的调控和外界环境因素的影响[10-11]。
Rab蛋白是一类单体GTP结合蛋白,分子质量为20~30 ku,是小G蛋白家族中最大的一个家族,广泛存在于动物、植物和微生物中,目前已经克隆并获得很多Rab蛋白,其中拟南芥有57 个Rabs,水稻有52个Rabs[12],人类有60 个Rabs,酵母有11 个Rabs[13-14]。Rab蛋白是细胞内的“分子开关”,主要通过与GTP 或GDP结合来行使“开”或“关”功能[15],现有研究已证明,Rab蛋白具有参与信号转导[16-17]、细胞极性生长[18]、囊泡运输[19]和骨架组装[20]等功能。由于花青素能够调控植物的生物胁迫和非生物胁迫反应,Rab蛋白作为细胞内的“分子开关”,也参与了植物生物胁迫和非生物胁迫反应,因此Rab蛋白与植物花青素合成之间存在一定联系。
本试验以马铃薯为材料,超表达小G蛋白StRab5b基因后,研究其对马铃薯叶片、茎段和薯块中花青素含量以及花青素合成关键酶PAL活性的影响,旨在为研究小G蛋白StRab5b和马铃薯花青素合成之间的关系提供理论依据。
1 材料和方法
1.1 试验材料
组培苗选用马铃薯品种底西瑞(Desiree),中间载体PLG-ROP和表达载体pBIA1300-221为内蒙古农业大学植物病理实验室保存的质粒载体。花青素含量和PAL活性测定中选用的材料为转基因马铃薯株系StRab5b-L2、StRab5b-L3和StRab5b-L5,对照材料选用转空载体pBIA1300-221的马铃薯植株。
1.2 试验方法
1.2.1StRab5b基因的克隆利用TRIzol Reagent(Invitrogen)试剂盒提取马铃薯叶片组织中总RNA,经过1%琼脂糖凝胶电泳检测RNA的完整性。利用反转录试剂盒HiScript 1st Strand cDNA Synthesis Kit(Vazyme)合成cDNA,以cDNA为模板,用分别带有KpnⅠ和BglⅡ酶切位点的StRab5b基因特异性引物(StRab5b-F 5′-GAAGATCTTCATGGGTTGCGCATCTTCAGC-3′,StRab5b-R 5′-GGGGTACCCCATGATCAAGCAGCAGTCG-3′)进行PCR,获得StRab5b基因片段。经过胶回收试剂盒Easy Pure Quick Gel Extraction Kit(北京全式金生物技术有限公司)纯化后与克隆载体PCR 2.1连接,构建T-StRab5b载体,将T-StRab5b载体转化大肠杆菌后,利用蓝白斑筛选阳性菌落,提取质粒DNA后,用KpnⅠ和BglⅡ进行双酶切鉴定。
1.2.2 表达载体构建 将T-StRab5b和PLG-ROP载体分别用KpnⅠ和BglⅡ进行双酶切,回收T-StRab5b中的小片段,与PLG-ROP载体回收的大片段进行连接,构建中间载体PLG-StRab5b,转化大肠杆菌后,在添加100 mL/L Kan的LB固体培养基上筛选阳性菌落,提取质粒DNA后,用SwaⅠ和SacⅠ进行双酶切鉴定。将PLG-StRab5b载体用SwaⅠ和SacⅠ进行双酶切,pBIA1300-221用SmaⅠ和SacⅠ进行双酶切,回收PLG-StRab5b载体小片段,与pBIA1300-221载体大片段连接,构建表达载体p1300-221-StRab5b,转化大肠杆菌后,在添加100 mL/L Kan的LB固体培养基上筛选阳性菌落,提取质粒DNA后,用Sac Ⅰ和XbaⅠ进行双酶切鉴定。将表达载体p1300-221-StRab5b转入农杆菌LB4404中,在添加100 mL/L Kan,100 mg/L Rif的LB固体培养基上筛选阳性菌落,提取质粒,用StRab5b基因特异性引物(StRab5b-F和StRab5b-R)进行PCR鉴定。
1.2.3 马铃薯遗传转化 采用叶盘法进行马铃薯遗传转化,摘取带叶柄的马铃薯组培苗叶片,沿主脉横切2~3次,置于带有表达载体p1300-221-StRab5b的农杆菌LB4404菌液(OD600=0.5)中,轻摇10 min,用无菌滤纸吸干叶片表面的菌液,移到共培养培养基(MS+1.0 mg/L IAA+0.2 mg/L GA3+2.0 mg/L ZT+0.5 mg/L 6-BA)中黑暗培养2~3 d。然后将叶片转移到芽诱导分化培养基(MS+1.0 mg/L IAA+0.2 mg/L GA3+2.0 mg/L ZT+0.5 mg/L 6-BA+25 mg/L Hyg)中,在培养条件为25 ℃、光照16 h/d、光照强度4 000 μmol/(m2· s)诱导生芽,每隔14 d更换一次培养基。当抗性芽长到2 cm时,转入MS培养基中进行生根培养,待形成完整植株时,切取叶片,利用qPCR进行鉴定。qPCR反应引物信息为q-StRab5b-F 5′-ATAGCCTTGCAGGACTCAAC-3′和q-StRab5b-R 5′-CAGCACCTCGGTAGTATAATGG-3′,内参引物信息为q-Stactin-F:5′-GATGGTGTCAGCCACAC-3′和q-Stactin-R:5′-ATTCCAGCAGCTTCCATTCC-3′。
1.2.4 马铃薯试管薯产生 将马铃薯无菌苗放入MS液体培养基(MS基本成分+0.5 mg/L 6-BA+0.3 mg/L GA3+2% 蔗糖),在温度25 ℃、光照16 h/d、黑暗8 h/d条件下培养30 d。挑选健壮幼苗,加入诱导生薯培养基(MS基本成分+0.5 mg/L 6-BA+8%蔗糖),在温度25 ℃、黑暗条件下诱导生薯。
1.2.5 花青素含量测定 将0.2 g马铃薯组织(叶片、茎段、薯块)剪碎,转入15 mL离心管中,加入5 mL 2%盐酸甲醇(V/V=2∶98)溶液,黑暗条件下,室温浸提至组织完全变白。12 000 r/min离心10 min,将上清液转入10 mL容量瓶中,用2%盐酸甲醇溶液定容至10 mL,重复3次。以2%盐酸甲醇溶液为空白对照,用光径1 cm的比色皿,在波长为530 nm处,用TU-1901紫外可见分光光度计测定吸光度值[21]。以吸光度值为0.1代表花青素含量的1个单位,用花青素相对含量表示。
1.2.6 PAL活性测定 将0.2 g马铃薯组织(叶片、茎段、薯块)放入-20 ℃预冷的研钵中,加入1 mL 0.2 mol/L硼酸盐缓冲液(pH值8.8),其中含有0.5 mmol/L β-巯基乙醇和5%聚乙烯吡咯烷酮PVP,于冰浴中研磨成匀浆,用1 mL 0.2 mol/L硼酸盐缓冲液(pH值8.8)冲洗研钵后,一同转入2 mL离心管中。4 ℃、12 000 r/min离心10 min,上清液即为粗酶液,重复3次。
取0.5 mL粗酶液,加入反应液(1 mL 0.02 mol/L 反应底物L-苯丙氨酸,2.5 mL 蒸馏水)中,30 ℃水浴30 min,加入0.2 mL 6 mol/L盐酸终止反应。以不加底物的对照,在290 nm处,用TU-1901紫外可见分光光度计测定吸光度值[22]。以每分钟在290 nm处吸光度变化0.01为1个酶活性单位,用U表示。
PAL=A290×V/(a×0.01×W×t)
式中,V为提取粗酶液体积;a为测定时所用粗酶液体积;W为样品鲜质量;t为反应时间。
2 结果与分析
2.1 StRab5b基因的克隆
以马铃薯cDNA为模板,利用StRab5b基因特异性引物进行PCR扩增,获得约600 bp的目的基因片段,与预期的片段大小一致(图1)。与克隆载体连接后,用KpnⅠ和BglⅡ进行双酶切鉴定,获得约600 bp的小片段(图2),说明StRab5b基因与克隆载体PCR 2.1连接成功。
M.DNA Marker 2K;1.StRab5b基因。 M.DNA Marker 2K;1.StRab5b gene.
M.DNA Marker 2000;1.T-StRab5b载体。 M.DNA Marker 2000;1.T-StRab5b vector.
2.2 表达载体构建
为了构建与GFP融合的表达载体,先将StRab5b基因序列构建到含有GFP的载体PLG-ROP中,经过SwaⅠ和SacⅠ双酶切鉴定,获得约1 200 bp的GFP-StRab5b融合片段(图3-A)。将GFP-StRab5b融合片段构建表达载体pBIA1300-221中,获得重组质粒p1300-221-StRab5b,经过SacⅠ和XbaⅠ双酶切鉴定,获得约1 200 bp的片段(图 3-B),说明GFP-StRab5b已经连接到表达载体中。将表达载体p1300-221-StRab5b转入农杆菌LB4404中,利用StRab5b基因特异性引物(Rab5b-F和Rab5b-R)进行PCR鉴定,获得了约600 bp的片段,与阳性对照相同(图4),说明表达载体已经转入农杆菌LB4404中。

A.PLG-StRab5b载体SwaⅠ和SacⅠ酶切鉴定:M.DNA Marker 2000 Plus;1.PLG-StRab5b载体。 B.p1300-221-StRab5b载体SacⅠ和XbaⅠ酶切鉴定:M.DNA Marker 15000;1.p1300-221-StRab5b载体。 A.PLG-StRab5b/SmaⅠ-SacⅠ:M.DNA Marker 2000 Plus;1.PLG-StRab5b vector.B.p1300-221-StRab5b/SacⅠ-Xba I: M.DNA Marker 15000;1.p1300-221-StRab5b vector.
2.3 超表达StRab5b基因马铃薯的鉴定
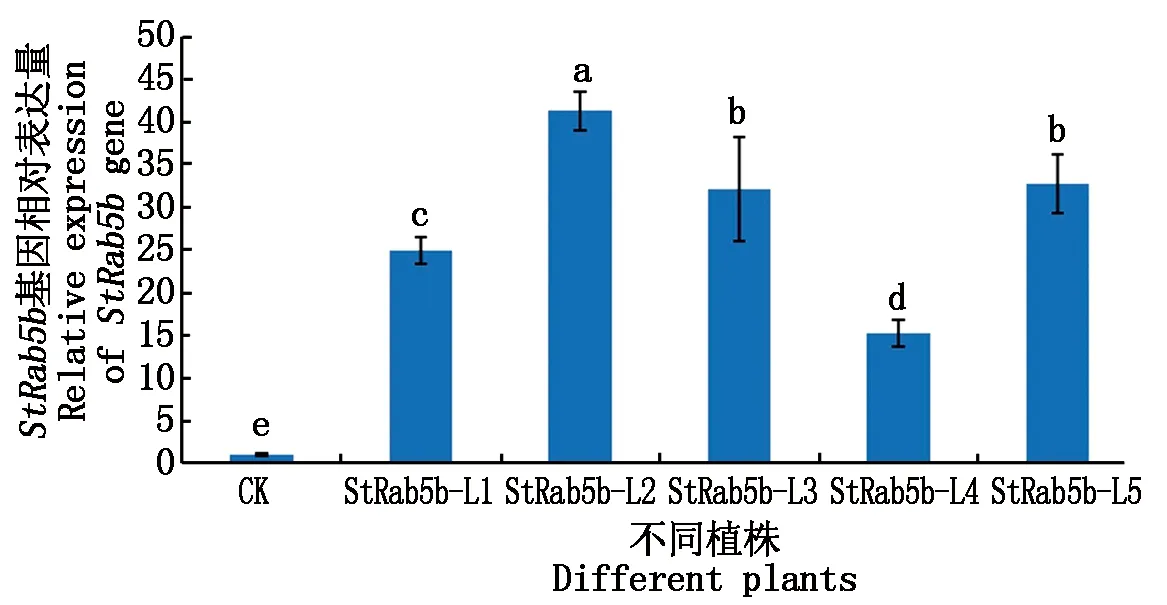
利用qPCR方法对获得的阳性植株进行StRab5b基因相对表达量的分析,结果显示(图5),与对照植株相比较,阳性植株中StRab5b基因的表达量均显著增加,其中在StRab5b-L2、StRab5b-L3和StRab5b-L5植株中,StRab5b基因的表达丰度较高。
2.4 超表达StRab5b基因后马铃薯的表型
选择StRab5b基因表达量较高的转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5,将薯块种植到营养钵中,培养30 d后,观察植株叶片和茎段颜色的变化。转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的叶片和茎段中均出现紫红色,而对照马铃薯叶片和茎段中未出现紫红色(图6)。利用试管生薯的方法,诱导马铃薯产生薯块,在转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的薯块中出现紫红色,但是对照马铃薯薯块中没有产生紫红色(图7)。说明小G蛋白StRab5b基因在马铃薯超表达后,增加了马铃薯叶片、茎段、薯块的颜色积累。
不同小写字母表示差异显著(P<0.05)。图8—9同。 Different letters represent significant differences(P<0.05). The same as Fig.8—9.

图6 超表达StRab5b基因后叶片和茎段的表型Fig.6 The phenotype of leaves and stem segments after overexpression of StRab5b gene
2.5 超表达StRab5b基因对马铃薯花青素含量的影响
分别测定马铃薯叶片、茎段和薯块中的花青素含量,结果显示,马铃薯不同组织中花青素含量大小依次为叶片>茎段>薯块,与对照相比,超表达StRab5b基因后,马铃薯叶片、茎段和薯块中的花青素含量均显著增加。叶片中,转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的花青素含量分别比对照增加了42%,24%,54%,转基因马铃薯叶片中花青素含量与对照形成显著差异(P<0.05),表现为植株StRab5b-L5>StRab5b-L2>StRab5b-L3;茎段中,转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的花青素含量分别比对照增加了59%,37%,32%,转基因马铃薯茎段中花青素含量与对照形成显著差异,表现为植株StRab5b-L2>StRab5b-L3>StRab5b-L5;薯块中,转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的花青素含量分别比对照增加了118%,82%,105%,转基因马铃薯薯块中花青素含量没有显著差异,表现为StRab5b-L2>StRab5b-L5>StRab5b-L3(图8)。说明小G蛋白StRab5b基因超表达能够增加马铃薯叶片、茎段和薯块中的花青素含量。

图8 超表达StRab5b基因后马铃薯中花青素相对含量Fig.8 The anthocyanin relative content in potato after overexpression of StRab5b gene
2.6 超表达StRab5b基因对马铃薯PAL活性的影响
由图9可知,与对照相比,超表达StRab5b基因后,马铃薯叶片、茎段和薯块中PAL活性均显著增加(P<0.05)。叶片中,转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的PAL活性分别比对照增加了88%,63%,66%;茎段中,转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的PAL活性分别比对照增加了48%,38%,31%;薯块中,转基因马铃薯植株StRab5b-L2、StRab5b-L3和StRab5b-L5的PAL活性分别比对照增加了98%,78%,64%,而转基因马铃薯叶片、茎段和薯块中的PAL活性没有差异。说明小G蛋白StRab5b基因超表达能够增加马铃薯叶片、茎段和薯块中PAL的活性。

图9 超表达StRab5b基因后马铃薯中PAL活性Fig.9 The PAL activity in potato after overexpression of StRab5b gene
3 结论与讨论
植物中花青素的生物合成可以划分为3个阶段,即苯丙烷途径阶段、类黄酮代谢阶段和花青素催化合成阶段,这些过程涉及多种关键酶和转录因子的参与[6,10]。在苯丙烷途径中,花青素生物合成的直接前体是苯丙氨酸,PAL能够将苯丙氨酸转化为肉桂酸,肉桂酸在4CL和C4H的作用下形成香豆酸辅酶A,再通过进一步代谢形成花青素,其中PAL是苯丙烷代谢途径的重要调控位点,是花青素合成的限速酶[23]。已有研究发现,植物中花青素的合成与PAL呈现一定的相关关系,植物大量合成花青素的时候,检测到PAL的活性增加,同时PAL基因的表达量呈现上调的趋势[24-26]。本研究中,马铃薯中超表达StRab5b基因后,与对照相比,植株叶片、茎段和薯块中的花青素含量显著增加,同时叶片、茎段和薯块中PAL活性也增加,说明StRab5b基因能够参与马铃薯叶片、茎段和薯块的花青素的合成,调控花青素合成的方式主要是通过调节PAL的活性,由于增加了苯丙氨酸转化为肉桂酸量,进而增加了合成花青素的底物,因此,在马铃薯叶片、茎段和薯块中花青素的合成量增加。
马铃薯不同组织中,超表达StRab5b基因后的花青素含量和PAL活性存在差异,表现为叶片>茎段>薯块,揭示StRab5b基因在不同组织中的表达水平存在差异。由于在叶片中StRab5b基因表达量较多,对PAL活性产生较大作用,通过PAL调节合成较多的花青素,而茎段和薯块中StRab5b基因表达量较少,对PAL活性影响作用较小,因此,在茎段和薯块中合成了相对较少的花青素。
