罗汉果皂苷Ⅴ通过PI3K/Akt通路抑制过氧化氢诱导的MIN6细胞氧化损伤
2022-09-13韩梦洁刘国翔周璐炜
韩梦洁,王 娟,刘国翔,李 婷,周璐炜,陈 旭
(桂林医学院药学院,广西 桂林 541100)
罗汉果广泛分布于广西桂林永福县、临桂县[1],作为一种常用的药食两用的植物,罗汉果具有降血糖、抗炎抑菌、抗氧化等作用[2]。罗汉果主要含有由三萜皂苷类、黄酮类、多糖类等物质[3],其中罗汉果皂苷V(mogroside V,MV)是其主要的活性成分[4],MV是一种三萜类化合物,具有抗氧化、抗肿瘤、止咳润肺、降血糖等作用[5]。糖尿病是一种以血糖水平升高为表现的慢性疾病,与内分泌代谢紊乱有关。糖尿病已经成为发生率仅次于心血管疾病和肿瘤的疾病,预计到2040年,会有超过6亿人遭受糖尿病的侵害[6]。寻找天然的降糖药物,加强对糖尿病的防治,减轻其并发症一直是研究者关注的焦点。胰岛β细胞是一种内分泌细胞,能贮存和分泌胰岛素从而维持体内血糖的稳态[7]。在氧化应激条件下,活性氧(reactive oxygen species,ROS)会对胰岛β细胞造成损伤,引起凋亡,从而导致功能障碍,最终引发高血糖。研究表明MV具有抗氧化活性,对氧化应激环境有拮抗作用,从而降低糖尿病并发症的发生率[2]。但是,其是否能降低胰岛β细胞内ROS水平,从而发挥保护胰岛细胞的作用仍不清楚。PI3K/Akt是细胞生长、存活、增殖等的重要信号通路[8],与藤茶总黄酮抑制肝癌的作用有关[9],且其参与了ROS的氧化应激。本研究通过采用过氧化氢(hydrogen peroxide,H2O2)构建小鼠胰岛β细胞株MIN6细胞氧化损伤模型,探讨MV对MIN6细胞氧化损伤的保护作用及其机制是否与PI3K/Akt信号通路有关。
1 材料与方法
1.1 材料
1.1.1细胞 小鼠胰岛β细胞株MIN6细胞为桂林医学院生药学重点实验室传代保存。
1.1.2药物 含量为95.78%的MV(批号:PS000637)购自成都普思生物科技股份有限公司。
1.1.3主要试剂 DMEM高糖培养基购自美国Gibco公司;胎牛血清购自美国CLACK公司;噻唑蓝(MTT)购自北京索莱宝公司;Annexin V-FITC凋亡试剂盒购自美国BD公司;RIPA强裂解液购自上海Beyotime公司;BCA蛋白定量测定试剂盒购自上海Beyotime;β-actin单克隆抗体购自北京中杉金桥生物技术有限公司;Bcl-2、PCNA、Akt等单克隆抗体购自美国Abcam公司;p-Akt单克隆抗体购自沈阳万类生物科技有限公司;MK2206购自于美国MedChemExpress公司;鼠二抗及兔二抗均购自上海Abmart公司;Western一抗稀释液购自上海雅酶生物科技有限公司;硝酸纤维素膜购自美国Pall公司;H2O2购自西陇化工厂;ECL超敏化学发光试剂购自合肥Biosharp公司。
1.1.4仪器 流式细胞仪购自美国BD公司(BD C6 plus);Galaxy 170S型二氧化碳培养箱购自德国Eppendorf公司;A2-4S1级2型生物安全柜购自新加坡ESCO公司;Infinite M200Pro型酶标仪购自瑞士TECAN公司;蛋白电泳系统购自美国Bio-Rad公司;蛋白转印系统购自美国Bio-Rad公司;电泳仪电源购自美国Bio-Rad公司;高速冷冻离心机购自美国Thermo公司;TDZ4-WS型台式低速离心机购自湘仪离心机仪器有限公司;ECL化学发光仪购自美国Bio-Rad公司。
1.2 方法
1.2.1药物的配制 (1)MV为白色粉末,用PBS配制成浓度为100 g·L-1的母液,根据实验所需用DMEM培养基稀释至所需浓度。(2)将30%H2O2(10 mol·L-1)加PBS配置成60 mmol·L-1的母液,现用现配,根据实验要求用培养基稀释成所需浓度。
1.2.2细胞培养 将MIN6细胞复苏后,5 mL培养基混匀后,放入7 cm培养皿中,摇匀,放置于37 ℃,5% CO2的培养箱中培养至细胞密度为80%~90%时,进行传代。
1.2.3MTT试验检测细胞活力 将处于对数生长期的MIN6细胞,胰酶消化后,加入适当的培养基制成细胞悬液,利用细胞计数仪计量细胞悬液中的细胞密度。调整细胞密度为4×103个/孔接种于96孔板中,置于37 ℃,5% CO2培养箱中培养。过夜贴壁后,设置空白对照组(Control,Ctrl)、H2O2组(500 μmol·L-1)、MV组(100 mg·L-1)以及MV保护组(MV预处理1 h后加入H2O2),空白对照组加入等体积培养基,每组浓度设6个复孔。药物处理后,置于37 ℃,5% CO2培养箱中分别培养24 h后,每孔加入20 μL MTT。继续培养4 h后,弃上清,每孔加入150 μL DMSO溶液,用枪吹打使结晶溶解,混匀。在490 nm波长处测吸光度(OD)。
1.2.4流式细胞凋亡检测 取对数生长期MIN6细胞种于7 cm培养皿中,贴壁后,按照“1.2.3”中分组方式加入相应浓度的药物。作用24 h后,用不含EDTA的0.25%胰酶消化收集细胞,离心后加入1 mL PBS洗涤细胞后再次离心。弃上清,加入200 μL Binding buffer,5 μL FITC和5 μL PI,室温避光孵育30 min。加入200 μL Binding buffer,300目筛网过滤后,BD C6 Plus 流式细胞仪检测细胞凋亡。
1.2.52′,7′-二氯荧光黄双乙酸盐(DCFH-DA)检测ROS 取对数生长期的MIN6细胞,0.25%胰酶消化后,种于6孔板中。贴壁后,加入药物处理24 h。药物处理完毕,弃去培养基,用PBS洗涤,用0.25%胰酶消化后加入600 μL培养基终止消化,1 000 r·min-1离心5 min,用PBS洗涤。加入500 μL ROS探针DCFH-DA(2 μmol·L-1)后,37 ℃孵育20 min。孵育结束后,用PBS洗涤3次,加入300 μL PBS悬浮细胞,300目筛网过滤后,流式细胞仪检测荧光强度。
1.2.6Bcl-2、PCNA蛋白水平检测 取对数生长期MIN6细胞种于10 cm培养皿中,贴壁后,加入相应浓度药物处理。处理结束后,将细胞收集于1.5 mL EP管中,根据细胞沉淀量加入适量的RIPA强裂解液,用1 mL的移液器将细胞沉淀吹散,放置于冰上30 min,使得细胞沉淀得以充分裂解。12 000 r·min-1离心30 min,将上清移至预冷的1.5 mL EP管中。BCA定量试剂盒测定蛋白浓度。根据蛋白浓度以及所需体积,并加入5×SDS、ddH2O使上样体积为20 μL。根据蛋白分子量配制相应浓度的分离胶,SDS-PAGE电泳分离120 min,转膜60 min,5%脱脂牛奶室温封闭2 h,洗膜后分别加入相应的一抗(1 ∶1 000)4 ℃孵育过夜。PBST洗膜3次,室温孵育对应的二抗,再洗膜4次。ECL发光及进行灰度值计算分析。

2 结果
2.1 MV抑制了H2O2诱导的MIN6细胞的损伤作用我们使用25~1 600 mg·L-1的MV处理MIN6细胞,发现100 mg·L-1以内的MV处理MIN6细胞与对照组之间的细胞活力值无差异(P>0.05),结果表明100 mg·L-1以下的MV对MIN6细胞几乎无毒性(Fig 1A)。在光学显微镜下观察细胞形态发现,对照组细胞生长状况良好,细胞膜边缘清晰可见,H2O2单独处理的细胞数减少,细胞皱缩变圆、变亮,细胞损伤严重。结果提示,H2O2抑制了MIN6细胞增殖并极可能诱导了细胞死亡。MV预处理组与H2O2单独处理组相比,MV预处理组细胞密度有所增加,细胞碎片减少(Fig 1B和C),说明MV对H2O2诱导的MIN6细胞损伤具有一定的保护作用。

Fig 1 The protective effect of mogroside Ⅴ
2.2 MV对H2O2诱导MIN6细胞凋亡的影响流式结果表明,H2O2作用于MIN6细胞后,细胞凋亡率达到了21.2%。MV预处理后,能减少H2O2诱导的细胞凋亡至15%,差异具有统计学意义(P<0.05)。因此,MV可以部分抵抗H2O2的氧化应激,从而保护MIN6细胞,减轻其氧化损伤,减少MIN6细胞的凋亡(Fig 2)。
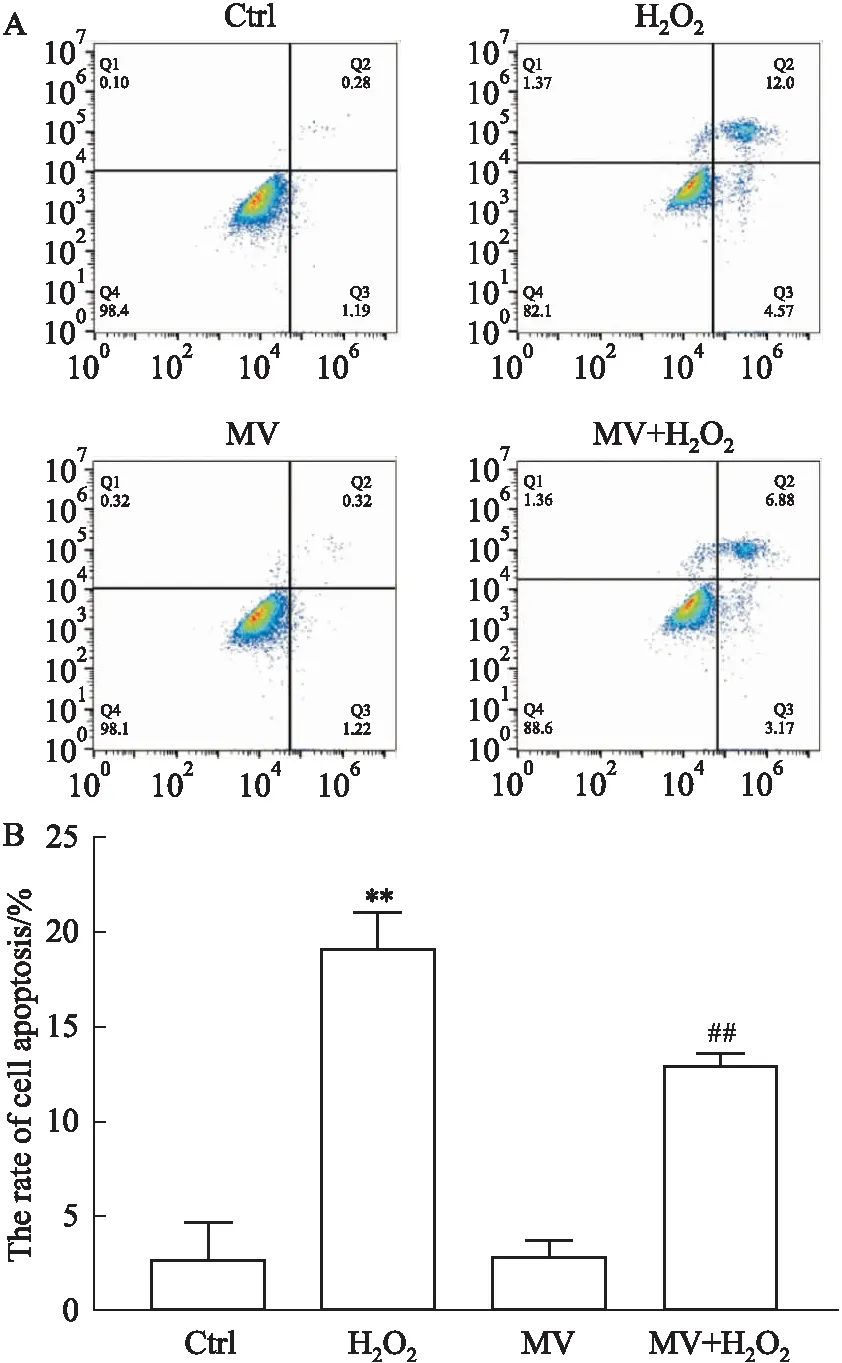
Fig 2 Effect of mogroside Ⅴ on apoptosis of MIN6
2.3 MV对MIN6细胞ROS释放的影响流式结果显示,H2O2作用于MIN6细胞后,ROS的释放增加,因此导致了MIN6细胞的死亡。MV预处理MIN6细胞后,能显著减少H2O2诱导的ROS(P<0.05)(Fig 3),这可能与其具有抗氧化的药理活性有关。MIN6细胞ROS水平下调,细胞氧化损伤降低,细胞凋亡减少。
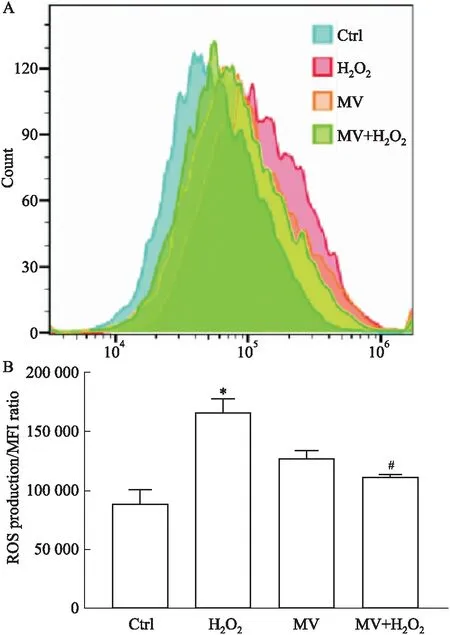
Fig 3 Effect of mogroside Ⅴ on reactive oxygenspecies (ROS) in MIN6
2.4 MV对MIN6细胞Bcl-2、PCNA、Akt和p-Akt蛋白表达的影响我们进一步通过Western blot分析增殖以及凋亡相关因子Bcl-2、PCNA和Akt的表达。结果显示,H2O2使MIN6细胞中PCNA、Bcl-2以及p-Akt蛋白的表达降低,这可能是H2O2处理后导致细胞减少,细胞凋亡的原因。MV预处理后,能减轻H2O2对MIN6细胞内PCNA以及Bcl-2表达的抑制及Akt的活性下降,进而提高了MIN6细胞活性及抑制其凋亡(Fig 4)。
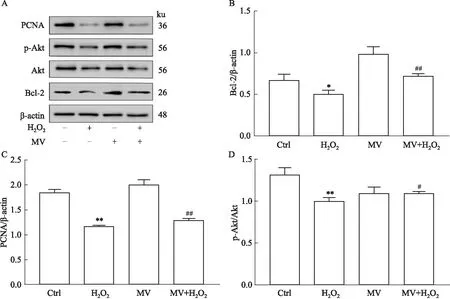
Fig 4 Effect of mogroside Ⅴ on protein volume expression of MIN6
2.5 MV减轻Akt抑制剂对MIN6细胞的氧化损伤为进一步验证Akt在MV对MIN6细胞中的作用,我们使用Akt抑制剂MK2206处理MIN6细胞,发现MK2206能引起MIN6细胞凋亡,而且MV也可以部分逆转其对MIN6细胞的损伤(Fig 5A)(P<0.05)。同时发现,MK2206也可以使细胞内ROS水平增加(Fig 5B)(P<0.01),这与H2O2导致MIN6细胞发生氧化损伤的结果一致。此外,蛋白水平分析显示,MV也可以上调MK2206导致的PCNA以及Bcl-2表达降低以及Akt的活化(Fig 5C)(P<0.05)。
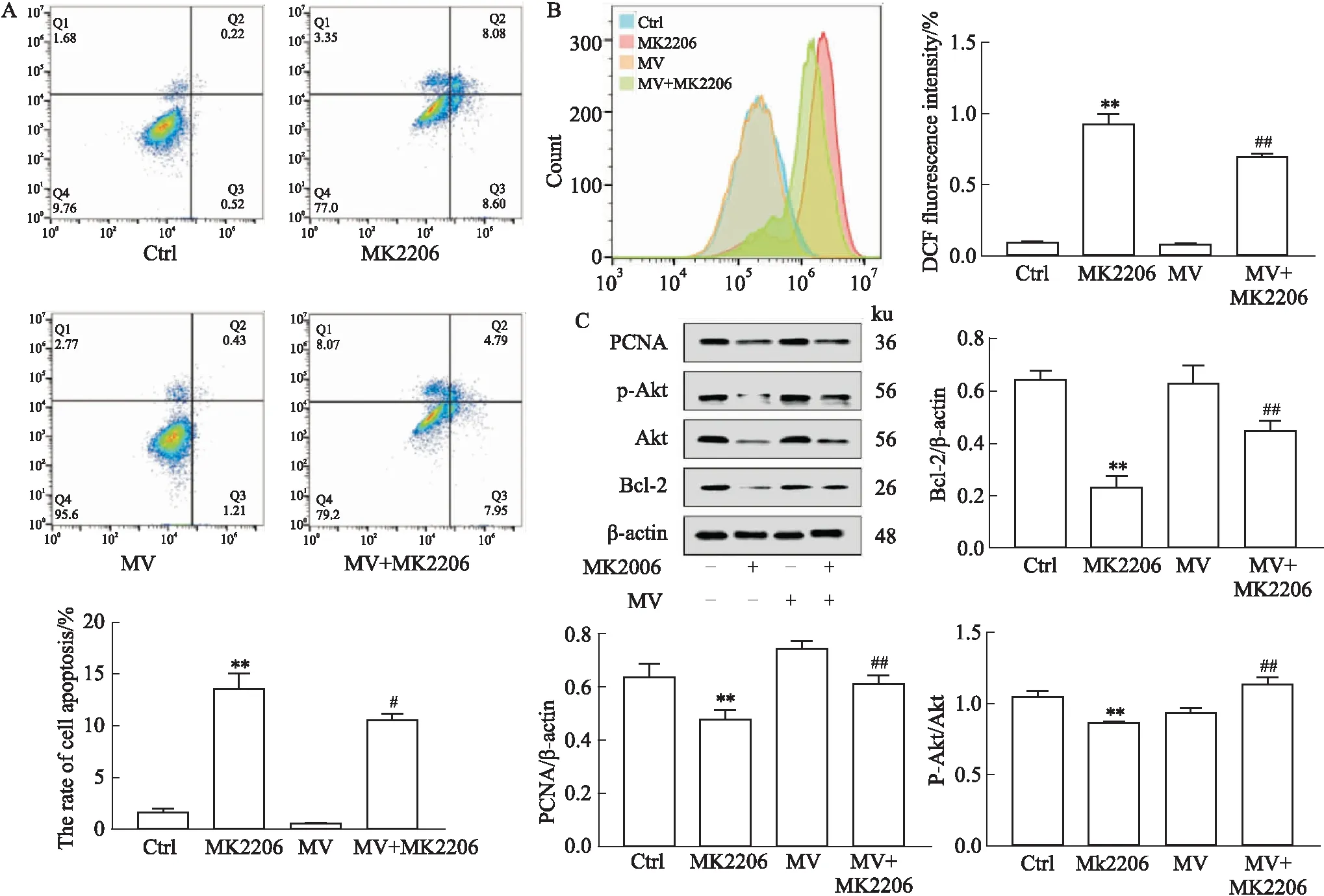
Fig 5 The oxidative damage on MIN6 cells caused by Akt inhibitor alleviated by mogroside
3 讨论
糖尿病是全球最主要的代谢性疾病之一[9]。胰岛β细胞能够分泌和贮存胰岛素,其增殖的减少以及受损抑制了胰岛素的分泌。本研究结果显示,MV能够增加H2O2诱导的MIN6细胞的增殖。PCNA与细胞增殖密切相关,其表达水平的高低可反映MIN6细胞的增殖活性。Western blot结果显示,MV逆转了H2O2诱导的PCNA表达减少。因此,推测MV通过增加PCNA的表达来促进H2O2诱导的MIN6细胞增殖。
氧化应激是糖尿病的病理基础之一,其能够损伤胰岛β细胞以及导致胰岛素抵抗。胰岛β细胞中的抗氧化酶水平较低,对高糖、高脂、炎症因子等刺激因子非常敏感,导致其容易受到ROS介导的氧化应激损伤[10]。本研究表明,MV能够减少H2O2诱导的ROS释放。这提示MV可能通过抑制氧化应激减少MIN6细胞氧化损伤。细胞内产生氧化应激,ROS增加的同时,常常伴随着细胞凋亡的发生。胰岛β细胞的凋亡也是糖尿病发生的一个重要因素。过量ROS的产生会激活线粒体凋亡通路,从而诱导细胞发生凋亡。当凋亡刺激作用于线粒体时,会导致促凋亡和抗凋亡因子表达的失衡,从而诱导细胞凋亡。Bcl-2是重要的抗凋亡因子,细胞凋亡的发生常常伴随着其表达的减少。我们研究发现,MV能够上调H2O2诱导的Bcl-2表达减少。因此,我们推测MV减少H2O2诱导的凋亡机制可能与增加Bcl-2的表达有关。
PI3K/Akt信号通路是细胞的重要调节通路,与增殖凋亡密切相关。我们发现MV干预后,能够保护H2O2诱导的PI3K/Akt失活。有研究表明,磷酸化的Akt蛋白可以使Bcl-2从聚合体中释放出来,从而发挥抗凋亡作用。为了确定Akt的活化确实参与了MV对MIN6细胞的保护作用,我们使用了Akt的抑制剂MK2206。我们发现Akt抑制剂MK2206可以升高MIN6细胞内的ROS水平以及造成细胞凋亡,而MV也可以减轻其对MIN6细胞的氧化损伤。因此,MV上调氧化损伤MIN6细胞内Bcl-2的表达可能与激活上游Akt信号通路有关。
综上所述,MV通过促进胰岛β细胞的增殖,抑制凋亡的发生以及减少ROS的水平保护了H2O2诱导的MIN6细胞损伤,其机制可能与促进PI3K/Akt的活化增加Bcl-2的表达有关。
