易错PCR 技术提高嗜热酸性III 型普鲁兰水解酶TK-PUL 催化活性的研究
2022-09-13郭建军袁林
曾 静,郭建军,袁林
(江西省科学院微生物研究所,江西南昌 330096)
优化工业淀粉制糖工艺的相关研究对于我国淀粉制糖工业的发展具有重要的技术和经济意义。现行工业淀粉制糖工艺包括液化和糖化两个步骤。液化步骤和糖化步骤的反应温度、pH 均不同,并且淀粉制糖工艺中使用了多种淀粉水解酶(例如-淀粉酶、-淀粉酶、普鲁兰酶以及葡萄糖淀粉酶等),这些因素导致淀粉制糖工业的生产成本增加、生产效率降低。因此,如果能够获得一种在高温液化条件下对淀粉原料同时进行液化和糖化作用的酶,则可有效降低生产成本,提高生产效率。
III 型普鲁兰多糖水解酶(EC 3.2.1.1/41)属于糖苷水解酶类的第13 家族(GH13_20),是一种双功能淀粉水解酶,同时具有-淀粉酶活性和普鲁兰酶活性。嗜热酸性III 型普鲁兰多糖水解酶可在淀粉制糖工业的液化条件下完全水解淀粉为淀粉糖,有望实现“液化糖化一步法”淀粉酶法制糖工艺。嗜热酸性III 型普鲁兰多糖水解酶TK-PUL 来源于极端嗜热古生菌KOD1,具有优良的热稳定性和高温活性,并且其热稳定性和高温活性均不依赖于Ca,即TK-PUL 的酶学性质完全符合淀粉酶法制糖工业的需求。因此TK-PUL在淀粉酶法制糖工业中具有巨大的应用潜力。但是TK-PUL 的催化效率尚不能满足淀粉酶法制糖工业的需求,难以在淀粉酶法制糖工业中高效地发挥水解作用,这限制了TK-PUL 在淀粉酶法制糖工业中的应用。通过蛋白质工程对TK-PUL 进行提高催化活性的分子改造可以为其在淀粉酶法制糖工业中的应用奠定基础,对淀粉制糖工业的升级改造具有重要意义。此外,突变体催化效率强化的分子机制研究也可为其他淀粉水解酶以应用为导向的分子改造提供理论依据和设计思路。
易错聚合酶链式反应(polymerase chain reaction,PCR)就是目前采用最多的一种蛋白质体外定向进化技术,在酶分子的催化特性改善方面发挥重要作用。易错PCR 技术已经应用于提升淀粉水解酶、脂肪酶、漆酶、-葡聚糖酶、糖基海藻糖合酶、纤维素酶等酶活力,并对研究影响酶催化性质的关键氨基酸残基起到了重要指导作用。本研究拟运用易错PCR 技术对TK-PUL 进行体外定向进化研究,以期获得酶活力提高的突变体。进一步通过比较突变体与TK-PUL 的酶学特性和蛋白质分子结构,揭示突变体酶活力提高的可能分子机制。本研究有助于理解TK-PUL 的双功能催化机制,也可为其他淀粉水解酶以应用为导向的分子改造提供理论依据和设计思路。
1 材料与方法
1.1 材料与仪器
TK-PUL 表达载体pBE-S-大肠杆菌JM109 均由本实验室保存;DNA Marker、蛋白质Marker、质粒DNA 小量纯化试剂盒、Secretory Protein Expression System、DNA Ligation Kit Ver.2.1、限制性内切酶 日本TaKaRa 公司;StarMut 随机突变试剂盒 北京康润诚业生物科技有限公司;Ni-NTA 亲和层析柱 德国QIAGEN 公司;普鲁兰糖、可溶性淀粉、麦芽糖、麦芽三糖、麦芽四糖、潘糖、异潘糖 上海惠诚生物科技有限公司;Bradford 法蛋白质定量检测试剂盒上海碧云天生物技术有限公司;LB 肉汤培养基 生工生物工程(上海)股份有限公司;其他试剂 均为国产分析纯。
S1000 PCR 仪(Mastercycler gradient)美国Bio-Rad 公司;全自动数码凝胶图像分析系统(Tanon-4100)上海天能科技有限公司;紫外可见分光光度计(760CRT)上海仪电分析仪器有限公司;CMax Plus 酶标仪 日本Hitachi 公司。
1.2 实验方法
1.2.1 易错PCR 扩增 根据StarMut 随机突变试剂盒说明书和TK-PUL 的基因序列,设计易错PCR 引物。在引物的末端分别引入限制性内切酶I 和I 的酶切位点(如下划线所示):上游引物F 为5'-CGCATATGAGCGGATGTATCTCGGAGAGC-3';下游引物R 为5'-TGTCTAGAACCCCGCTCAAGG ATGATTATC-3'。易错PCR 反应的模板为pBE-S。PCR 反应体系为50 μL:模板DNA 1 μL、2×StarMut Random system 25 μL、上游引物F 1 μL、下游引物F 1 μL、StarMut Enhancer 0~20 μL、ddHO补足至50 μL。PCR 扩增条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,25 个循环;72 ℃ 7 min。通过调整PCR 反应体系中StarMut Enhancer 的添加量改变碱基突变率。
1.2.2 突变文库的构建 采用DNA 胶回收试剂盒对易错PCR 产物进行切胶回收。将重组载体pBES-和纯化后的易错PCR 产物分别用限制性内切酶I 和I 双酶切后进行连接,其中酶切反应和连接反应均参照产品说明书进行。将连接产物电击转入大肠杆菌JM109 感受态细胞,转化产物于37 ℃孵育1 h 后涂布于含100 μg/mL 氨苄青霉素的LB 平板,37 ℃培养16 h,提取所有转化子中的重组质粒。采用改进的Spizizen 法将所获得的重组质粒转化RIK1285 感受态细胞,根据Secretory Protein Expression System 说明书,将转化产物涂布于含10 μg/mL 卡那霉素的LB 平板上,于37 ℃培养24 h,即获得突变文库。
1.2.3 突变文库的高通量培养和高通量筛选 突变文库的高通量培养和高通量筛选参照文献[13]方法进行。突变体文库经高通量培养后,各突变体的发酵液上清用于-淀粉酶活性的高通量检测。-淀粉酶活性的高通量检测对应的吸光值的大小反应突变体的酶活大小,筛选出吸光值最大的突变体用做第2 轮易错PCR 的模板或进行基因测序分析。
1.2.4 重组酶的诱导表达和纯化 重组酶的诱导表达与纯化参照文献[13]进行。采用聚丙烯酰胺凝胶电泳(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)检测重组酶的纯度,并采用Bradford 法蛋白质定量检测试剂盒测定重组酶的浓度。
1.2.5 重组酶的酶活力测定 分别以1%(m/V)可溶性淀粉或普鲁兰多糖为底物,参照文献[13]测定重组酶的-淀粉酶活性和普鲁兰酶活性。酶活力单位(U)定义:在一定反应条件下,每分钟催化产生1 μmol 还原糖的酶量为一个酶活力单位(U)。
1.2.6 重组酶的酶学性质测定 分别以1%可溶性淀粉或普鲁兰多糖为底物,测定重组酶的最适反应pH、pH 稳定性、最适反应温度及热稳定性。重组酶的酶学性质测定参照文献[26]进行。重组酶的最适反应pH 以及pH 稳定性的测定范围为pH3.0~9.0;于40~110 ℃下测定重组酶的最适反应温度,并于100 ℃下测定重组酶的热稳定性。测定重组酶的最适反应pH 或最适反应温度时,将所测得的最高酶活定义为100%,其余测得酶活与最高酶活的比值定义为相对酶活。测定重组酶的pH 稳定性或热稳定性时,将未处理酶液的酶活定义为100%,处理后酶液的酶活与未处理酶液的酶活的比值定义为剩余酶活。
1.2.7 重组酶的动力学常数测定 分别以可溶性淀粉或普鲁兰多糖为底物,测定重组酶的动力学常数。重组酶的动力学常数测定参照文献[26]进行。可溶性淀粉的浓度梯度设定为5.0、10.0、15.0、20.0、30.0、35.0 mg/mL;普鲁兰多糖的浓度梯度设定为1.6、3.2、6.4、12.8、16.0、20.0 mg/mL。
1.2.8 生物信息学分析 将筛选获得的突变体送至生工生物工程(上海)股份有限公司进行基因测序,并根据基因的碱基序列生成氨基酸序列,分析碱基及氨基酸的突变情况。以TK-PUL(PDB ID:5OT1)的蛋白质分子结构为模板,采用SWISS-MODEL(http://swissmodel.expasy.org)同源模建突变体的蛋白质分子结构,并采用三维图像软件PyMOL v2.5.2 显示TK-PUL 及突变体的三级结构。
1.3 数据处理
所有试验均重复3 次,试验结果用平均值±标准差表示,运用软件SigmaPlot 14.0 对试验数据进行统计分析并作图。
2 结果与分析
2.1 易错PCR 条件的确立
根据StarMut 随机突变试剂盒说明书,调整PCR反应体系中StarMut Enhancer 的添加量可以改变碱基突变率。因此我们根据实验要求,在PCR 反应体系中加入不同体积的StarMut Enhancer,进行易错PCR 反应,构建突变体文库。从每组突变体文库中随机挑取10 株菌进行基因测序以计算突变率,如表1 所示,其中StarMut Enhancer 的添加量为1 μL时的平均突变率为0.26%,接近目前公认的合适突变率0.25%,因此本研究易错PCR 反应体系中Star-Mut Enhancer 的添加量为1 μL。
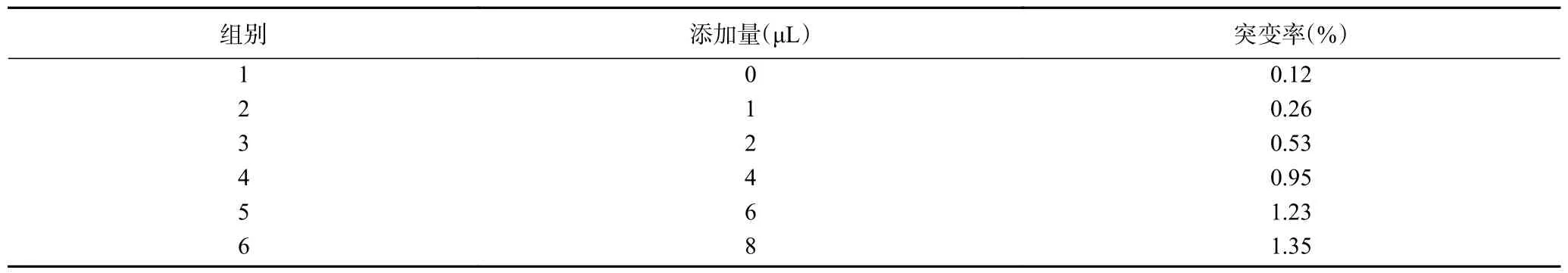
表1 PCR 反应体系中StarMut Enhancer 添加量对应的PCR 突变率Table 1 PCR mutation rates corresponding to the supplemental level of StarMut Enhancer in the PCR reaction system
2.2 突变体文库的构建与高通量筛选
以重组质粒pBE-S-为模板进行第1 轮易错PCR,回收PCR 产物,将其双酶切处理后连接经同样双酶切处理的载体,将连接产物转化大肠杆菌JM109 感受态细胞,提取所有转化子所含重组质粒。将所获得的重组质粒转化RIK1285感受态细胞,获得容量约为2500 株转化子的突变体文库。利用高通量筛选方法筛选突变体文库中酶活力提高的转化子,共获得10 株胞外-淀粉酶活力提高的转化子(数据未显示)。再次采用高通量筛选方法对以上10 株转化子(定义为转化子1~转化子10)以及包含重组质粒pBE-S-的转化子(定义为转化子C)进行胞外-淀粉酶活力的测定,结果如表2所示,筛选得到2 株胞外-淀粉酶活力提高幅度最大的转化子(转化子2 和转化子7)。提取这2 株转化子中重组质粒,并以这两种重组质粒为模板进行第2 轮易错PCR,按照同样的方法获得容量约为2800 株转化子的突变体文库。然而对新的突变体文库进行高通量筛选未能获得酶活力进一步提高的突变体。对经第1 轮易错PCR 反应获得的2 个重组质粒进行测序,测序结果显示这2 个重组质粒包含的突变位点一致,其第1612 位碱基由C 突变为G、第1613 位碱基由T 突变为A,即基因编码序列CTC突变为GAC,氨基酸序列由Leu538 突变为Asp538。即本研究通过易错PCR 技术对TK-PUL 进行体外定向进化,获得了酶活力提高的突变体L538D。
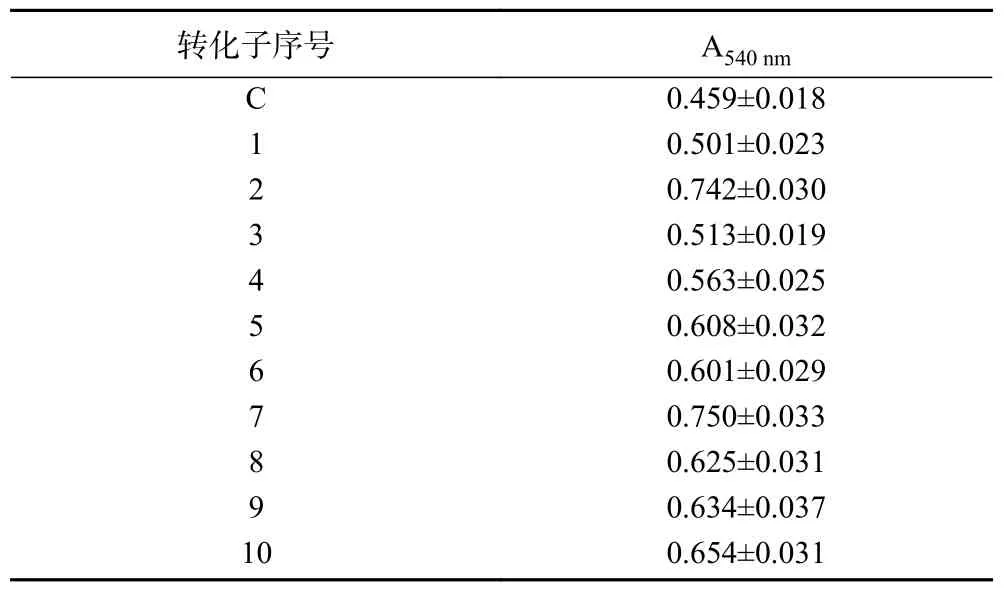
表2 转化子的高通量筛选结果Table 2 High throughput screening results of the transformants
2.3 TK-PUL 和突变体L538D 的表达、纯化及比酶活测定
枯草芽孢杆菌作为传统的工业生产菌株,具有分泌能力强、培养条件和基因操作简单、发酵工艺成熟等优点,被认为是理想的外源蛋白质的分泌表达宿主菌。本研究于枯草芽孢杆菌表达系统中表达TKPUL 和突变体L538D,重组酶TK-PUL 和突变体L538D 均得到成功表达。采用Ni亲和层析法对重组酶进行纯化,并采用SDS-PAGE 检测各重组酶的纯度。如图1 所示,TK-PUL 和突变体L538D 的表观分子质量分别约为84 kDa,大小均与理论值相符。根据SDS-PAGE 检测图中蛋白质条带的灰度分析结果,重组酶TK-PUL 和突变体L538D 的纯度均达到95%以上。

图1 TK-PUL 和突变体L538D 的SDS-PAGE 检测图Fig.1 SDS-PAGE analysis of TK-PUL and the mutant L538D
采用Bradford 法测定TK-PUL 和突变体L538D的蛋白质浓度,并测定其分别以可溶性淀粉和普鲁兰多糖为底物的比酶活力,结果如表3 所示。TKPUL 的-淀粉酶比酶活力为54.08 U/mg,L538D 的-淀粉酶比酶活力为81.14 U/mg。与TK-PUL 相比,L538D 的-淀粉酶比酶活力提高了50%。TKPUL 的普鲁兰酶比酶活力为110.39 U/mg,L538D 的普鲁兰酶比酶活力为133.18 U/mg。与TK-PUL 相比,L538D 的普鲁兰酶比酶活力提高了21%。TKPUL 的-淀粉酶活性与普鲁兰酶活性的比值为0.49,L538D 的-淀粉酶活性与普鲁兰酶活性的比值为0.61。以上结果表明,与TK-PUL 相比,突变体L538D 的-淀粉酶活性和普鲁兰酶活性均明显提高,并且其-淀粉酶活性的提高幅度更大。

表3 TK-PUL 及突变体L538D 于100 ℃的比酶活力Table 3 Specific activities of TK-PUL and the mutant L538D at 100 oC
2.4 TK-PUL 和突变体L538D 的酶学性质
本研究测定了pH 和温度对TK-PUL 及突变体L538D 酶学性质的影响。由图2(A)可知。以1%可溶性淀粉或普鲁兰多糖为底物时,TK-PUL 及突变体L538D 的最适反应pH 均约为4.5,并且两者的相对酶活随pH 的变化趋势也基本相同。另外,图2(B)显示,在pH 为3.0~9.0 的范围内,TK-PUL 及突变体L538D 的pH 稳定性也几乎一致。这表明TK-PUL中L538D 位点变化不影响其最适反应pH 和pH 稳定性。
TK-PUL 及突变体L538D 的最适反应温度测定结果如图2(C)所示。TK-PUL 及突变体L538D 的最适反应温度均约为100 ℃,在40~110 ℃的范围内两者的相对酶活随温度的变化趋势也基本相同。同时,由图2(D)可知,TK-PUL 及突变体L538D 于100 ℃的热稳定性也基本一致,于100 ℃的半衰期均约为2 h。即TK-PUL 中L538D 位点变化也不影响其最适反应温度和热稳定性。
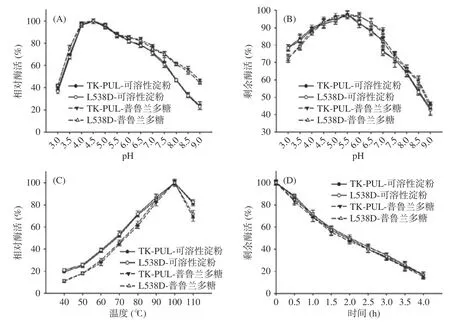
图2 TK-PUL 和突变体L538D 的酶学性质Fig.2 Enzymatic properties of TK-PUL and the mutant L538D
2.5 TK-PUL 及L538D 的动力学常数测定
本研究测定并比较了TK-PUL 及突变体L538D于100 ℃的动力学常数,依此来确定TK-PUL 中L538D 位点变化对其底物结合能力和底物降解能力的影响。由表4 可知,以可溶性淀粉或普鲁兰多糖为底物时,与TK-PUL 相比,突变体L538D 的K值基本不变,k值均明显提高。其中以可溶性淀粉为底物时,突变体L538D 的k/K值提高了44%;以普鲁兰多糖为底物时,突变体L538D 的k/K值提高了27%。以上结果表明,TK-PUL 中L538D 位点变化不影响TK-PUL 对底物的结合能力,并有利于提高其对底物的降解能力,特别有利于提高其对可溶性淀粉的降解能力。
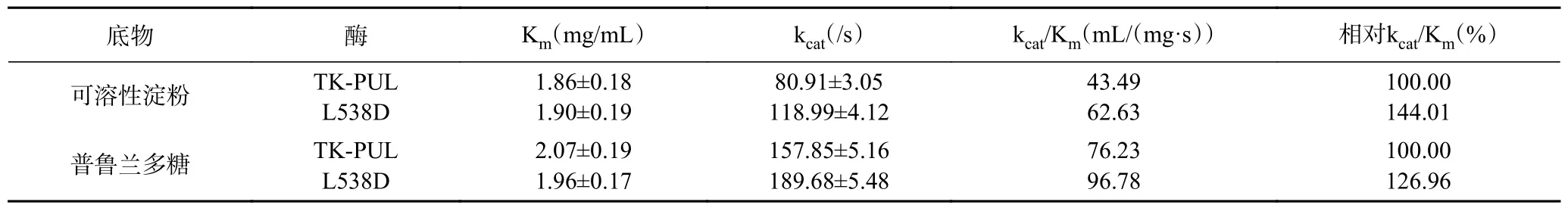
表4 TK-PUL 及突变体L538D 的动力学常数Table 4 Kinetic parameters of TK-PUL and the mutant L538D
2.6 突变位点分析与分子结构模拟
以TK-PUL(PDB ID:5OT1)的蛋白质分子结构为模板,采用Swiss-Model 同源模建突变体L538D的蛋白质分子结构。采用三维图像软件PyMOL v2.5.2 显示TK-PUL 及突变体L538D 的三级结构。由图3(A1)可知,TK-PUL 具有糖苷水解酶第13 家族酶分子结构和催化机制上的共同特征,如三个结构域、四个高度保守的保守基序、保守的催化活性中心(Asp503、Glu534、Asp601)等。蛋白质的分子结构具有较强的稳定性,单个氨基酸残基的突变不会明显改变蛋白质分子的三维结构,所以突变体L538D与TK-PUL 的三级结构基本一致(如图3 所示)。由图3(A2)可知,TK-PUL 中Leu538 距离其催化活性中心和底物结合中心较远,无直接相互作用。本研究结果也表明,TK-PUL 中L538D 位点变化不影响其最适反应pH、pH 稳定性、最适反应温度及热稳定性。因此蛋白质分子结构对比分析结果与本研究实验结果是相对应的。但是已有研究结果表明,催化活性位点附近的氨基酸残基的侧链大小以及侧链性质影响酶分子水解糖苷键的活性和特异性。Leu538邻近催化活性位点Glue534,两者均位于同一loop 结构上。TK-PUL 中L538D 位点变化可能通过缩短氨基酸残基侧链的长度和减弱氨基酸残基的疏水性,改变催化活性位点Glu534 所在loop 结构的柔性,进而提高酶的催化活性。
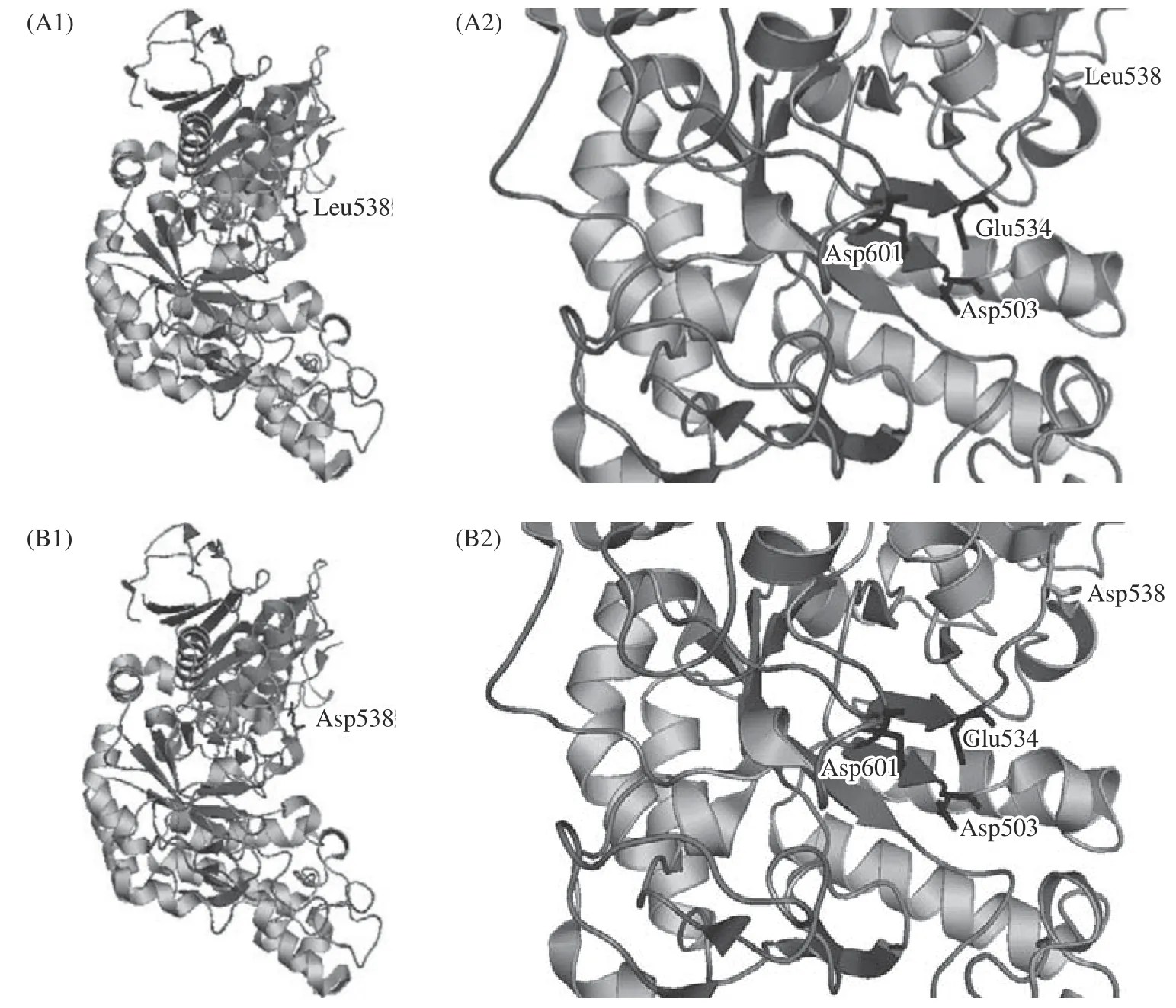
图3 TK-PUL 和突变体L538D 的三级结构模拟图Fig.3 Three-dimensional modelling of TK-PUL and the mutant L538D
3 结论
本研究采用易错PCR 技术对III 型普鲁兰多糖水解酶TK-PUL 进行体外定向进化,获得催化活性提高的突变体L538D。TK-PUL 中Leu538 是影响其催化效率的重要氨基酸残基。将TK-PUL 中催化活性位点Glu534 邻近的氨基酸残基Leu538 替换为侧链长度更短并且极性更强的氨基酸残基Asp538,有利于提高TK-PUL 的催化活性。突变体L538D有望应用于“液化糖化一步法”的淀粉制糖工艺,可极大地简化淀粉酶法制糖工艺和提高生产效率。本研究也可为其他淀粉水解酶以应用为导向的分子改造提供理论依据和设计思路。
