猪血管紧张素转换酶2 的分离纯化及性质研究
2022-09-13刘维维张凌晶纪梦雅翁凌张志刚刘光明曹敏杰
刘维维,张凌晶,纪梦雅,翁凌,张志刚,刘光明,曹敏杰,
(1.集美大学海洋食品与生物工程学院,福建厦门 361021;2.肉食品安全生产技术国家重点实验室,福建厦门 361100)
血管紧张素转换酶2(ACE2,EC 3.4.17.23)是血管紧张素转换酶(ACE,EC 3.4.15.1)的同源酶,两者共同参与血压调节系统的稳定平衡。ACE2 对多种生物活性肽具有水解活性,并优先裂解以Pro-X 结尾的肽段的末端氨基酸残基(X 为疏水性氨基酸),如Ang II(DRVYIHPF)、Apelin-13(QRPRLSHKGPMPF)等。Ang II 是高血压系统中的关键调节因子之一,ACE2 可水解Ang II 生成Ang(1-7),进而作用于G 蛋白偶联受体Mas 受体,从而发挥舒张血压、抗氧化损伤、抗炎等作用,对抗平衡由ACE-Ang Ⅱ-AT1 受体系统介导的升压效应,并发挥减缓肠道内的炎症反应及氧化损伤等功能。除此之外,ACE2 还可协调肠道内氨基酸的转运和葡萄糖的稳态。
近年来,随着对ACE2 在高血压系统中作用研究的深入,关于食源性降压产品的研究不再局限于ACE 抑制肽,ACE2 激活肽的研究日益受到关注。Liao 等发现,蛋清蛋白中提取的一种可显著降低原发性高血压大鼠(Spontaneously Hypertensive Rats,SHRs)血压的三肽IRW,其降压途径并非抑制ACE,而是通过上调ACE2 发挥降压作用。这表明以激活ACE2 为目的开发降压产品有望成为高血压防治的新靶点。有研究发现,ACE2 激动剂氧杂蒽酮类化合物(Xanthenone,XNT)可与ACE2 结合,打开其相对封闭的构象使更多的底物进入,且能显著降低原发性高血压大鼠(SHRs)的血压。这表明以激活ACE2 为靶点制备新型降血压产品是一种新途径,而食源性肽是ACE2 激活产品的良好来源。
ACE2 的组织分布广泛,在肾脏、心脏、睾丸、肠道等组织均有表达,主要分布于冠状动脉、肾血管内皮和肾小管内皮。前期的研究者通过分子生物学技术克隆并表达了人源、猪源以及牛源等动物的ACE2,而天然ACE2 由于含量低、纯化难度大等问题,其分离纯化以及性质研究鲜有报道。因此,本研究拟优化天然ACE 的纯化方法,以猪肾实质为原材料分离纯化猪ACE2 并对其酶学性质进行研究,为以ACE2 活性为靶点的食源性功能食品的开发提供参考。
1 材料与方法
1.1 材料与仪器
新鲜猪肾脏、胰、脾、大肠、小肠、胃、心、脑及肺组织 厦门银祥食品有限公司,为排除个体差异,每个组织取样三份,分别来源于三头猪;DEAESepharose、HiTrap Phenyl Sepharose、HiTrap Q-Sepharose 层析柱 GE Healthcare 公司;荧光底物Mca-Ala-Pro-Lys(Dnp)-OH(MCA-APK)GLPBIO 公司;7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)Peptide Institute 公司;兔抗人ACE2 单克隆抗体 ABclonal 公司;兔抗-actin 单克隆抗体Cell Signaling Technology 公司;HRP 标记的羊抗兔IgG 抗体 Pierce 公司;SDS 标准蛋白 Fermentas 公司;PAS 染色试剂盒 Solarbio 公司;其他试剂均为国产分析纯,国药集团化学试剂有限公司。
Avanti J-26SXP 高速冷冻离心机 美国Beckman公司;G:BOX 凝胶成像仪 英国Synegene 公司;Fluor ChemQ 化学发光成像仪 美国Alpha Innotech公司;Chirascan 圆二色谱仪 英国Applied Photophysics;M200 PRO 多功能酶标仪 奥地利Tecan公司;AKTA 蛋白及多肽纯化装置 美国GE Healthcare 公司;Nanodrop 100 微量蛋白核酸测定仪 美国Thermo Fisher Scientific 公司;JS-Power 600 电泳仪 中国培清科技。
1.2 实验方法
1.2.1 猪不同组织前处理 猪的肾、心、肝、脾、肺等组织在−18 ℃下预冻24 h 后常温流水解冻。每个组织共取15 g,洗去血水,用3 倍体积(w/v)的缓冲液A(50 mmol/L Tris-HCl,pH7.5)匀浆,而后加入0.7% Triton X-100(w/v)搅拌1 h,差速离心(0~8000×g,4 ℃,30 min)后取上清液,四层纱布过滤后的透过液即为样液。
1.2.2 免疫印迹(Western blot)分析ACE2 在不同组织中的存在 取上述样液,参考李婉玉等的方法进行实验操作。选择兔抗人ACE2 单克隆抗体(1:2000 稀释)作为一抗,内参蛋白以兔抗-actin 单克隆抗体(1:10000 稀释)作为一抗,HRP 标记的羊抗兔IgG(1:20000 稀释)作为二抗。用Image J 软件对图像进行灰度分析。
1.2.3 猪肾实质ACE2 的分离纯化
1.2.3.1 猪肾实质前处理 使用400 g 猪肾用于ACE2的分离纯化,处理过程均在4 ℃下进行。具体方法参考1.2.1。
1.2.3.2 酸沉淀及硫酸铵盐析 1.2.3.1 所得粗酶液用1 mol/L 盐酸缓慢调pH 至4.2,于50 ℃水浴加热20 min 后转移至37 ℃水浴2 h,冰水冷却后,离心(12000×g,4 ℃,30 min),四层纱布过滤后取透过液。透过液经终浓度2.1~2.7 mol/L(NH)SO盐析,所得沉淀立即用少量的缓冲液A 溶解后置于透析袋中,以同缓冲液A 在4 ℃充分透析以除去(NH)SO,透析期间更换3 次相同缓冲液。
1.2.3.3 柱层析分离纯化 透析后的粗酶液上样于预先以缓冲液A 平衡的DEAE-Sepharose 阴离子交换柱,采用含0~0.4 mol/L NaCl(800 mL)的缓冲液A作线性梯度洗脱,柱层析期间保持流速为1 mL/min。收集酶活力高且杂蛋白相对较少的组分在缓冲液B(50 mmol/L Tris-HCl,pH8.5)中充分透析。透析后上样于以缓冲液B 预先平衡的Q-HP(Q-High Performance)柱,依次用含0.125 mol/L(200 mL)、0.25 mol/L(220 mL)和0.5 mol/L NaCl(125 mL)的缓冲液B 进行梯度洗脱,柱层析期间保持流速为2 mL/min。收集酶活力较高的部分,选用30 kDa 浓缩管置换至缓冲液A 中,预先加入(NH)SO至终浓度为1.4 mol/L,上样于Phenyl-HP(Phenyl-High Performance)柱,依次用含1.05 mol/L(20 mL)、0.70 mol/L(NH)SO(35 mL)的缓冲液A 进行洗脱,柱层析期间保持流速为2 mL/min。将活性组分收集进行SDS-PAGE 验证纯度,并使用Western blot 进行验证,而后立即用于酶学性质分析。
1.2.4 ACE2 的活性测定 酶活力测定以MCAAPK 为底物,参照Sriramula 等的方法并略作修改,具体方法如下:在黑色酶标板中,将17.5 μL 待测酶液加入到80 μL 50 mmol/L Tris-HCl(pH7.0,含0.3 mol/L NaCl,10 μmol/L ZnCl)中并混匀,立即加入2.5 μL 底物MCA-APK 使其终浓度为10 μmol/L。在酶标仪中37 ℃下避光反应30 min 后,立即在激发波长320 nm,发射波长405 nm 下测定反应所释放产物的荧光强度,以7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)标准溶液对反应产物进行定量。
一个酶活力单位(U)定义为每分钟释放1 nmol AMC 所需的酶量。
1.2.5 蛋白含量测定 使用微量蛋白核酸测定仪测定蛋白样品在280 nm 的吸光值,以标准浓度的牛血清白蛋白为对照。
1.2.6 ACE2 的LC-MS/MS 分析 纯化过程中,对ACE2 的纯度进行SDS-PAGE 分析。用考马斯亮蓝染液对最终纯化的ACE2 凝胶进行染色,充分脱色后切胶回收目的蛋白条带,用LC-MS/MS 进行氨基酸序列鉴定,该工作委托深圳市微纳菲生物技术有限公司完成。
1.2.7 猪肾ACE2 酶学性质分析
1.2.7.1 温度对ACE2 活性的影响 ACE2 最适温度的测定:将适量的酶液在不同的温度下(15、20、25、30、35、40、45、50、55、60、65、70 ℃)进行酶促反应,按照酶活检测方法,测定酶活。
ACE2 热稳定性的测定:将适量的酶液与50 mmol/L Tris-HCl 缓冲液(pH7.0,含0.3 mol/L NaCl,10 μmol/L ZnCl)混合后,置于不同温度下(0~70 ℃)孵育20 min,立即在冰水中冷却,按照酶活检测方法在37 ℃下测定ACE2 的剩余酶活力。
1.2.7.2 pH 对ACE2 活性的影响 ACE2 最适pH的测定:将适量的酶液在不同的pH 条件下(5.0、6.0、7.0、8.0、9.0、10.0)进行酶促反应,按照酶活检测方法,在37 ℃下测定酶活。
ACE2 的pH 稳定性测定:将适量的酶液与不同pH 的缓冲液混合后,置于4 ℃孵育30 min,按照酶活检测方法,在37 ℃,pH7.0 下测定ACE2 的剩余酶活力。
1.2.7.3 ACE2 的热变性温度分析 采用圆二色谱法(Circular dichroism,CD)分析热变性和冷却复性过程中ACE2 二级结构的变化。操作前将ACE2 酶液置换至不含盐的缓冲液中,蛋白浓度为0.3 mg/mL,扫描温度范围为20~90 ℃,速率为0.5 ℃/min,以1 nm的光谱间隔从190~260 nm 对样品进行测定。通过Global3 软件对ACE2 的热变性温度Tm 进行预测。
1.2.7.4 金属离子对ACE2 活力的影响 在ACE2酶液中,加入不同金属离子(Zn、Fe、Ca、Ba、Cu、Cd、Na、Co、Mn)至终浓度为1 mmol/L。在4 ℃下孵育30 min 后,立即按照酶活检测方法测定剩余酶活力。其中,对照组以50 mmol/L Tris-HCl(pH7.0)代替金属离子溶液。
1.2.7.5 抑制剂对ACE2 活力的影响 将ACE2 与不同蛋白酶抑制剂(EDTA,1,10-Phenanthroline,Pepstatin A,AEBSF,Leupeptin,E-64,Benzamidine)在常温下孵育30 min,然后测定其剩余酶活力。对照组不添加蛋白酶抑制。
1.2.7.6 PAS 染色法鉴定糖蛋白 将纯化的ACE2上样于10% 的SDS-PAGE,电泳后,按照PAS 染色试剂盒的说明对凝胶进行染色。
1.3 数据处理
采用Excel 2013 软件对数据进行整理,应用GraphPad Prism 5 软件进行绘图,使用Adobe Illustrator CS5 处理图像,所有实验数据均重复3 次进行测定,并取其平均值±标准差。
2 结果与分析
2.1 ACE2 在猪不同组织中的分布
利用Western blot 法分析ACE2 在猪不同组织中的分布。如图1,结果发现,ACE2 按蛋白表达水平从多到少依次为肾,小肠,肝,胃;在脑、肺、大肠、胰脏中几乎没有ACE2 的存在。王珊珊等通过RT-PCR 和免疫组化方法对仔猪不同组织中ACE2分布进行分析,结果显示ACE2 mRNA 在仔猪肾脏、小肠及胃底中显著表达,另外在十二指肠、空肠及结肠中表达量较高,与本研究从蛋白水平分析的结果相似。
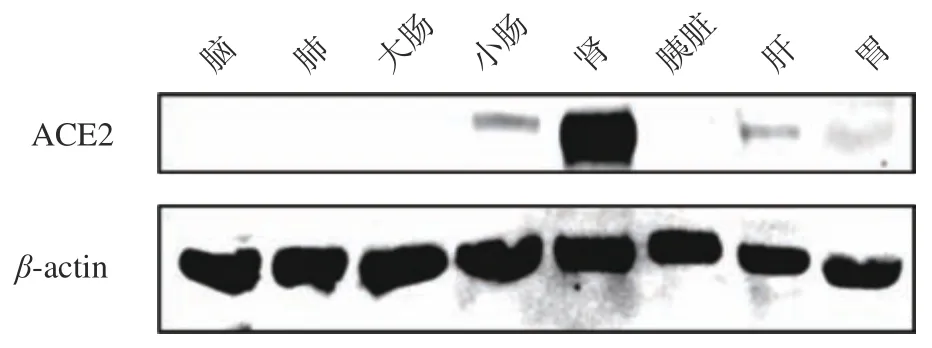
图1 ACE2 在猪不同组织中分布的免疫印迹分析Fig.1 Western blot analysis of ACE2 distribution in different tissues of porcine
2.2 ACE2 的分离纯化与免疫印迹
在纯化时选用Triton-X100 增加ACE2 溶解性,经酸沉淀和硫酸铵盐析去除部分杂蛋白后得到ACE2 粗酶液。ACE2 粗酶液经DEAE-Sepharose阴离子交换柱初步纯化,收集活性较高且杂蛋白较少的组分,经透析后上样于Q-Sepharose 强阴离子交换柱,在0.25 mol/L NaCl 时目的蛋白被洗脱下来(图2)。活性组份继续上样于Phenyl Sepharose 疏水柱,最终在0.7 mol/L(NH4)SO的洗脱部分酶活峰与蛋白峰重叠,获得目的蛋白(图2C)。SDS-PAGE 分析显示,纯化蛋白分子量为98 kDa(图2D),Western blot表明抗ACE2 单克隆抗体能与该蛋白产生特异性反应(图2E)。对ACE2 的纯化结果如表1 所示,从400 g 猪肾实质中纯化得到0.6 mg ACE2,得率为0.1%,纯化倍数为149.8 倍(表1)。

表1 猪肾ACE2 纯化结果Table 1 Purification of angiotensin converting enzyme 2 from porcine kidney

图2 ACE2 的柱层析纯化、SDS-PAGE 及免疫印迹分析Fig.2 Column chromatography purification,SDS-PAGE and Western blot analysis of ACE2
2.3 ACE2 的质谱鉴定
将纯化得到的ACE2 蛋白条带切胶回收,经胰蛋白酶酶切后得到的多肽样品上样于LC-MS/MS,共得到41 个肽段,含386 个氨基酸残基。通过Uniprot 下载的Sus scrofa 蛋白数据库进行检索,得到的结果如图3 所示,酶解后得到的41 个肽片段与猪的ACE2(NP_001116542.1)序列高度一致,表明纯化的蛋白为猪ACE2。
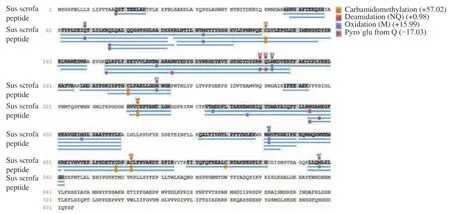
图3 纯化ACE2 的液相色谱-串联质谱分析Fig.3 LC-MS/MS analysis of the purified ACE2
2.4 ACE2 的酶学性质分析
2.4.1 最适温度与热稳定性 ACE2 的最适温度为40 ℃(图4A),该结果与多数哺乳动物体内的温度为35~40 ℃相对应,表明ACE2 在该温度附近能够发挥其最高的酶活力。
当温度在15~50 ℃时,ACE2 的酶活力较为稳定,相对酶活在90%以上,而当温度升高至55 ℃时,ACE2 的相对酶活开始下降,到60 ℃时下降至15%左右,到70 ℃时几乎完全丧失酶活,表明ACE2 的耐热性较差(图4A)。
2.4.2 最适pH 与pH 稳定性 ACE2 在pH7.0 时的活性最高,当pH 高于或低于7.0,ACE2 的相对酶活明显下降,在pH10.0 时酶活基本丧失,表明ACE2在中性偏酸的环境中更宜发挥其活性(图4B)。该结果与报道的在Sf9 昆虫细胞中表达纯化的重组人ACE2 的最适pH 为6.5 相似。
对ACE2 的pH 稳定性分析发现,当pH 在5.0~7.0 的范围内,ACE2 的稳定性较好,相对酶活保持在80%以上,pH 为6.0 时ACE2 的活性最高。而当pH 上升至10.0 时ACE2 的相对酶活仅有50%左右,表明其在中性偏酸的环境相对稳定(图4B)。

图4 温度(A)和pH(B)对猪肾ACE2 活性的影响Fig.4 Effect of temperature (A) and pH (B) on the activity of ACE2
2.4.3 ACE2 热变性分析 为了研究温度对猪ACE2二级结构的影响,对纯化ACE2 进行圆二色谱扫描分析,扫描波长范围为190~260 nm。如图5 所示,通过Global 3 软件对ACE2 的热变性温度(Tm)进行预测,其Tm 值为(67.5±0.1)℃,即当环境温度在67.5 ℃附近时,ACE2 的氢键和范德华力会受到破坏,从而导致其构象开始发生变化(图5A)。图5B显示了加热前后以及回温后ACE2 的结构变化,当温度升高至90 ℃时,与天然状态下即30 ℃时的二级结构对比有较大的差异,此时ACE2 的二级结构已经被破坏,当温度回复至30 ℃时无法恢复至天然状态下的结构,表明90 ℃加热可导致ACE2 的不可逆变性。

图5 圆二色谱法检测温度对ACE2 结构的影响Fig.5 Effect of temperature on the structure of ACE2 as detected by CD spectrum
2.4.4 金属离子对ACE2 相对酶活的影响 金属离子对于酶的表达和调控具有重要的作用,某些金属离子对酶有催化作用,而一些金属离子,如重金属离子Cu、Pb等,在低浓度时会对某些酶产生抑制作用,高浓度时会使酶变性失活。表2 总结了不同金属离子在同一浓度(1.0 mmol/L)下对ACE2 酶活的影响,其中Zn、Na、Co及Mn对ACE2 的酶活有一定的激活作用,Zn的激活作用最强。Cd对ACE2 的酶活有一定的抑制作用,Cu和Fe几乎能完全抑制ACE2 的活性。

表2 金属离子对ACE2 活性的影响Table 2 Effect of metal ions on the activity of ACE2
2.4.5 抑制剂对ACE2 活性的影响 如表3,金属蛋白酶抑制剂EDTA,1,10-Phenanthroline 几乎能完全抑制ACE2 的活力,而其他抑制剂如丝氨酸蛋白酶抑制剂AEBSF、Leupeptin 及Benzamidine,胃蛋白酶抑制剂Pepstatin A,半胱氨酸蛋白酶抑制剂E-64 对ACE2 的活力无明显影响。这些结果反映了ACE2具备金属蛋白酶特性,与Donoghue 等发现ACE2有潜在金属蛋白酶锌结合位点的结果类似。
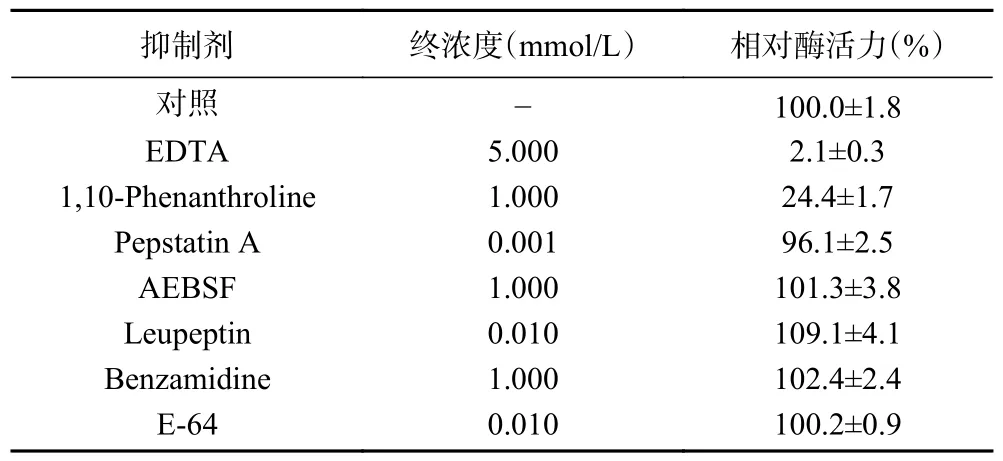
表3 抑制剂对ACE2 活力的影响Table 3 Effect of inhibitors on ACE2 activity
2.4.6 糖蛋白鉴定 目前对于糖蛋白的鉴定通常采用PAS 染色法,即通过高碘酸与Schiff 碱的氧化还原反应形成明显的红色复合物进行鉴别。对ACE2进行PAS 染色鉴定是否为糖蛋白,结果如图6 所示。ACE2(泳道3)与阳性对照二肽基肽酶(Dipeptidyl Peptidase Ⅳ,DPP-Ⅳ)(泳道1)同显示为一条红色条带,而阴性对照牛血清白蛋白(Albumin from bovine serum,BSA)(泳道2)则不显示红色条带,表明ACE2 是糖蛋白。蛋白质的糖基化,除了结构特征不明显的O-糖基化外,还有结构特征为N-X-S(T)(X 代表任何一种氨基酸)的N-糖基化,而ACE2 中具有该结构特征的位点有多个(图3)。

图6 PAS 染色结果Fig.6 Result of PAS staining
3 讨论
前期对ACE2 的研究工作中,Lin 等通过硫酸铵盐析,Q-Sepharose,Phenyl-Sepharose,DEAESepharose,SP-Sepharose 和Superose HR 等多种柱层析结合的方法从人心脏左心室膜中分离纯化出了ACE2 与整合素1 的复合物,分子量为130 kDa,但得率仅为0.0006%。该方法存在流程繁琐、得率低等问题。为了建立更加有效的天然ACE2 纯化方法,本研究利用免疫印迹法从蛋白水平探究了猪不同组织中ACE2 的分布差异。以ACE2 蛋白水平最高的肾脏为原材料优化条件,采用Triton-X100 增加ACE2溶解性,简化了柱层析步骤,最终实现了ACE2 的高度纯化。纯化ACE2 的分子量约为98 kDa,得率为0.1%。
不同物种的ACE2 分子量在60~130 kDa 不等,其分子量的差异可归因于不同程度的糖基化。糖基化是蛋白质翻译后修饰的方式之一,在哺乳动物体内超过50%的蛋白质都会发生糖基化。本研究纯化的猪ACE2 在SDS-PAGE(图2D)及免疫印迹(图2E)中显示其分子量约为98 kDa,比重组猪ACE2(92 kDa)略高,提示天然ACE2 在合成及转运过程中可能发生了糖基化、磷酸化等翻译后修饰。PAS 染色结果证实了猪ACE2 是一种糖蛋白(图6)。实际上,蛋白质糖基化具有识别定位、稳定蛋白质构象和信息传递等作用。
金属离子作为蛋白酶结构的一部分或作为酶激活因子,对蛋白酶的稳定性有重要的影响。ACE2 是锌离子蛋白酶家族成员,含有一段高保守的锌结合序列,本研究结果也表明Zn能显著激活其酶活性。质谱结果同样显示,ACE2 的第374~378位氨基酸残基为HEMGH,该片段为ACE2 的锌结合序列,与其功能和活性相关。另外,第402 位的谷氨酸高度保守,与第374 位的组氨酸同为ACE2的锌离子配体,Zn与ACE2 的这些残基位点形成配位键,对ACE2 的催化起重要作用。
蛋白质的结构和稳定性在决定其生理功能方面起着至关重要的作用,影响其结构的外在因素主要有pH、温度、盐浓度等。猪ACE2 与ACE 的热变性温度分别为67.5 与58.5 ℃。当温度达到50 ℃时,ACE 的活性急剧下降,而ACE2 仍能保持90%的活性,表明ACE2 的热稳定性更好。蛋白酶的稳定性通常与自身的结构相关联,酶的活性位点是决定温度对酶的重要影响因素之一。Towler等对重组人ACE2 胞外区域的晶体结构进行了解析,结果表明除了一些活性氨基酸被ACE2 的某些氨基酸替代外,ACE 的S2 活性口袋被ACE2 的Arg覆盖,导致ACE2 的活性区域比ACE 狭小,这些区别使得两者在水解底物及其他性质方面有差异。作为与高血压密切相关的2 种酶,分析ACE2与ACE 在结构上的差异以及糖基化程度等,对于了解它们的酶学性质进而开发降血压产品具有重要意义。
4 结论
对猪不同组织比较发现,猪肾中ACE2 含量最高,其分子量约为98 kDa,是一种典型的金属蛋白酶。ACE2 的最适pH 为7.0,最适温度为40 ℃,变性温度为67.5 ℃。ACE2 含一个HEMGH 锌离子结合域和第402 位的谷氨酸锌离子结合配体。在锌离子存在下,其活性增加62%。部分金属离子如Cu、Fe和Cd对ACE2 的活性有抑制作用。ACE2 是糖基化蛋白,这也是其稳定性较好的一个因素。本研究为高效纯化天然ACE2 提供了技术参考,为开发以ACE2 为靶标的功能性食品提供了思路。
